-
人类活动产生的氮(N)排放引起大气N沉降持续增加,已经成为全球性的环境问题。近30 年来,我国N沉降总量持续增加[1],尽管近10 年来增加趋势有所缓和,仍成为除欧洲和北美之外的第三大沉降区[2]。东部沿海地区是我国N沉降最严重的区域之一,N沉降速率均值已超过50 kg·hm−2·a−1[2]。大量含N化合物通过湿沉降和干沉降的形式降落到陆地表面,对森林生态系统养分循环产生巨大而深远的影响[3-4]。
根系在植物生态系统中扮演着不可或缺的角色,其化学计量特征是植物重要的功能性状之一,对认识植物对环境变化的适应策略具有重要作用[5-7]。通常情况下,直径小于2 mm的根被视作细根,直径大于2 mm的根被视为粗根[8-11]。以往的研究表明,细根与粗根在植物地下系统中行使着不同的功能,其化学计量特征、形态、周转等都存在高度异质性[9, 12-14]。
N沉降通过影响土壤N养分有效性间接改变了植物的养分限制[15-16],进一步对植物地上与地下部分以及不同组分的光合产物和N、磷(P)元素分配格局产生影响[17-19],可能导致细根与粗根间碳(C)、N、P计量特征对N添加响应产生差异,但目前这方面的研究相对较少,且结论也存在差异[20-21]。前期研究发现,N添加显著增加油松(Pinus tabuliformis Carr.)细根N含量,对粗根N含量无显著影响[20];对榆树(Ulmus pumila L.)的研究则发现,N添加均显著增加细根和粗根N含量[4]。细根是根系吸收土壤水分和养分最活跃的部分,其根尖细胞分裂旺盛,代谢活跃[21],而粗根对土壤水分、养分供应的变化相对不敏感。
水杉(Metasequoia glyptostroboides Hu et W. C. Cheng)是杉科(Taxodiaceae)速生落叶树种,具有涵养水源、改善土壤性质的功效,是我国东部泥质海岸防护林的主要树种之一。在作者之前的研究中,N沉降试验集中于水杉地上部分的影响,未曾展开对地下部分的研究[22]。为此,本研究以N沉降严重的区域东部沿海主要造林树种水杉为研究对象,进行N添加试验,分析水杉不同径级根系C、N、P计量特征对N添加的可塑性响应,揭示不同N添加量下细根和粗根N、P养分分配格局的变化,为科学认识水杉对N沉降的适应策略提供参考。
-
试验地位于江苏省东台市林场(120°07′~120°53′ E,32°33′~32°57′ N),属亚热带和暖温带的过渡区,热量充裕,雨量充沛。年平均气温14.6 ℃,年平均相对湿度88.3%,年蒸发量 911.9 mm,年均无霜期220 d,年日照时数2 209 h,年均降水量1 050 mm。土壤质地为砂质壤土。该林场总面积约2 867 hm2,森林覆盖率为86%,主要树种为水杉、I-72杨树(Populus euramericana cv. I-72)等。水杉人工林样地基本情况见表1。
表 1 水杉人工林样地基本情况(2014年)
Table 1. The basic situation of M. glyptostroboides plantations plot (in 2014)
林分结构
Stand structure土壤理化性质
Soil physical and chemical properties平均树高
Average
tree
height/
m林分密度
Stand
density
(株·hm−2)冠幅
Crown
width/
m含水量
Moisture
content/
%总孔隙度
Total
porosity/
%毛管孔隙
Capillary
porosity/
%有机碳含量
Organic
carbon
content/
(g·kg−1)全氮含量
Total
nitrogen
content/
(g·kg−1)水解氮含量
Alkali-hydrolyzable
nitrogen
content/
(mg·kg−1)全磷含量
Total
phosphorus
content/
(g·kg−1)有效磷含量
Available
phosphorus
content/
(mg·kg−1)10.33±1.83 417 4.61±0.65 22.85±1.71 44.09±2.81 42.46±3.68 8.19±0.38 0.71±0.01 54±4.27 0.85±0.03 14.27±3.91 -
2014年,在试验区分别选取立地条件和经营水平一致的6年生水杉人工林,建立3个300 m × 100 m的样地,并在每个样地中建立4个20 m × 30 m的样方,样方间间隔超过10 m,采用完全随机区组设计,设计4个N添加处理,每个处理3个重复,共计12个试验小区。参照研究区域大气N沉降量[2],以及同类研究通用的施N量成倍增加的方法[3],设置4个N添加处理:对照(CK,0 kg·hm−2·a−1)、低N(LN,56 kg·hm−2·a−1)、中N(MN,168 kg·hm−2·a−1)、高N(HN,280 kg·hm−2·a−1)。2015年,按照N含量折算后的CO(NH2)2,分两次在水杉样方内撒施,第1次在3月底至4月初,添加总量的60%,第2次在6月中旬,添加总量的40%,此后每年均按照2015的施肥方式持续施肥及样地监测。各处理水杉人工林的生长情况见表2。
表 2 各处理水杉人工林的胸径(2015年)和胸径生长量(2015—2019年)
Table 2. DBH in 2015 and DBH growth in four years of the M. glyptostroboides plantations of various treatments
项目
ItemN添加 N addition CK LN MN HN 胸径 DBH/cm 17.80±0.86 18.46±0.69 17.85±1.13 18.47±0.53 胸径生长量 DBH growth/cm 4.80±1.52 c 6.12±1.98 b 6.99±1.89 a 6.46±1.61 ab 注:不同小写字母为不同处理下胸径(胸径生长量)差异显著(P<0.05)。
Note: Different lowercase letters indicate significant differences in DBH (DBH growth) at various treatments at 0. 05 level. -
2018年9月下旬,调查样地内每株树木的胸径,计算平均胸径,在每个样方均选取3株接近于平均胸径的树木作为标准木。在3株标准木1.5 m范围内刮去地表异物,在树干基部找到从基部延伸出的侧根,将整条侧根从土壤中挖出,清除根表面的土壤和杂质(其余标准木均按此方式获取根系),并将挖取的侧根混合装进贴有标签的封口袋中并标号,放入保温箱(4 ℃)带回实验室(取样中尽量避免末端低级根的损失,以保证根系构型的完整性),用蒸馏水轻轻将根系表面附着物洗去。根据根系的颜色和外形(死根黑色且干瘪)等区分出活死根,直径<2 mm的根视为细根,2 mm≤直径≤5 mm的根视为粗根,并分别用滤纸包好标记后将其置于烘箱内,105 ℃杀青1.5 h后,70 ℃烘干至恒质量(约48 h),打磨粉碎。然后将植物细根和粗根分别过0.25 mm筛,选取均匀样品后放入干燥器中保存,供养分含量测定。
在地下树木根系收获完成后,在每个样地内,以S型选取5个点,去除地面枯枝落叶层,使用内径3.8 cm的土钻,钻取0~20 cm土壤充分混合均匀后过2 mm筛,去除植物残根和石块,带回实验室用于后续养分含量测定。
细根和粗根C含量和土壤有机碳含量采用重铬酸钾外加热法测定,细根和粗根N含量和土壤全氮含量采用半微量凯氏定N法测定,土壤水解氮含量采用KCl溶液浸提比色法测定,细根和粗根P含量和土壤全磷含量采用钼锑钪比色法测定,土壤有效磷含量采用碳酸氢钠浸提法测定[23]。
-
参考Valladares等[24]的方法,计算细根和粗根C、N、P化学计量特征的可塑性响应指数,即可塑性响应(%)=
$ \left|\left(\mathrm{N}\mathrm{处}\mathrm{理}-\mathrm{对}\mathrm{照}\right)/\mathrm{对}\mathrm{照}\times 100\mathrm{\%}\right| $ 。试验数据在Microsoft Excel 2019和Origin 2018软件中进行整理和图表制作。采用单因素(One-way ANOVA)方差分析,分析各处理间土壤C、N、P含量、细根和粗根C、N、P计量特征以及其可塑性响应的差异、相同处理细根和粗根间C、N、P计量特征以及其可塑性响应的差异,以上分析皆在SPSS 23.0统计软件中进行。
-
由表3可知,N添加对水杉人工林土壤中不同存在形式的N的影响存在差异,且N添加量不同,产生的影响程度也不同。随着N添加量的增加,土壤有机碳含量呈现先增加后下降的趋势,且在MN处理达到最高,增幅达到38.29%,LN和HN处理与CK处理间无显著差异。N添加在一定程度上提高了土壤全氮含量(P>0.05),在不同施N浓度中,土壤全氮含量增幅分别为7.78%、16.86%和15.06%,但与对照相比无显著差异(P>0.05)。然而,土壤水解氮含量随N添加量的增加先迅速上升后平稳增加,与对照相比,在MN、HN处理下差异显著(P<0.05),各N处理下土壤水解氮含量增幅分别为29.12%、56.76%和60.99%。N添加对土壤全磷含量、有效磷含量和pH值均无显著影响(P>0.05)。
表 3 不同N添加量对土壤pH值和养分含量的影响
Table 3. Effect of N addition on the soil pH and C, N, P concentrations
处理
Treatment土壤pH
Soil pH有机碳含量
Organic
carboncontent/
(g·kg−1)全氮含量
Total
nitrogencontent/
(g·kg−1)水解氮含量
Alkali-hydrolyzablenitrogen
content/(mg·kg−11)全磷含量
Total
phosphoruscontent/
(g·kg−1)有效磷含量
Availablephosphorus
content/(mg·kg−1)CK 7.70±0.23 a 4.30±0.06 b 0.61±0.05 a 49.05±1.34 b 0.86±0.05 a 13.37±1.45 a LN 7.80±0.24 a 4.90±0.13 ab 0.66±0.04 a 63.33±8.25 ab 0.87±0.04 a 11.75±3.38 a MN 7.60±0.18 a 5.95±0.58 a 0.72±0.14 a 76.89±6.84 a 0.84±0.05 a 13.03±2.41 a HN 7.60±0.21 a 5.30±0.74 ab 0.70±0.11 a 78.90±15.66 a 0.90±0.05 a 15.93±2.64 a 注:不同小写字母为不同处理下土壤C、N、P含量差异显著(P<0.05)。
Note: Different lowercase letters indicate significant differences in C, N, P concentrations of soil at various treatments at 0. 05 level.试验结果表明,N添加对水杉人工林土壤有机碳和水解氮含量存在明显促进作用,且随着N添加量增加,这种促进作用有所减弱。
-
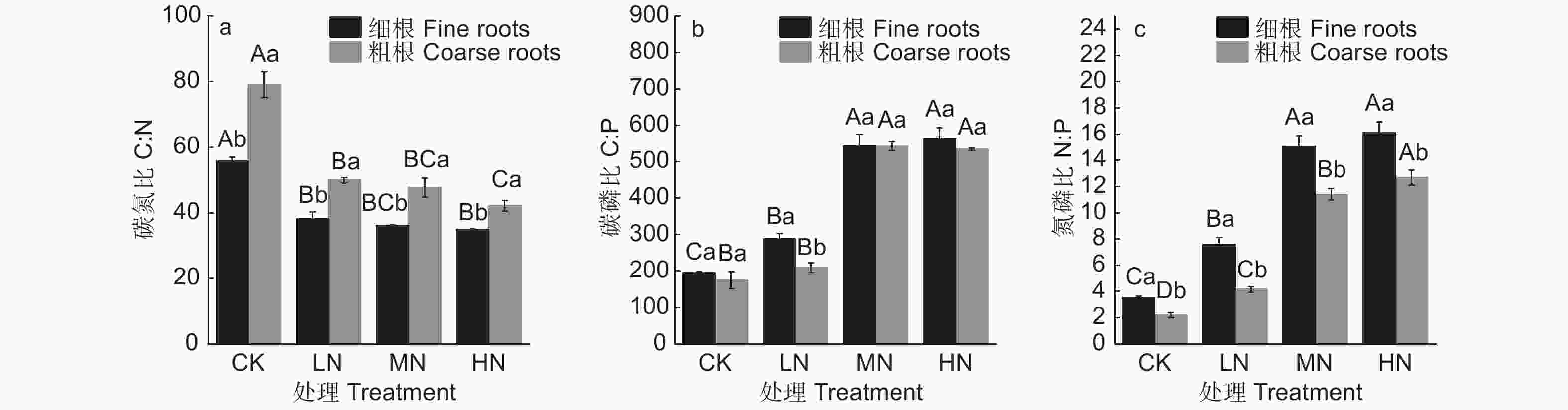
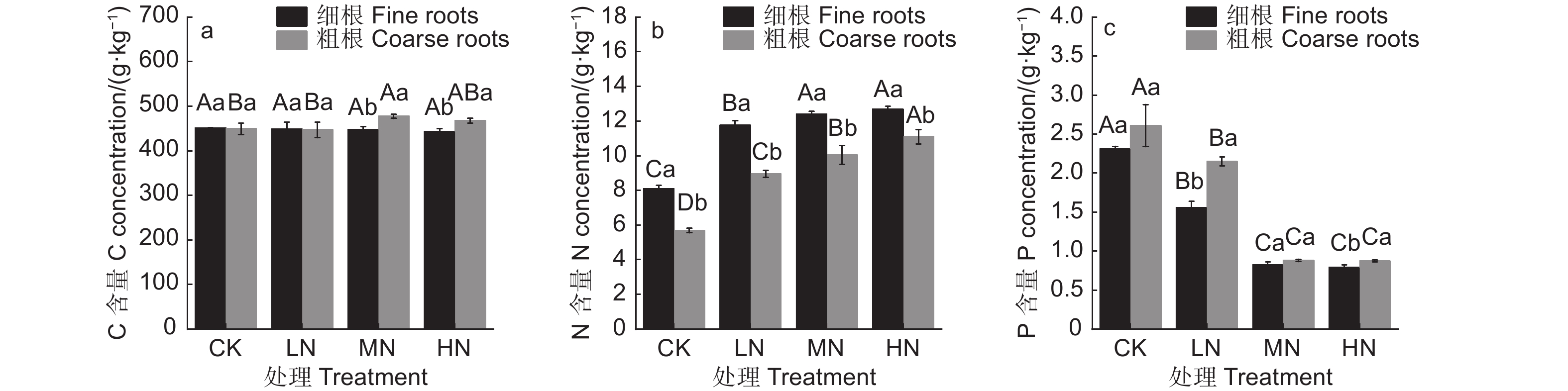
随着N添加量的增加,水杉细根C含量无明显变化(图1a,p>0.05),粗根C含量呈现增加趋势(P>0.05),仅在MN处理下C含量显著高于CK和LN处理,表明C作为植物的结构性物质,对N添加的响应较低。N添加明显促进了细根和粗根的N含量(图1b,P<0.05),然而细根N含量在MN和HN处理间无显著差异,粗根N含量在各N添加量间均存在显著差异,说明了低中N添加量下细根和粗根N含量对N添加的响应基本一致,然而高N添加量下,细根对N添加的响应减弱,水杉吸收的N元素更多地储存于粗根中。此外,N添加显著降低了细根和粗根的C:N(图2a,P<0.05),细根C:N的降幅为30.8%、35.2%和37.4%,粗根C:N的降幅为36.9%、39.7%和46.7%;N添加显著提高了细根和粗根的N:P(图2b,P<0.05),各N添加量下粗根N:P分别是CK处理的1.90、5.18和5.77倍,细根N:P 分别是CK处理的2.13、4.29和4.59倍,反映了由于水杉对N元素分配机制的变化,细根C:N和N:P在高N添加量下同样对N添加的响应减弱。随着N添加量的增加,细根和粗根P含量显著降低(图1c,P<0.05),C:P显著增加(图2c,P<0.05),且细根和粗根的P含量和C:P在MN和HN处理间均无显著差异。
-
随着N添加量的增加,除了C:N,水杉细根和粗根C、N、P化学计量特征可塑性响应均显著增加(图3,P <0.05),MN和HN处理下N含量、P含量、C:P和N:P可塑性响应显著高于LN处理,且MN和HN处理间无显著差异,说明N添加促进了根系对N元素的吸收,相对降低了P元素的吸收,且随着N添加量的增加,N、P元素计量特征变化趋缓。粗根N含量和C:N可塑性响应在HN处理下显著高于细根,粗根N:P可塑性响应在MN和HN处理下均显著高于细根,然而N添加对细根与粗根间P含量和C:P的可塑性响应均无显著影响,同样表明高N添加量下水杉N元素分配格局发生了变化。
-
土壤是树木生长的基础,是树木生长发育所需N、P、K和微量元素等矿质养分的主要供给者。其中N和P被认为限制树木生长的主要元素[25],研究表明,外源元素添加能够提高土壤中树木所需元素含量,进而缓解营养元素对树木生长的限制作用[26]。在前期研究中,Wang等[27]通过化学计量内稳性理论证实了研究地水杉林生长受到N限制。N元素参与植物能量代谢、呼吸作用、光合作用以及碳水化合物的运输等生理生化过程,并在植物生长的初级阶段对营养生长有着更加明显的促进作用。在本研究中,N添加显著提高了土壤水解氮含量 ,土壤水解氮含量由49.05 mg·kg−1提升到78.90 mg·kg−1,同时,N添加显著促进了水杉胸径生长,胸径生长量由4.90 cm提升到6.99 cm。因此,N添加后水杉林的N限制状况得到有效缓解,进一步促进了其生长发育。王建宇等[28]研究指出,低水平N添加会促进乔木快速生长,但高水平N添加会减弱对乔木生长的促进作用,这与本研究的研究结果一致,幼龄水杉生长随N添加量的增加呈现先增加后下降的趋势,在MN处理达到最快。这种结果的产生可能是高水平N添加容易引起树木对N元素的过量吸收[29-30],导致树木内部C、N、P化学计量的不平衡(尤其是N和P元素间的不平衡),从而产生其它元素的匮缺,最终抑制树木生长。
-
在本研究中,与其它元素相比,N添加对水杉细根、粗根C含量的影响较弱,与C元素作为植物的结构性元素,具有相对稳定性有关[31]。N添加显著增加了细根、粗根N含量、C:P、N:P,显著降低了P含量、C:N。N添加显著提高植物细根和粗根中N含量,进而导致植物细根和粗根C:N下降和N:P上升,这与Yue研究发现N沉降对陆地生态系统C:N:P的全球数据整合分析结果相一致[32]。N添加显著促进了土壤N可利用性[33],对根系N含量的增加产生促进作用[34],进一步导致C:N下降和N:P上升。本研究中N添加下土壤水解氮含量的提高引起细根和粗根N含量的上升和P含量的相对下降,这与郭润泉等[30]的研究结果相一致,即N添加增加了树木对N的吸收,而相对减少了树木对P的吸收。同时,N添加促进水杉生长而产生的稀释作用使根系中P浓度相对降低[34-35]。
-
根系的生长、呼吸、养分吸收与同化、有机质分泌会消耗大量的碳水化合物[36]。细根较于粗根在植物的营养吸收过程中起到关键性作用[37],因此植物会将养分大量分配给细根以完成自身生长发育和植物养分供应[38]。研究表明,细根是植物对外界生存环境变化响应最为敏感的地下器官[39]。然而,本研究发现水杉粗根N计量特征对N添加的可塑性响应比细根更强。
在本研究中,LN和MN处理下细根和粗根N含量对N添加的响应基本一致,然而HN下,细根对N添加的响应减弱。根据最优分配假说:在养分限制情况下,树木优先将养分分配给获取限制性资源的器官;而当限制性资源增加时,树木降低吸收该资源器官的养分分配比率,并提高其它器官养分分配比率 [40-41]。在这种养分分配机制下,受N限制的水杉细根可能会将限制性N养分储存于自身维持化学计量的稳态并促进自身生长以获取植物缺少的养分(表现为细根的N含量显著高于粗根N含量)。当低水平外源N添加缓解了林分内N限制,树木会将N元素选择性地优先供给地上部分(叶片)促进树木地上部分生长,而当外源N添加水平过高时,N元素会积聚于储存器官(粗根)中。因此,粗根N含量、C:N、N:P的可塑性响应在低N处理下与细根无显著差异,而在高N处理下显著高于细根[4],反映了树木面对养分胁迫环境所作出的适应性策略,具体表现为树木通过将胁迫元素更多地积聚于储存器官(粗根)中,维持细根N、P元素平衡,保证其吸收功能不受影响。N添加显著降低了细根和粗根P含量,显著增加了C:P,且细根和粗根的P含量和C:P在MN和HN处理间均无显著差异,此外,水杉细根与粗根间的P含量(C:P)的可塑性响应在N添加下均无显著差异,表明N添加下,树木并未改变P元素在细根和粗根间的分配。这种结果可能是由于水杉本身并不受到P限制,根系中的P元素的变化更多地与树木营养生长的需求相关[27]。
-
水杉人工林细根和粗根C、N、P计量特征对N添加的响应较为一致。较细根而言,粗根C、N、P计量特征对N添加的可塑性响应更强,表现为粗根N含量、C:N、N:P的可塑性响应在HN处理下显著高于细根。细根和粗根 N:P随N添加量的增加而增加,表明中低水平的N添加缓解了研究地水杉人工林的N限制,而高水平N添加可能引起水杉林P限制,表现在水杉胸径生长量呈现先增加后下降的趋势。研究结果为认识大气N沉降持续增加背景下林木地下部分养分分配策略提供新的思路,也为东部沿海地区水杉人工林养分管理措施的制定提供科学依据。
水杉人工林细根和粗根碳氮磷计量特征对N添加的响应
Response of C, N, P Stoichiometry of Fine and Coarse Roots of Metasequoia glyptostroboides Plantation to Nitrogen Addition
-
摘要:
目的 研究水杉细根和粗根碳(C)、氮(N)、磷(P)计量特征对N添加的响应,揭示细根和粗根N、P养分分配格局的变化,为科学认识水杉对N沉降的适应策略提供参考。 方法 在江苏省东台市林场水杉人工林进行长期N添加试验,设置对照(CK,0 kg·hm−2·a−1)、低N(LN,56 kg·hm−2·a−1)、中N(MN,168 kg·hm−2·a−1)、高N(HN,280 kg·hm−2·a−1)4个N添加处理,测定水杉细根(直径<2 mm)和粗根(2 mm≤直径≤5 mm)C、N、P含量及土壤理化性质指标。 结果 (1)N添加对水杉人工林土壤有机碳和水解氮含量存在明显促进作用,且随着N添加量增加,这种促进作用有所减弱。N添加对土壤全磷含量、有效磷含量和pH均无显著影响。(2)随着N添加量的增加,水杉细根和粗根N含量、C:P、N:P显著增加,P含量和C:N显著下降。此外,细根和粗根N含量、C:N和N:P在HN处理下对N添加的响应存在明显差异,表现为细根N含量、C:N和N:P在HN处理下对N添加响应减弱。(3)水杉粗根N含量和C:N可塑性响应在HN处理下显著高于细根,粗根N:P可塑性响应在MN和HN处理下显著高于细根。 结论 水杉细根和粗根C、N、P计量特征对N添加的响应较为一致,分析发现粗根N含量、C:N、N:P的可塑性响应在HN处理下显著高于细根。研究结果为认识N沉降持续增加背景下林木地下部分养分分配策略提供新的思路,也为沿海防护林养分管理措施的制定提供科学依据。 Abstract:Objective The responses of fine roots and coarse roots stoichiometric characteristics to nitrogen (N) addition were determined to reveal the difference between fine roots and coarse roots for Metasequoia glyptostroboides, which would provide theoretical guidance for understanding plant strategies under soil nutrient changing. Method We conducted a long-term N addition experiment in M. glyptostroboides plantations in Forest Farm of Dongtai City, Jiangsu Province, with four levels of N addition including control (CK, 0 kg·hm−2·a−1), low N (LN, 56 kg·hm−2·a−1), medium N (MN, 168 kg·hm−2·a−1), and high N (HN, 280 kg·hm−2·a−1). The carbon (C), N, phosphorus (P) concentrations of fine roots (diameter<2 mm) and coarse roots (2 mm≤diameter≤5 mm) and the soil physical and chemical properties were measured. Result (1) N addition significantly promoted soil organic carbon and Alkali-hydrolyzable N content, and the promotion effect weakened with the increase of N addition. (2) P concentration, C:N in both fine roots and coarse roots decreased, while N concentration, C:P, N:P increased with the increase of N addition. In addition, the response of N concentration, C:N and N:P in fine roots and coarse roots to N addition were significantly different under HN treatment, which showed the response of N concentration, C:N and N:P in fine roots to N addition weakened. (3) The plastic response of N concentration and C:N in coarse root were significantly higher than those in fine root under high N treatments. Also, the plastic response of N:P in coarse root was significantly higher than that in fine root under medium N and high N treatments. Conclusion The response of C, N, P stoichiometry in both fine roots and coarse roots to N deposition was consistent, while, plasticity response of C, N, P stoichiometry in coarse root was stronger than that in fine root under HN treatment. Overall, our findings would provide insights into the understanding of plant belowground nutrient allocation strategies under N addition, and also support for management of coastal shelterbelt. -
Key words:
- Metasequoia glyptostroboides
- / nitrogen addition
- / fine root
- / coarse root
- / C, N, P stoichiometry
-
表 1 水杉人工林样地基本情况(2014年)
Table 1. The basic situation of M. glyptostroboides plantations plot (in 2014)
林分结构
Stand structure土壤理化性质
Soil physical and chemical properties平均树高
Average
tree
height/
m林分密度
Stand
density
(株·hm−2)冠幅
Crown
width/
m含水量
Moisture
content/
%总孔隙度
Total
porosity/
%毛管孔隙
Capillary
porosity/
%有机碳含量
Organic
carbon
content/
(g·kg−1)全氮含量
Total
nitrogen
content/
(g·kg−1)水解氮含量
Alkali-hydrolyzable
nitrogen
content/
(mg·kg−1)全磷含量
Total
phosphorus
content/
(g·kg−1)有效磷含量
Available
phosphorus
content/
(mg·kg−1)10.33±1.83 417 4.61±0.65 22.85±1.71 44.09±2.81 42.46±3.68 8.19±0.38 0.71±0.01 54±4.27 0.85±0.03 14.27±3.91 表 2 各处理水杉人工林的胸径(2015年)和胸径生长量(2015—2019年)
Table 2. DBH in 2015 and DBH growth in four years of the M. glyptostroboides plantations of various treatments
项目
ItemN添加 N addition CK LN MN HN 胸径 DBH/cm 17.80±0.86 18.46±0.69 17.85±1.13 18.47±0.53 胸径生长量 DBH growth/cm 4.80±1.52 c 6.12±1.98 b 6.99±1.89 a 6.46±1.61 ab 注:不同小写字母为不同处理下胸径(胸径生长量)差异显著(P<0.05)。
Note: Different lowercase letters indicate significant differences in DBH (DBH growth) at various treatments at 0. 05 level.表 3 不同N添加量对土壤pH值和养分含量的影响
Table 3. Effect of N addition on the soil pH and C, N, P concentrations
处理
Treatment土壤pH
Soil pH有机碳含量
Organic
carboncontent/
(g·kg−1)全氮含量
Total
nitrogencontent/
(g·kg−1)水解氮含量
Alkali-hydrolyzablenitrogen
content/(mg·kg−11)全磷含量
Total
phosphoruscontent/
(g·kg−1)有效磷含量
Availablephosphorus
content/(mg·kg−1)CK 7.70±0.23 a 4.30±0.06 b 0.61±0.05 a 49.05±1.34 b 0.86±0.05 a 13.37±1.45 a LN 7.80±0.24 a 4.90±0.13 ab 0.66±0.04 a 63.33±8.25 ab 0.87±0.04 a 11.75±3.38 a MN 7.60±0.18 a 5.95±0.58 a 0.72±0.14 a 76.89±6.84 a 0.84±0.05 a 13.03±2.41 a HN 7.60±0.21 a 5.30±0.74 ab 0.70±0.11 a 78.90±15.66 a 0.90±0.05 a 15.93±2.64 a 注:不同小写字母为不同处理下土壤C、N、P含量差异显著(P<0.05)。
Note: Different lowercase letters indicate significant differences in C, N, P concentrations of soil at various treatments at 0. 05 level. -
[1] Wen Z, Wen X, Li Q, et al. Changes of nitrogen deposition in China from 1980 to 2018[J]. Environment International, 2020, 144: 106022. doi: 10.1016/j.envint.2020.106022 [2] Yu G R, Jia Y L, He N P, et al. Stabilization of atmospheric nitrogen deposition in China over the past decade[J]. Nature Geoscience, 2019, 12(6): 424-429. doi: 10.1038/s41561-019-0352-4 [3] 杨 璐, 汪金松, 赵 博, 等. 长期施氮对暖温带油松林土壤呼吸及其组分的影响[J]. 林业科学, 2021, 57(1):1-11. doi: 10.11707/j.1001-7488.20210101 [4] 王 凯, 张大鹏, 宋立宁, 等. 氮沉降和降水增加对榆树幼苗不同器官碳氮磷分配格局的影响[J]. 林业科学, 2020, 56(3):175-186. [5] 吴伊波, 车荣晓, 马 双, 等. 高寒草甸植被细根生产和周转的比较研究[J]. 生态学报, 2014, 34(13):3529-3537. [6] Jia S X, Mclaughlin N B, Gu J C, et al. Relationships between root respiration rate and root morphology, chemistry and anatomy in Larix gmelinii and Fraxinus mandshurica[J]. Tree Physiology, 2013, 33(6): 579-589. doi: 10.1093/treephys/tpt040 [7] Han M G, Sun L J, Gan D Y, et al. Root functional traits are key determinants of the rhizosphere effect on soil organic matter decomposition across 14 temperate hardwood species[J]. Soil Biology and Biochemistry, 2020, 151: 108019. doi: 10.1016/j.soilbio.2020.108019 [8] 刘 颖, 贺静雯, 余 杭, 等. 干热河谷优势灌木细根, 粗根与叶片养分(C、N、P)含量及化学计量比[J]. 山地学报, 2020, 38(5):29-39. [9] 马玉珠, 钟全林, 靳冰洁, 等. 中国植物细根碳、氮、磷化学计量学的空间变化及其影响因子[J]. 植物生态学报, 2015, 39(2):159-166. doi: 10.17521/cjpe.2015.0015 [10] 陈晓萍, 郭炳桥, 钟全林, 等. 武夷山不同海拔黄山松细根碳、氮、磷化学计量特征对土壤养分的适应[J]. 生态学报, 2018, 28(1):273-281. [11] Yang C B, Zhang X P, Ni H J, et al. Soil carbon and associated bacterial community shifts driven by fine root traits along a chronosequence of moso bamboo (Phyllostachys edulis) plantations in subtropical China[J]. Science of The Total Environment, 2021, 752: 142333. doi: 10.1016/j.scitotenv.2020.142333 [12] 于立忠, 丁国泉, 朱教君, 等. 施肥对日本落叶松不同根序细根养分浓度的影响[J]. 应用生态学报, 2009, 20(4):747-753. [13] 许 旸, 谷加存, 董雪云, 等. 海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量[J]. 植物生态学报, 2011, 35(9):955-964. [14] 苗 宇, 陈栎霖, 李贤伟, 等. 施肥对台湾桤木-扁穗牛鞭草复合模式下桤木细根形态特征、生物量及组织碳氮含量的影响[J]. 植物生态学报, 2013, 37(7):674-683. [15] Lu M, Zhou X H, Luo Y Q, et al. Minor stimulation of soil carbon storage by nitrogen addition: a meta-analysis[J]. Agriculture, Ecosystems & Environment, 2011, 140(1-2): 234-244. [16] Feng J G, Zhu B. A global meta-analysis of soil respiration and its components in response to phosphorus addition[J]. Soil Biology and Biochemistry, 2019, 135: 38-47. doi: 10.1016/j.soilbio.2019.04.008 [17] 平晓燕, 周广胜, 孙敬松. 植物光合产物分配及其影响因子研究进展[J]. 植物生态学报, 2010, 34(1):100-111. doi: 10.3773/j.issn.1005-264x.2010.01.013 [18] Li W B, Jin C J, Guan D X, et al. The effects of simulated nitrogen deposition on plant root traits: A meta-analysis[J]. Soil Biology & Biochemistry, 2015, 82: 112-118. [19] Xu C L, Xing A J, Du E Z, et al. Effects of nitrogen addition on leaf nutrient stoichiometry in an old-growth boreal forest[J]. Ecosphere, 2021, 12(1): e03335. [20] Jing H, Zhou H X, Wang G L, et al. Nitrogen addition changes the stoichiometry and growth rate of different organs in Pinus tabuliformis Seedlings[J]. Frontiers in Plant Science, 2017, 8: 1922. doi: 10.3389/fpls.2017.01922 [21] 刘 佳, 项文化, 徐 晓, 等. 湖南会同5个亚热带树种的细根构型及功能特征分析[J]. 植物生态学报, 2010, 34(8):938-945. doi: 10.3773/j.issn.1005-264x.2010.08.006 [22] Wen Y X, Tong R, Zhang H, et al. N addition decreased stand structure diversity in young but increased in middle-aged Metasequoia glyptostroboides plantations[J]. Global Ecology and Conservation, 2021, 30: e01803. doi: 10.1016/j.gecco.2021.e01803 [23] 鲍士旦. 土壤农化分析.3版[M]. 北京: 中国农业出版社, 2000. [24] Valladares F, Wright S J, Lasso E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian Rainforest[J]. Ecology, 2000, 81(7): 1925-1936. doi: 10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 [25] 邹安龙, 李修平, 倪晓凤, 等. 模拟氮沉降对北京东灵山辽东栎林树木生长的影响[J]. 植物生态学报, 2019, 43(9):783-792. doi: 10.17521/cjpe.2018.0232 [26] Güsewell S, Koerselman W, Verhoeven J T. Biomass N: P ratios as indicators of nutrient limitation for plant populations in wetlands[J]. Ecological Applications, 2003, 13(2): 372-384. doi: 10.1890/1051-0761(2003)013[0372:BNRAIO]2.0.CO;2 [27] Wang J N, Wang J Y, Wang Lei, et al. Does stoichiometric homeostasis differ among tree organs and with tree age? [J] Forest Ecology and Management, 2019, 453: 117637. [28] 王建宇, 王庆贵, 闫国永, 等. 原始云冷杉、红松林树木生长对氮沉降的响应[J]. 北京林业大学学报, 2017, 39(4):21-28. [29] Li Y, Tian D, Yang H, et al. Size-dependent nutrient limitation of tree growth from subtropical to cold temperate forests[J]. Functional Ecology, 2018, 32(1): 95-105. doi: 10.1111/1365-2435.12975 [30] 郭润泉, 熊德成, 宋涛涛, 等. 模拟氮沉降对杉木幼苗细根化学计量学特征的影响[J]. 生态学报, 2018, 38(17):123-132. [31] Ågren G. Stoichiometry and nutrition of plant growth in natural communities[J]. Annual Review of Ecology, Evolution, and Systematics, 2018, 39: 153-170. [32] Yue K, Fornara D A, Yang W Q, et al. Effects of three global change drivers on terrestrial C: N: P stoichiometry: a global synthesis[J]. Global Change Biology, 2016, 23(6): 2450-2463. [33] Peñuelas J, Sardans J, Rivas-ubach A, et al. The human-induced imbalance between C, N and P in Earth's life system[J]. Global Change Biology, 2015, 18(1): 3-6. [34] Sardans J, Alonso R, Janssens I A, et al. Foliar and soil concentrations and stoichiometry of nitrogen and phosphorous across European Pinus sylvestris forests[J]. Functional Ecology, 2017, 30(5): 676-689. [35] 洪琮浩, 洪 震, 雷小华, 等. 氮添加对长序榆C、N、P养分含量及非结构性碳水化合物含量的影响[J]. 林业科学, 2020, 56(6):187-192. [36] Lin G G, Gao M X, Zeng D H, et al. Aboveground conservation acts in synergy with belowground uptake to alleviate phosphorus deficiency caused by nitrogen addition in a larch plantation[J]. Forest Ecology and Management, 2020, 473: 118309. doi: 10.1016/j.foreco.2020.118309 [37] Wang H F, Wang Z Q, Dong X Y. Anatomical structures of fine roots of 91 vascular plant species from four groups in a temperate forest in Northeast China[J]. Plos One, 2019, 14(5): e0215126. doi: 10.1371/journal.pone.0215126 [38] Farrar J F, Jones D L. The control of carbon acquisition by roots[J]. New Phytologist, 2010, 147(1): 43-53. [39] Iversen C M, Mccormack M L, Powell A S, et al. A global fine-root ecology database to address below-ground challenges in plant ecology[J]. New Phytologist, 2017, 215(1): 15-26. doi: 10.1111/nph.14486 [40] 陈克立. 氮添加对油松和辽东栎幼苗次生代谢过程的影响[D]. 杨凌: 西北农林科技大学, 2019. [41] Kobe R K, Iyer M, Walters M B. Optimal partitioning theory revisited: nonstructural carbohydrates dominate root mass responses to nitrogen[J]. Ecology, 2010, 91(1): 166-179. doi: 10.1890/09-0027.1 -





 下载:
下载: