-
红树林作为海陆交界处特殊的湿地生态系统,虽仅占世界陆地面积的0.1%,但由于土壤初级生产力高,有机质分解率低,因此,是一个重要的碳汇[1]。近年来,因海平面上升、富营养化和土地利用变化等各种干扰,导致红树林面积减少[2]。红树林湿地具有极其丰富的有机碳储量,对调控全球碳循环和气候变化有重要作用。为此,迫切需要探明红树林生态系统快速固碳的潜在机制,有学者将红树林有机碳含量的量化作为红树林湿地受各种非生物和物理化学影响程度的一个非常重要的指标[3]。
红树林土壤有机质极低的分解速率被认为是由低氧和养分有效性以及难分解生物质造成的[4]。然而,对微生物在土壤有机质分解中起关键作用的机制研究很少[5]。土壤微生物在生态系统中发挥重要作用,与土壤形成、有机质积累与矿化、养分转化等过程息息相关[6]。相关研究表明,土壤酶是生态系统中微生物等分解者发挥自身职能的天然工具[7],如Liu等[8]研究报道了红树林土壤有机质含量与β-葡萄糖苷酶活性呈显著正相关;Chen等[9]在其他土壤生态系统中也观察到土壤有机质和水解酶活性之间存在正相关;Jinhyun等[1]研究也指出,红树林土壤有机质与水解酶的活性呈显著相关性,反之,与真菌丰度和酚氧化酶活性呈显著负相关;马维伟等[10]研究发现,土壤有机碳与土壤酶(蔗糖酶、淀粉酶、纤二糖酶和纤维素酶)活性呈极显著正相关。由此看出,土壤酶的分解作用参与并控制着陆地系统土壤有机碳的循环过程,有必要开展红树林湿地土壤微生物生物量及土壤酶活性对土壤有机碳含量影响的相关研究,研究结果对揭示红树林湿地土壤碳循环过程具有重要意义。
清澜港红树林湿地位于海南文昌市境内,属于北缘地带,常年受到海水周期性浸淹、热带风暴、台风、强流、积物等因素的影响,具有典型的热带红树林湿地特征[11]。目前,众多学者针对清澜港红树林湿地的研究多集中在土壤有机碳含量[12]、重金属污染[13]、植物群落特征[14]以及动态变化监测[15]等方面,并取得一定的成果,而对于土壤酶活性方面的研究鲜见报道。因此,本研究选择清澜港红树林海莲(Bruguiera sexangula (Lour.) Poir,简称BS)、正红树(Rhizophora apiculata Blume,简称RA)、杯萼海桑(Sonneratia alba J. Smith,简称SA)、榄李(Lumnitzera racemosa Willd,简称LR)及角果木(Ceriops tagal (perr.) C. B. Rob,简称CT)群落为研究对象,研究红树林土壤酶活性特征的差异及其主要影响因子,尝试从土壤酶活性角度分析红树林湿地土壤质量状况及其生态效应,为海南省红树林湿地土壤碳汇监测与生态修复提供数据支撑。
-
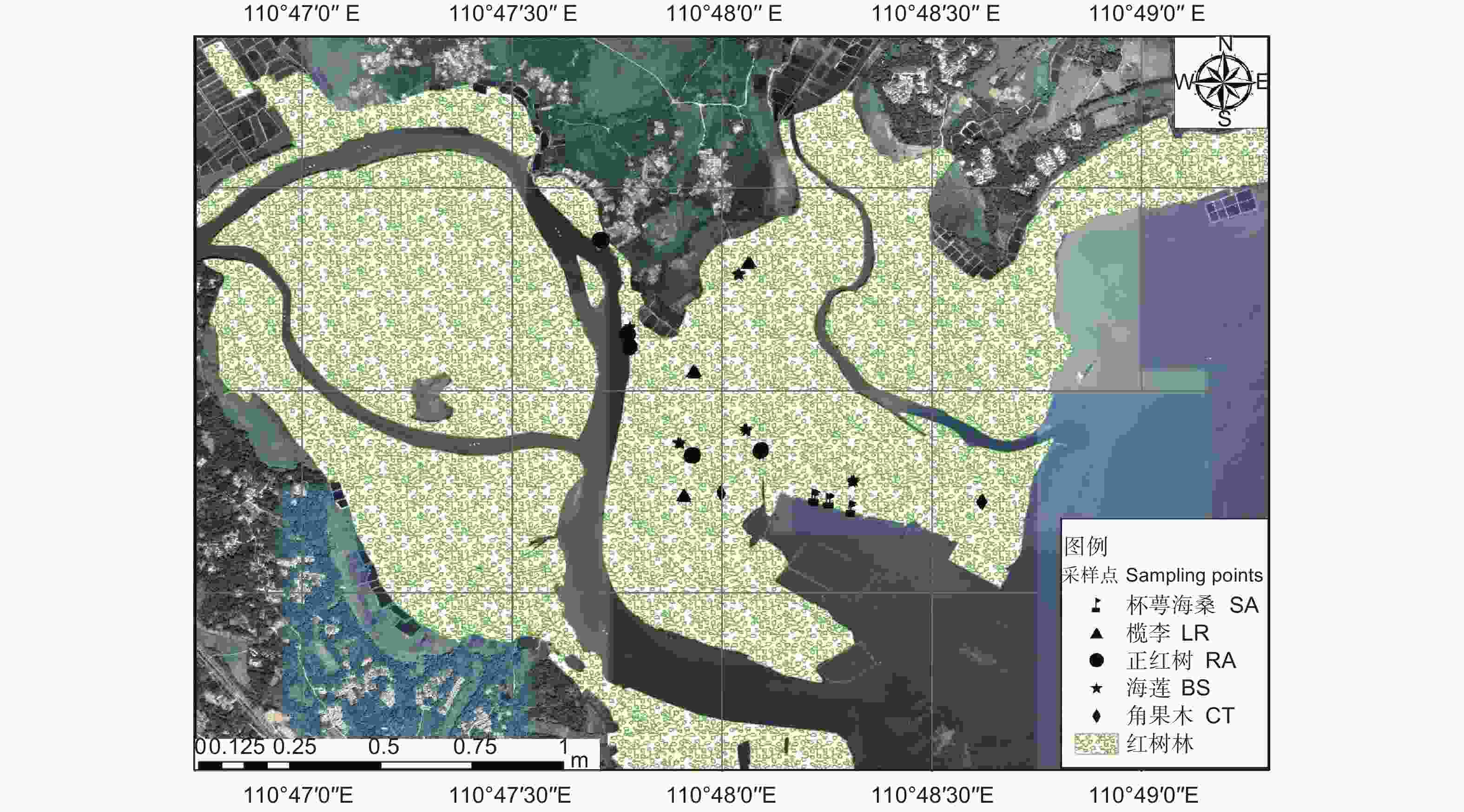
选取文昌市清澜港红树林保护区(110°40′~110°48′ E,19°22′~19°35′ N)作为研究对象,根据2019年调查数据显示,文昌市红树林分布面积约1 274.64 hm2,主要分布海莲、榄李、红海榄、正红树、角果木等植物。本次调查区域位于文昌江和文教河汇入湾内,地处八门湾七差河处,呈葫芦状海湾,平均径流量小,其潮汐现象呈现不规则的半日潮特点,每天两起两落[16],最高潮位为2.38 m,最低潮位为0.01 m[14],平均潮差0.75 m。研究区地处热带北缘沿海地带,属热带季风气候,年平均气温24 ℃,年均降水量1 799.4 mm[17]。结合历史气象数据分析发现,研究区域极易受到热带气旋的影响,年平均受到3.58个热带气旋影响[18]。
-
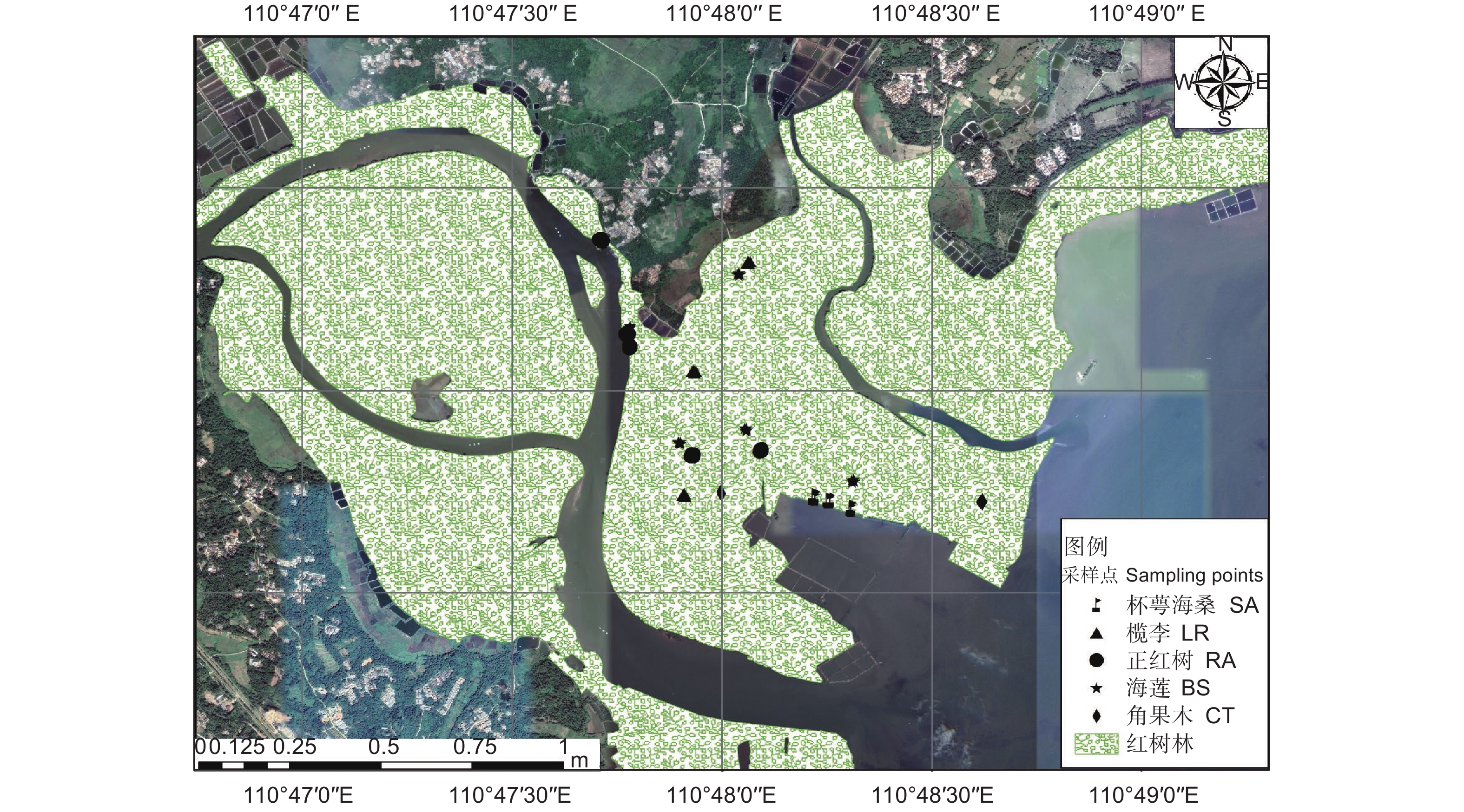
2021年3月,在全面踏查基础上,结合清澜港群落组成情况(由海向陆分别生长着海莲(尖瓣海莲)、红树 + 海桑-白骨壤、海桑(杯萼、大叶、海南海桑)、榄李(红榄李)等群落),考虑到各群落所处位置不同以及可比性原则,最终选取海莲、正红树、杯萼海桑、榄李及角果木5种优势群落,共设置18个10 m × 10 m的采样点(图1),各采样点的高程值范围为1.45~7.01 m。用小铲子在样方内按表层(0~20 cm)3点采集土壤样品,采集之后将相同样方土壤混合均匀,并分两部分处理,一部分带回实验室进行风干处理,之后去除杂质贮存用于土壤理化性质分析;另一部分则放置在4 ℃保温冰箱中贮存,用于土壤微生物量碳氮和土壤酶活性的测定。
-
土壤理化性质采用常规标准进行测定。土壤有机碳(SOC)采用重铬酸钾氧化-硫酸溶液氧化法测定(NY/T 1121.6—2006) [19];全氮(TN)采用凯氏定氮仪测定(NY/T 1121.24—2012)[20];全磷(TP)采用碱熔-钼锑抗比色法测定(HJ 632—2011)[21];全钾(TK)采用火焰光度计测定(LY/T 1234—2015)[22];pH值采用电位法测定(NY/T 1377—2007)[23];土壤还原性物质总量(RS)采用重铬酸钾氧化法测定[24]。
-
土壤微生物生物量碳(MBC)和土壤微生物生物量氮(MBN)含量采用氯仿熏蒸-0.5 mol·L−1K2SO4 提取法,浸提液用碳氮分析仪测定[25]。
微生物熵碳(qMBC)和微生物熵氮(qMBN)的计算公式如下[26]:
$\begin{array}{c} 微生物熵碳(\text{qMBC})=\\ \dfrac{土壤微生物生物量碳(\text{MBC})}{土壤有机碳(\text{SOC})}\times 100\text{%} \end{array} $
$ \begin{array}{c} 微生物熵氮(\text{qMBN})=\\ \dfrac{土壤微生物生物量氮(\text{MBN})}{土壤全氮(\text{TN})}\times 100\text{%} \end{array}$
-
各种土壤酶活性的测定参照文献[27]中的测定方法,其中,土壤磷酸酶(PHO)活性采用磷酸苯二钠比色法测定;土壤蔗糖酶(SUC)活性采用3,5-二硝基水杨酸比色法测定;土壤过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定;土壤脲酶(URE)活性采用苯酚钠-次氯酸钠比色法测定。
-
数据整理和初步计算在Excel 2010完成;采用单因素方差法(One-way ANOVA)和最小显著性差异法(LSD)检验不同植物群落土壤理化性质和土壤酶活性的显著性差异(ɑ=0.05);利用Pearson相关性分析得到与土壤酶活性显著相关的土壤因子;用Canoco Software 4.5软件对土壤酶活性与土壤因子进行冗余分析(RDA),探究影响土壤酶活性变化的主要因子。
-
表1表明:不同红树林优势群落土壤有机碳(SOC)含量均值为55.57~81.21 g·kg−1;土壤pH值总体呈弱酸性,其中,海莲群落的pH值最高(5.57),均显著高于其余群落(杯萼海桑除外);全氮(TN)、全磷(TP)、全钾(TK)含量均值分别为3.06~4.14、0.43~2.13、10.77~14.57 g·kg−1,其中,角果木群落的土壤TN和TK含量最高,但不同群落间无显著差异,海莲群落的土壤TP含量最高,均显著高于其余群落(榄李群落除外)。土壤还原性物质总量(RS)均值为2.30~4.12 cmol·kg−1,榄李群落的最高。土壤含水量(SWC)含量均值为7.00%~16.15%,角果木群落的最高,均显著高于其余群落。
表 1 不同群落类型红树林湿地表层土壤理化性质
Table 1. Physicochemical properties of mangrove wetland surface soil of different community types
群落类型
Community type土壤有机碳
SOC/(g·kg−1)土壤pH值 土壤全氮
TN/(g·kg−1)土壤全磷
TP/(g·kg−1)土壤全钾
TK/(g·kg−1)土壤还原性物质总量
RS/(cmol·kg−1)土壤含水量
SWC/%角果木 CT 81.21 4.90 bc 4.14 0.73 b 14.57 3.97 ab 16.15 a 海莲 BS 55.57 5.57 a 3.88 2.13 a 13.22 2.54 bc 7.00 b 杯萼海桑 SA 63.61 5.44 ab 3.31 0.59 b 11.81 2.84 abc 9.93 b 正红树 RA 63.30 5.00 bc 3.26 0.43 b 10.77 2.30 c 5.77 b 榄李 LR 70.13 4.70 c 3.06 1.12 ab 12.13 4.12 a 8.52 b 注:同列不同字母表示群落类型间差异显著(p<0.05)。
Note: ifferent letters in the same column indicate significant differences between community types(p<0.05). -
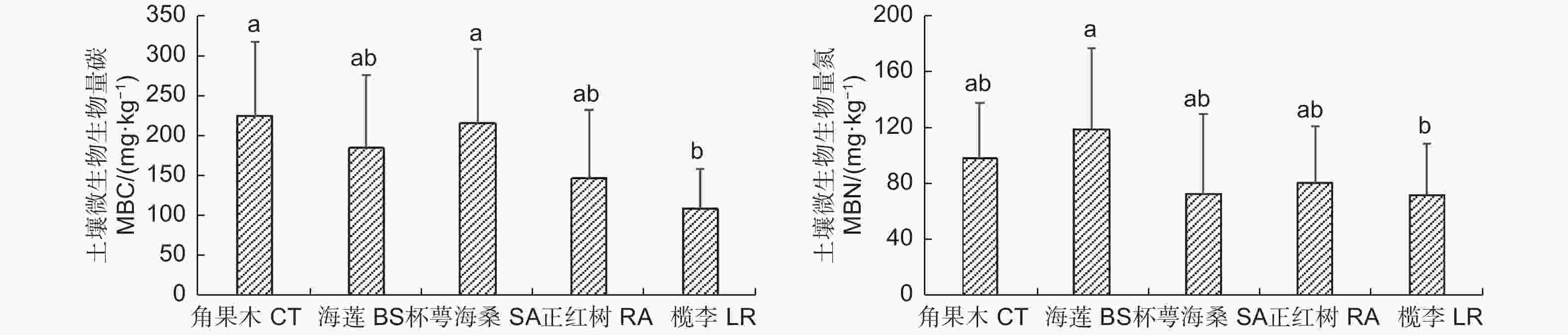
通过对清澜港红树林5种群落类型土壤微生物生物量碳氮进行分析,结果(图2)表明:土壤微生物生物量碳(MBC)含量为109.16~225.89 mg·kg−1,5种群落类型土壤MBC含量以角果木群落最高,其次是杯萼海桑群落,二者均显著高于榄李群落(p<0.05)。土壤微生物生物量氮(MBN)含量为72.51~119.47 mg·kg−1,5种群落类型土壤MBN含量以海莲群落最高,显著高于榄李群落(p<0.05),其次是角果木群落。
-
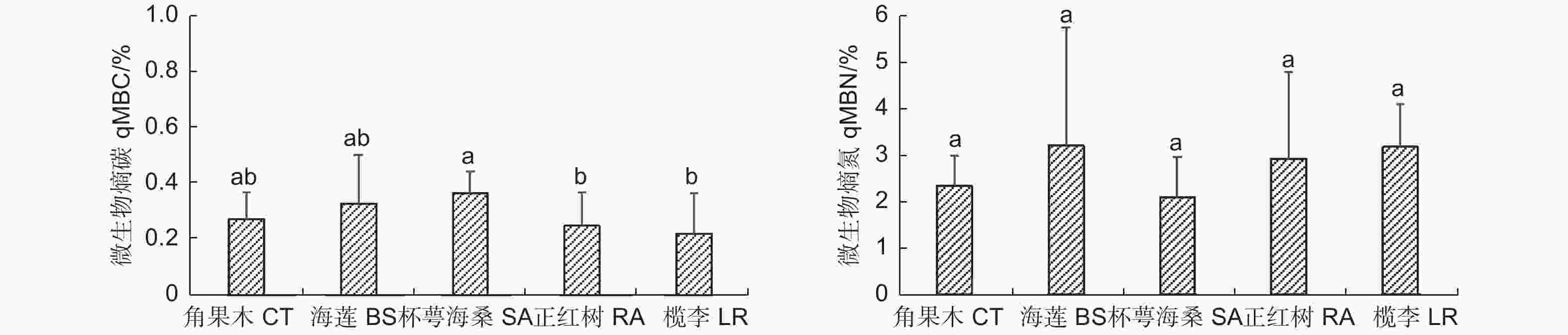
图3表明:不同红树林群落类型的土壤微生物熵碳(qMBC)变化范围为0.22%~0.36%,依次为杯萼海桑群落>海莲群落>角果木群落>正红树群落>榄李群落,其中,杯萼海桑群落显著高于正红树群落和榄李群落。土壤微生物熵氮(qMBN)的变化范围为2.09%~3.20%,依次为海莲群落>榄李群落>正红树群落>角果木群落>杯萼海桑群落。整体看,qMBC和qMBN在不同红树林优势群落间无规律性。
-
图4表明:角果木群落的土壤脲酶(URE)和磷酸酶(PHO)活性在5种红树林群落中最高,且均显著高于海莲、杯萼海桑和正红树群落,榄李群落次之。土壤过氧化氢酶(CAT)活性高低依次为角果木群落>杯萼海桑群落>榄李群落>海莲群落>正红树群落,其中,角果木群落显著高于海莲和正红树群落。土壤蔗糖酶(SUC)活性高低依次为杯萼海桑群落>角果木群落>榄李群落>正红树群落>海莲群落,其中,杯萼海桑群落显著高于海莲和正红树群落。不同红树植物群落土壤的4种土壤酶活性以蔗糖酶最大,其次是磷酸酶和过氧化氢酶,脲酶最小。因此,蔗糖酶是该区域最活跃的土壤酶。
-
由表2可知:脲酶活性与磷酸酶、过氧化氢酶活性呈极显著正相关,与蔗糖酶活性呈显著正相关;脲酶活性与SWC、SOC、MBC、TN、TP、TK和RS呈极显著正相关,与MBN呈显著正相关,与pH值呈不显著相关。磷酸酶活性与过氧化氢酶、蔗糖酶活性呈不显著相关;磷酸酶活性与SWC、MBC、MBN和RS呈极显著正相关,与TN、TK呈显著正相关,与pH值、SOC和TP呈不显著相关。过氧化氢酶活性与蔗糖酶活性呈极显著正相关;过氧化氢酶活性与SWC、SOC、MBC和TN呈极显著正相关,与RS呈显著正相关,与pH值、TP、TK和MBN呈不显著相关。蔗糖酶活性与SWC、SOC、MBC、TN和MBN呈极显著正相关,与pH值、TP、TK和RS呈不显著相关。说明在清澜港红树林湿地,脲酶、磷酸酶、过氧化氢酶和蔗糖酶在土壤代谢中起到重要作用。
表 2 清澜港不同红树林优势群落土壤酶活性与土壤理化因子间的相关性分析
Table 2. Correlation analysis between soil enzyme activities and soil physicochemical factors in different dominant mangrove communities of Qinglan port
项目
Item脲酶
URE磷酸酶
PHO过氧化氢酶
CAT蔗糖酶
SUC脲酶 URE 1 磷酸酶 PHO 0.488** 1 过氧化氢酶 CAT 0.554** 0.226 1 蔗糖酶 SUC 0.310* 0.214 0.482** 1 pH值 0.085 0.047 0.001 0.189 土壤含水量 SWC 0.788** 0.469** 0.664** 0.591** 土壤有机碳含量 SOC 0.414** 0.252 0.517** 0.437** 土壤微生物生物量碳含量 MBC 0.481** 0.425** 0.632** 0.613** 土壤全氮含量 TN 0.447** 0.333* 0.500** 0.443** 土壤全磷含量 TP 0.468** 0.128 0.272 −0.025 土壤全钾含量 TK 0.442** 0.307* 0.212 0.122 土壤微生物生物量氮含量 MBN 0.333* 0.535** 0.251 0.418** 土壤还原性物质总量 RS 0.632** 0.628** 0.293* 0.158 注:*和**分别表示显著相关(P<0.0.5)和极显著相关(P<
0.01)。
Note: *and**indicate the correlation is significant at P<0.05 and P<0.01 levels.对土壤酶活性与土壤理化因子进行RDA分析,其中,选取土壤SOC、MBC、MBN、RS、TN、TP、TK、SWC和pH值作解释变量,土壤URE、PHO、CAT、SUC作响应变量。表3表明:9种土壤理化因子前3个排序轴累计解释了土壤酶活性特征的60.0%,土壤酶活性特征和土壤因子之间关系的累积解释量为97.5%。
表 3 清澜港不同红树林优势群落土壤酶活性的解释变量冗余分析
Table 3. Redundancy analysis of the soil enzyme activity in different dominant mangrove communities of Qinglan port
参数
Parameter第1轴
Axis1第2轴
Axis2第3轴
Axis3特征值
Eigenvalue0.411 0.109 0.008 土壤酶活性-环境相关性
Soil enzyme activity-environmental
correlation0.897 0.707 0.686 土壤酶活性累计解释量
Accumulated interpretation amount of
soil enzyme activity/%41.1 52.0 60.0 土壤酶活性--环境累计解释量
Soil enzyme activity-cumulative
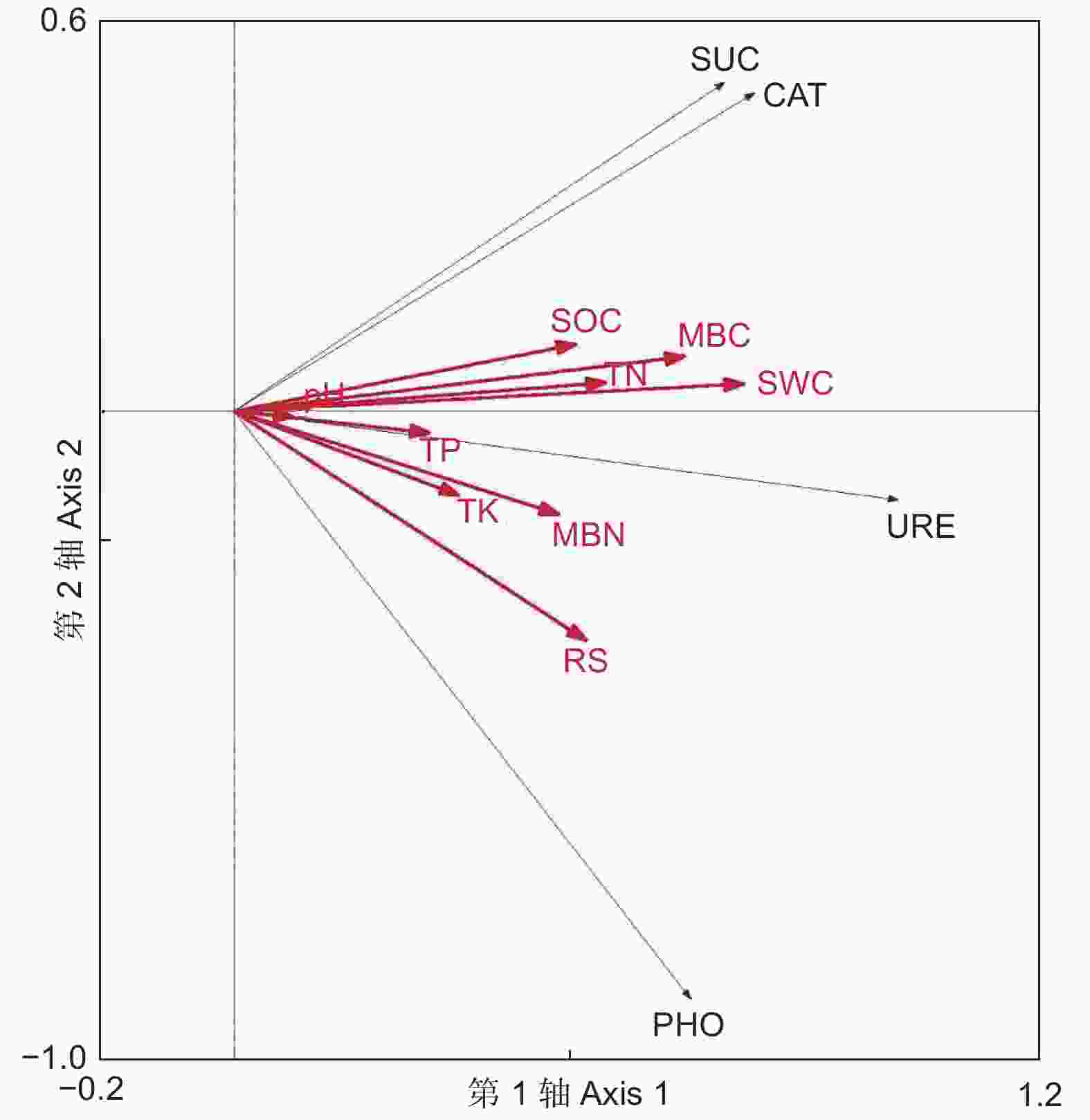
environmental interpretation/%66.9 84.5 97.5 从图5可看出:SWC、MBC和RS的箭头连线最长,且与酶活性箭头方向基本一致,说明选择的9个土壤理化因子中SWC、MBC和RS是影响土壤酶活性分布的重要因子。土壤因子对4种土壤酶活性特征的解释量分别为:SWC(37.0%)、MBC(29.7%)、RS(22.3%)、TN(19.8%)、MBN(17.1%)、SOC(17.0%)、TK(8.0%)、TP(8.0%)、pH(1.0%)。
-
土壤微生物生物量是土壤中有机质最活跃的部分,是反映土壤养分潜力的重要指标,对环境变化反应敏感,能够调节土壤碳氮循环与转化过程[28]。研究结果表明,该研究区内土壤微生物生物量碳(MBC)含量变幅为109.16~225.89 mg·kg−1,角果木群落和杯萼海桑群落显著高于榄李群落(p<0.05);土壤微生物量氮(MBN)含量变幅为72.51~119.47 mg·kg−1,海莲群落的最高,且显著高于榄李群落(p<0.05),这可能与不同群落类型地表凋落物量和植物根系分布有关。有研究指出,枯落物的输入量和植物根系生物量是影响土壤微生物生物量的关键因素[29-30]。另外,有关湿地研究指出,在水位梯度变化驱动下,不同植物群落土壤养分和微生物活性特征存在差异,表现出积水沼泽区域植物群落土壤微生物生物量碳氮含量高于深水区域群落[31-32]。
土壤微生物熵碳(qMBC)反映土壤有机碳向微生物量碳的转化效率,是表征土壤有机碳累计或损失的一个重要指标[33];而土壤微生物熵氮(qMBN)是反映土壤供应有效氮的潜能。本研究结果表明,杯萼海桑群落的土壤qMBC显著高于正红树群落和榄李群落,表明杯萼海桑群落土壤有机碳累积效率较高,微生物对土壤碳库的利用效率处于提升阶段,进而改善了该区群落土壤质量状况。微生物熵氮(qMBN)变幅为2.09%~3.20%,海莲群落的最高,其次是榄李群落,各群落类型间无显著差异。综上表明,土壤微生物活性特征反映了不同植物群落的环境适应和土壤质量的状况。
-
土壤酶作为土壤生态系统的重要组成部分,参与土壤有机物的合成、分解与转化等过程,在森林生态系统土壤碳循环中发挥重要作用[34]。土壤酶活性时空变化受多种因素共同调控,常用于表征土壤养分状况和环境质量指标[35]。前人研究表明,土壤有机碳主要来源于凋落物,不同森林类型间因凋落物数量和质量输入存在差异,所形成的土壤微生物养分环境也各异,因此,必然影响土壤酶活性[36]。
本研究发现,脲酶、磷酸酶、过氧化氢酶和蔗糖酶活性在清澜港红树林湿地中存在较大差异,角果木群落和榄李群落的土壤脲酶和磷酸酶活性显著高于杯萼海桑群落;土壤过氧化氢酶(CAT)活性以角果木群落的最高,正红树群落的最低;土壤蔗糖酶(SUC)活性以杯萼海桑群落的最高,海莲群落的最低。有研究指出,地表覆盖物和植物根系分泌物的不同是造成土壤酶活性产生差异的重要因素;也有研究指出,凋落物输入对土壤酶活性无显著影响,但不同林型和凋落物输入时间则显著影响土壤酶活性[37]。
通过对4种酶活性之间进行相关性分析,结果显示彼此间存在显著相关,这与孙毅等[7]的研究结果一致,表明该研究区内不同元素的循环酶在反映土壤肥力状况方面发挥共性特征[27]。比较3种水解酶发现,蔗糖酶活性最高,磷酸酶次之,脲酶最小,因此,得出蔗糖酶是该研究区域最活跃的水解酶。
-
土壤酶活性与土壤养分紧密相关,能够通过活化土壤营养元素的方式来改善土壤环境质量[38]。大量研究结果显示,土壤酶活性受林分密度、水分、温度、盐度、凋落物的输入等多种环境因素影响[39-40],通过分析土壤酶活性能够较直观的反映土壤质量。因此,对清澜港红树植物群落土壤酶活性与土壤理化因子进行相关性分析,能够更好地研究该区红树植物群落土壤质量及健康状况差异。
4种土壤酶活性与土壤SWC呈极显著正相关,与白静等[41]研究结论一致,说明土壤微生物活性极易受到水分的影响,当土壤SWC越高时,土壤酶活性越强。4种土壤酶活性与土壤pH值无显著正相关,与王玲等[42]研究结论一致,但李聪等[43]研究表明,土壤酶的活性与pH值呈负相关。
此外,4种酶活性的影响因子也存在较大差异。脲酶活性与土壤SOC、MBC、MBN、TN、TP、TK和RS呈极显著或显著正相关(P<0.01或P<0.05);磷酸酶活性与土壤MBC、MBN、TN、TK和RS呈极显著或显著正相关(P<0.01或P<0.05);过氧化氢酶活性与土壤SOC、MBC、TN和RS呈极显著或显著正相关(P<0.01或P<0.05);蔗糖酶活性与土壤SOC、MBC、TN和MBN呈极显著正相关(P<0.01),与TP呈不显著负相关,显示较高的TP不利于蔗糖酶活性的提高。本研究中,土壤SOC与土壤脲酶活性、过氧化氢酶活性和蔗糖酶活性均呈极显著正相关,与土壤磷酸酶活性呈不显著正相关(表2),说明3种土壤酶与SOC含量的增加和积累有密切联系。总体而言,土壤酶与土壤SOC之间存在相互协同作用,土壤酶活性可用来反映土壤营养水平。
RDA分析结果发现,对4种土壤酶活性特征差异的解释量表现为SWC>MBC>RS>TN>MBN>SOC>TK>TP>pH。结果显示,清澜港红树植物群落土壤酶活性主要受土壤SWC、MBC和RS的影响。
-
(1)不同红树植物群落间4种土壤酶活性特征差异较大,土壤脲酶和过氧化氢酶活性在角果木群落最高,正红树群落最低;土壤磷酸酶活性在角果木群落中最高,杯萼海桑群落最低;土壤蔗糖酶活性在杯萼海桑群落中最高,海莲群落最低。
(2)从相关性分析得知,4种酶活性的影响因子存在一定差异,表现为土壤脲酶活性主要受到SWC、SOC、MBC、MBN、TN、TP、TK和RS的影响;土壤磷酸酶活性主要受到SWC、MBC、MBN、TN、TK和RS的影响;土壤过氧化氢酶活性主要受到SWC、SOC、MBC、TN和RS的影响;土壤蔗糖酶活性主要受到SWC、SOC、MBC、TN和MBN的影响。总体认为,4种土壤酶活性的影响因子存在一定差异。
(3)4种土壤酶活性分别与多个土壤理化指标显著相关,RDA结果表明,SWC、MBC和RS是清澜港红树林湿地土壤酶活性变化的关键因子。
(4)可以用土壤酶活性来表征清澜港红树林湿地土壤质量状况。
清澜港红树林湿地土壤酶活性与理化性质的关系
Relationship between Soil Enzyme Activities and Physicochemical Properties in Mangrove Wetland of Qinglan Port
-
摘要:
目的 从土壤酶活性的角度分析清澜港红树林不同群落类型湿地土壤质量状况,为海南省红树林湿地土壤碳汇监测与生态修复提供数据支撑。 方法 对5种红树植物群落类型的土壤酶活性、土壤微生物生物量碳氮含量和理化性质进行分析。 结果 (1)不同群落类型表层土壤微生物量碳氮含量和微生物熵碳皆是榄李群落最低,且显著低于个别群落;土壤微生物熵氮在不同群落类型间无显著差异。(2)不同群落类型表层土壤酶活性基本表现为蔗糖酶>磷酸酶>过氧化氢酶>脲酶。不同群落类型的土壤酶活性存在差异,表现为脲酶、磷酸酶和过氧化氢酶活性以角果木群落的最高,均显著高于海莲和正红树群落;蔗糖酶活性以杯萼海桑群落的最高,显著高于海莲和正红树群落。(3)土壤脲酶活性与含水量(SWC)、有机碳(SOC)、微生物量碳(MBC)、全氮(TN)、全磷(TP)、全钾(TK)和还原性物质总量(RS)呈极显著正相关;磷酸酶活性与SWC、MBC、MBN和RS呈极显著正相关,与TN、TK呈显著正相关;过氧化氢酶活性与SWC、SOC、MBC和TN呈极显著正相关;蔗糖酶活性与SWC、SOC、MBC、TN和MBN呈极显著正相关。(4)冗余分析(RDA)结果显示,SWC、MBC和RS是影响清澜港红树林植物群落土壤酶活性的主要因子。 结论 可以通过土壤酶活性来表征清澜港红树林湿地土壤质量状况。 Abstract:Objective To analyze the soil quality of different mangrove communities in Qinglan Port wetland at the aspect of soil enzyme activity, so as to benefit the mangrove wetland soil carbon sink monitoring and ecological restoration in Hainan Province. Method Soil enzyme activities soil microbial biomass carbon and nitrogen content and physicochemical properties of five mangrove communities were analyzed. Result (1) The lowest contents of microbial biomass carbon and nitrogen and microbial entropy of carbon in the soil surface were found in the Lumnitzera racemosa community, which were significantly lower than that of the individual communities. However, the soil microbial entropy of nitrogen had no significant differences among different community types. (2) The soil enzyme activities in the surface layer of wetland in each community type were basically in the order of sucrase > phosphatase > catalase > urease. There were significant differences among different community types. The activities of urease, phosphatase and catalase in Ceriops tagal community were the highest, which were significantly higher than those in B. sexangula and R. apiculata communities. The catalase activity of C. tagal community was the highest, which was significantly higher than that of B. sexangula and R. apiculata communities. The sucrase activity was the highest in Sonneratia alba community, which was significantly higher than that in B. sexangula and R. apiculata communities. (3) The soil urease activity was significantly positively correlated with water content (SWC), organic carbon (SOC), microbial biomass carbon (MBC), total nitrogen (TN), total phosphorus (TP), total potassium (TK) and total reducing substances (RS). The phosphatase activity was significantly positively correlated with soil SWC, MBC, microbial biomass nitrogen (MBN) and RS, and significantly positively correlated with TN and TK. The catalase activity was significantly positively correlated with SWC, SOC, MBC and TN. The sucrase activity was significantly positively correlated with SWC, SOC, MBC, TN and MBN. (4) The results of redundancy analysis showed that SWC, MBC and RS were the main factors affecting the soil enzyme activities of mangrove communities in Qinglan Port. Conclusion Soil enzyme activity can be used to characterize the soil quality of mangrove wetland in Qinglan Port. -
Key words:
- mangrove wetland
- / soil microbial biomass
- / soil enzyme activities
- / Qinglan Port
-
表 1 不同群落类型红树林湿地表层土壤理化性质
Table 1. Physicochemical properties of mangrove wetland surface soil of different community types
群落类型
Community type土壤有机碳
SOC/(g·kg−1)土壤pH值 土壤全氮
TN/(g·kg−1)土壤全磷
TP/(g·kg−1)土壤全钾
TK/(g·kg−1)土壤还原性物质总量
RS/(cmol·kg−1)土壤含水量
SWC/%角果木 CT 81.21 4.90 bc 4.14 0.73 b 14.57 3.97 ab 16.15 a 海莲 BS 55.57 5.57 a 3.88 2.13 a 13.22 2.54 bc 7.00 b 杯萼海桑 SA 63.61 5.44 ab 3.31 0.59 b 11.81 2.84 abc 9.93 b 正红树 RA 63.30 5.00 bc 3.26 0.43 b 10.77 2.30 c 5.77 b 榄李 LR 70.13 4.70 c 3.06 1.12 ab 12.13 4.12 a 8.52 b 注:同列不同字母表示群落类型间差异显著(p<0.05)。
Note: ifferent letters in the same column indicate significant differences between community types(p<0.05).表 2 清澜港不同红树林优势群落土壤酶活性与土壤理化因子间的相关性分析
Table 2. Correlation analysis between soil enzyme activities and soil physicochemical factors in different dominant mangrove communities of Qinglan port
项目
Item脲酶
URE磷酸酶
PHO过氧化氢酶
CAT蔗糖酶
SUC脲酶 URE 1 磷酸酶 PHO 0.488** 1 过氧化氢酶 CAT 0.554** 0.226 1 蔗糖酶 SUC 0.310* 0.214 0.482** 1 pH值 0.085 0.047 0.001 0.189 土壤含水量 SWC 0.788** 0.469** 0.664** 0.591** 土壤有机碳含量 SOC 0.414** 0.252 0.517** 0.437** 土壤微生物生物量碳含量 MBC 0.481** 0.425** 0.632** 0.613** 土壤全氮含量 TN 0.447** 0.333* 0.500** 0.443** 土壤全磷含量 TP 0.468** 0.128 0.272 −0.025 土壤全钾含量 TK 0.442** 0.307* 0.212 0.122 土壤微生物生物量氮含量 MBN 0.333* 0.535** 0.251 0.418** 土壤还原性物质总量 RS 0.632** 0.628** 0.293* 0.158 注:*和**分别表示显著相关(P<0.0.5)和极显著相关(P<
0.01)。
Note: *and**indicate the correlation is significant at P<0.05 and P<0.01 levels.表 3 清澜港不同红树林优势群落土壤酶活性的解释变量冗余分析
Table 3. Redundancy analysis of the soil enzyme activity in different dominant mangrove communities of Qinglan port
参数
Parameter第1轴
Axis1第2轴
Axis2第3轴
Axis3特征值
Eigenvalue0.411 0.109 0.008 土壤酶活性-环境相关性
Soil enzyme activity-environmental
correlation0.897 0.707 0.686 土壤酶活性累计解释量
Accumulated interpretation amount of
soil enzyme activity/%41.1 52.0 60.0 土壤酶活性--环境累计解释量
Soil enzyme activity-cumulative
environmental interpretation/%66.9 84.5 97.5 -
[1] Jinhyun K, Jaehyun L, Yerang Y, et al. Microbial decomposition of soil organic matter determined by edaphic characteristics of mangrove forests in East Asia[J]. Science of the Total Environment, 2021, 763: 142972. doi: 10.1016/j.scitotenv.2020.142972 [2] Alongi D M. Present state and future of the world, s mangrove forests[J]. Environmental Conservation, 2002, 29(3): 331-349. doi: 10.1017/S0376892902000231 [3] Atwood T B, Connolly R M, Almahasheer H, et al. Global patterns in mangrove soil carbon stocks and losses[J]. Natural climate change, 2017, 7(7): 523-528. doi: 10.1038/nclimate3326 [4] Middleton B A, McKee K L. Degradation of mangrove tissues and implications for peat formation in Belizean island forests[J]. Journal of Ecology, 2001, 89(5): 818-828. doi: 10.1046/j.0022-0477.2001.00602.x [5] Keuskamp J A, Feller I C, Laanbroek H J, et al. Short and long-term effects of nutrient enrichment on microbial exoenzyme activity in mangrove peat[J]. Soil Biology and Biochemistry, 2015, 81: 38-47. doi: 10.1016/j.soilbio.2014.11.003 [6] 欧 伟, 李 琪, 梁文举, 等. 不同水分管理方式对稻田土壤生物学特性的影响[J]. 生态学杂志, 2004, 23(5):53-56. doi: 10.3321/j.issn:1000-4890.2004.05.010 [7] 孙 毅, 和润莲, 何光熊, 等. 滇西并流河谷区土壤酶活性化学计量学特征与环境因子的关系[J]. 应用生态学报, 2021, 32(4):1269-1278. [8] Liu H J, Tian Y, Zheng T L, et al. Studies of glucosidase activities from surface sediments in mangrove swamp[J]. Journal of Experimental Marine Biology and Ecology, 2008, 367(2): 111-117. doi: 10.1016/j.jembe.2008.09.008 [9] Chen Y M, Xu X, Jiao X G, et al. Responses of labile organic nitrogen fractions and enzyme activities in eroded mollisols after 8-year manure amendment[J]. Scientific Reports, 2018, 8: 14179. doi: 10.1038/s41598-018-32649-y [10] 马维伟, 孙文颖. 尕海湿地植被退化过程中有机碳及相关土壤酶活性变化特征[J]. 自然资源学报, 2020, 35(5):1250-1260. [11] 王 鹏, 赵志忠, 马荣林, 等. 海南岛北部潮间带红树林对重金属的累积特征[J]. 生态环境学报, 2014, 23(5):842-846. doi: 10.3969/j.issn.1674-5906.2014.05.017 [12] 郭志华, 张 莉, 郭彦茹, 等. 海南清澜港红树林湿地土壤有机碳分布及其与pH的关系[J]. 林业科学, 2014, 50(10):8-15. [13] 王军广, 王 鹏, 伏箫诺, 等. 海南清澜港红树林湿地沉积物中重金属形态及生物有效性[J]. 西南农业学报, 2019, 32(10):2425-2431. [14] 涂志刚, 吴 瑞, 张光星, 等. 海南岛清澜港红树植物群落类型及其特征[J]. 热带农业科学, 2015, 35(11):21-25. doi: 10.3969/j.issn.1009-2196.2015.11.004 [15] 甄佳宁, 廖静娟, 沈国状. 1987以来海南省清澜港红树林变化的遥感监测与分析[J]. 湿地科学, 2019, 17(1):44-51. [16] 叶龙飞, 粱蔚鸿. 清澜港附近盐度变化与潮汐降水的关系[J]. 热带海洋, 1983(3):248-249. [17] 洪奕丰, 李浩然, 刘 强, 等. 台风灾害对文昌市的林业干扰影响因子分析[J]. 华东森林经理, 2012, 26(4):42-49. doi: 10.3969/j.issn.1004-7743.2012.04.014 [18] 梁海萍, 梁海燕, 车志伟, 等. 近五十年登陆海南省的热带气旋统计特征分析[J]. 海洋预报, 2015, 32(4):68-74. doi: 10.11737/j.issn.1003-0239.2015.04.008 [19] NY/T 1121.6—2006, 土壤有机质的测定[S]. [20] NY/T1121.24—2012, 土壤全氮的测定[S]. [21] HJ632—2011, 土壤总磷的测定[S]. [22] LY/T 1234—2015, 森林土壤钾的测定[S]. [23] NY/T 1377—2007, 土壤pH的测定[S]. [24] 鲁如坤. 土壤农业分析[M]. 北京: 中国农业出版社, 2000. [25] Chen S Y, Zhao Q, Liu W J, et al. Effects of freeze–thaw cycles on soil N2O concentration and flux in the permafrost regions of the Qinghai–Tibetan Plateau[J]. Sciences in Cold and Arid Regions, 2018, 10(1): 69-79. [26] 涂志华, 范志平, 王善祥, 等. 大伙房水库流域不同水源涵养林土壤微生物量碳氮特征及其影响因素[J]. 中国水土保持科学, 2019, 17(4):130-140. [27] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. [28] 卢 虎, 姚 拓, 李建宏, 等. 高寒地区不同退化草地植被和土壤微生物特性及其相关性研究[J]. 草业学报, 2015, 24(5):34-43. doi: 10.11686/cyxb20150505 [29] 肖 烨, 黄志刚, 肖菡曦, 等. 不同水位时期东洞庭湖湿地土壤微生物量碳氮和酶活性变化[J/OL]. 应用生态学报: 1-9. [2021-07-20]. https://doi.org/10.13287/j.1001-9332.202108.036. [30] Lipson D A, Schmidt S K, Monson R K. Carbon availability and temperature control the post-snowmelt decline in alpine soil microbial biomass[J]. Soil Biology and Biochemistry, 2000, 32(4): 441-448. doi: 10.1016/S0038-0717(99)00068-1 [31] 李艳琼, 沈育伊, 黄玉清, 等. 桂林会仙喀斯特湿地不同植物群落土壤养分分布差异与微生物活性特征[J]. 生态科学, 2018, 37(4):24-34. [32] Xiao Y, Huang Z G, Lu X G. Changes of soil labile organic carbon fractions and their relation to soil microbial characteristics in four typical wetlands of Sanjiang Plain, Northeast China[J]. Ecological Engineering, 2015, 82: 381-389. doi: 10.1016/j.ecoleng.2015.05.015 [33] Singh J S, Reghbanshi A S, Singh RS, et al. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna[J]. Nature, 1989, 338(4): 499-500. [34] Song Y Y, Song C C, Yang G S, et al. Changes in labile organic carbon fractions and soil enzyme activities after marshland reclamation and restoration in the Sanjiang Plain in Northeast China[J]. Environmental Management, 2012, 50(3): 418-426. doi: 10.1007/s00267-012-9890-x [35] 吕瑞恒, 周正立, 于 军, 等. 和田河上游不同植物群落土壤理化性质及酶活性分析[J]. 林业科学研究, 2016, 29(1):117-123. doi: 10.3969/j.issn.1001-1498.2016.01.017 [36] 张星星, 杨柳明, 陈 忠, 等. 中亚热带不同母质和森林类型土壤生态酶化学计量特征[J]. 生态学报, 2018, 38(16):5828-5836. [37] 焦泽彬, 李羿桥, 陈子豪, 等. 川西亚高山不同森林类型土壤酶活性对短期凋落物输入量变化的响应[J]. 应用与环境生物学报, 2021, 27(3):608-616. [38] 陆宇明, 许恩兰, 吴东梅, 等. 凋落物双倍添加和移除对米槠林土壤水解酶活性及其化学计量比的影响[J]. 水土保持学报, 2021, 35(4):313-320. [39] 孙思怡, 卢胜旭, 陆宇明, 等. 杉木林下套种阔叶树对土壤生态酶活性及其化学计量比的影响[J]. 林业科学研究, 2021, 34(1):106-113. [40] 莫 雪, 陈斐杰, 游 冲, 等. 黄河三角洲不同植物群落土壤酶活性特征及影响因子分析[J]. 环境科学, 2020, 41(2):895-904. [41] 白 静, 严锦钰, 何东进, 等. 互花米草入侵对闽东滨海湿地红树林土壤理化性质和酶活性的影响[J]. 北京林业大学学报, 2017, 39(1):70-77. [42] 王 玲, 赵广亮, 周红娟, 等. 华北地区油松人工林林分密度对土壤化学性质和酶活性的影响[J]. 中南林业科技大学学报, 2020, 40(12):9-16,33. [43] 李 聪, 吕晶花, 陆 梅, 等. 滇东南典型常绿阔叶林土壤酶活性的海拔梯度特征[J]. 林业科学研究, 2020, 33(6):170-179. -




 下载:
下载: