-
五倍子(Chinese gallnut)是五倍子蚜虫(Melaphis chinensis)寄生引起植物叶变态发育形成的虫瘿[1]。依据2020版《中华人民共和国药典》对五倍子的描述,漆树科植物盐肤木(Rhus chinensis Mill.)、青麸杨(R. potaninii Maxim)、红麸杨(R. punjabensis J.L. Stewart ex Brandis)是五倍子蚜虫的寄生树种。五倍子可被分为角倍和肚倍,角倍蚜(Schlechtendalia chinensis Bell)在盐肤木上寄生形成的虫瘿被称作角倍[2]。五倍子是我国重要的创汇林业资源,水解单宁含量丰富,可达到五倍子干质量的74.79%,缩合单宁最高可达到五倍子干质量的1.92%[3]。五倍子中富含的单宁类多酚化合物,具备抗氧化、抗菌、抗癌、抗病毒和神经保护等多种生物学效用,在医学、印染、制革、化工等方面应用广泛[4-6]。
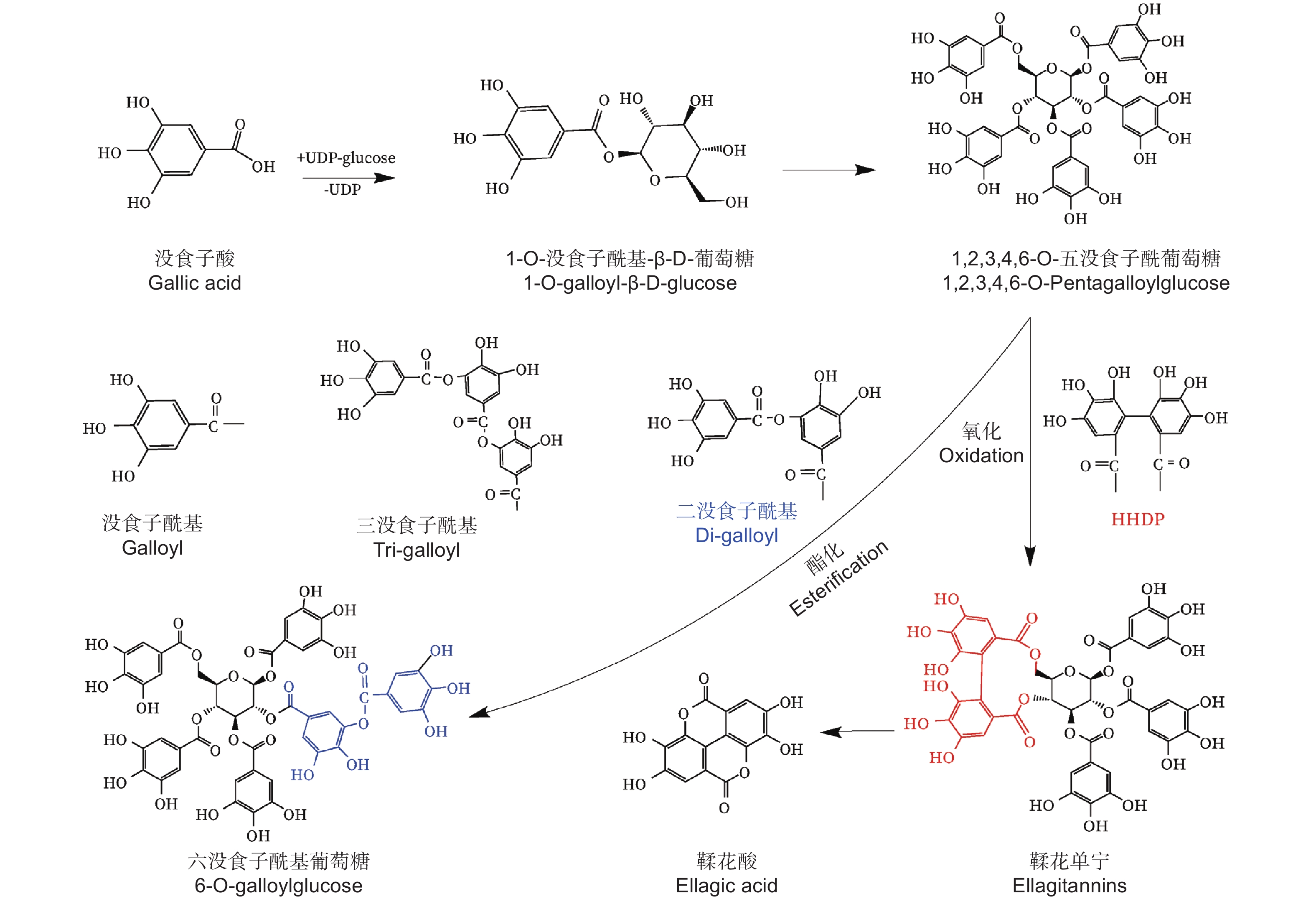
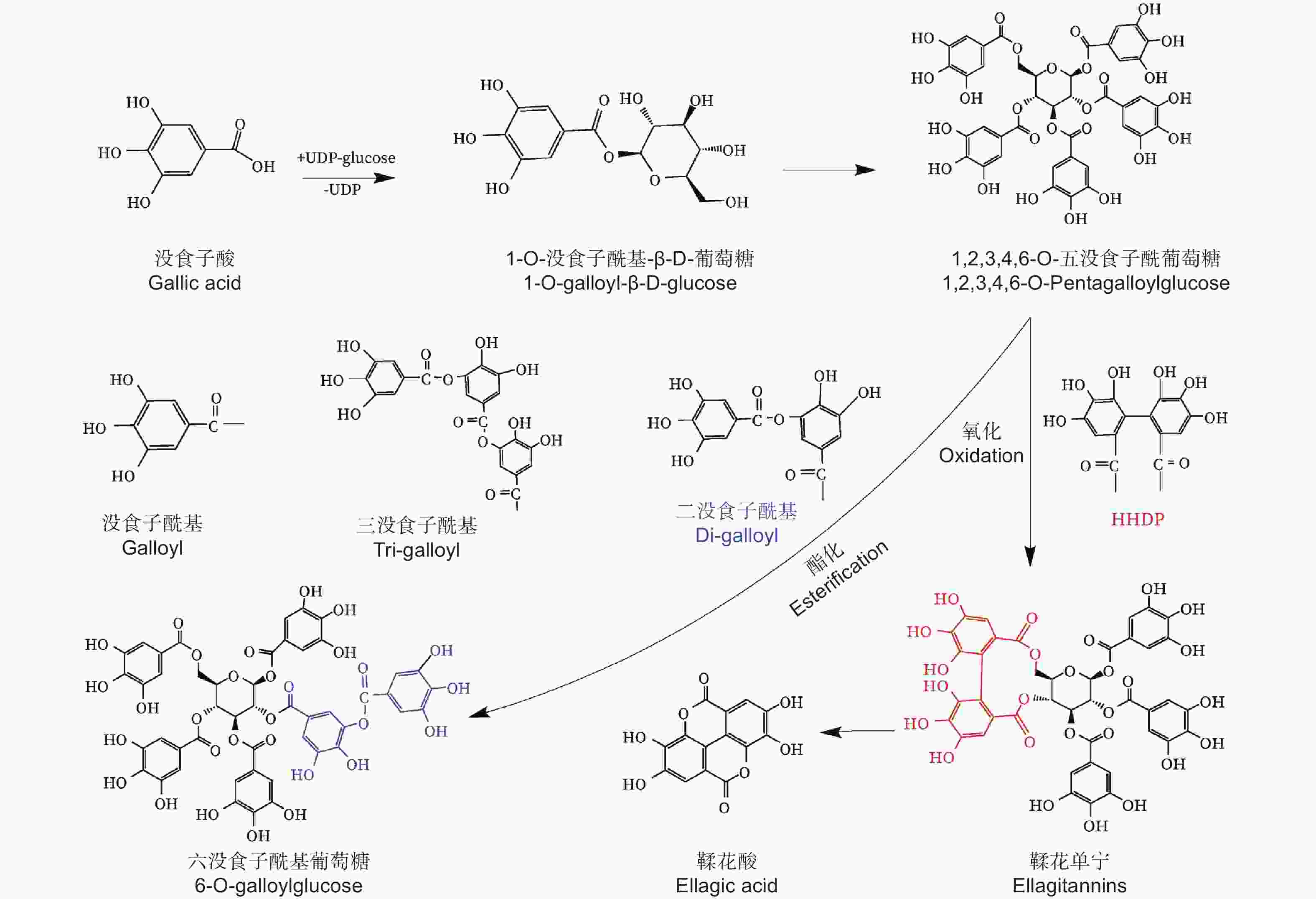
水解单宁通常被分为没食子单宁和鞣花单宁[7]。上世纪初,研究学者便开展了对没食子单宁结构及组分的研究,没食子单宁的中心葡萄糖可连接1至12个没食子酰基基团,形成没食子酰基葡萄糖(Galloylglucose,GG)[8-9]。1,2,3,4,6–五–O–没食子酰基–β–D–葡萄糖(PGG)具备5个没食子酰基,PGG结构上的没食子酰基结合1个新的没食子酰基,这两个没食子酰基则形成二没食子酰基基团(图1),增加1个没食子酰基基团的PGG被称为六没食子酰基葡萄糖(图1),PGG结构上的没食子酰基结合两个新的没食子酰基,则形成三没食子酰基基团(图1),增加两个没食子酰基的PGG被称为七没食子酰基葡萄糖,通过形成多个二没食子酰基基团和三没食子酰基基团,PGG可生成高分子质量的“复杂没食子单宁”。PGG结构上的两个没食子酰基之间以C–C键连接,生成特征基团六羟基二苯(HHDP),则形成鞣花单宁(图1)[10-13]。
单宁的分子质量最高可达20 000 Da,大量的酚羟基也易发生氧化水解反应[14]。除此之外,不同没食子单宁之间结构性质相似,为五倍子单宁成分分析带来了挑战。有研究表明,使用蒸馏水提取五倍子化合物成分后,将提取液溶解于95%乙醇溶液,HPLC–TOF–MS技术可检测到1–GG至3–GG,以及大量的单宁同分异构体[15]。一种基于UHPLC–MS/MS的技术,使用沸水回流的方法提取五倍子粉末,在提取液中鉴定到1–GG至8–GG[16]。一种基于HPLC–ESI–MS的方法,使用100 ℃水溶液提取五倍子,在提取液中鉴定到1–GG至8–GG[17]。基质辅助解析/电离–飞行时间–质谱(MALDI–TOF–MS)在高分子质量化合物的电离上有一定优势,有研究考察了阳离子化试剂对MALDI–TOF–MS技术鉴定五倍子单宁的影响,在购买的分析试剂级五倍子提取物中,鉴定到3–GG至14–GG[18],然而,该方法未能分离单宁的同分异构体。目前,五倍子单宁成分的分析,没有统一的标准和方法,很多研究不能全面地鉴定高分子质量的没食子单宁。超高效液相色谱–四极杆飞行时间–质谱联用技术(UHPLC–QTOF–MS)具备优越的分离和定性鉴别能力[19],该技术可被用来鉴定水解单宁、黄酮类等多酚化合物[20-21],是植物活性成分分离和表征的重要分析手段。依据前人的研究基础,本实验以–80 ℃冻存的角倍和烘干处理的角倍为材料,采用高温提取和超声波辅助提取2种提取方式,选用乙醇、水和丙酮3种不同的提取溶剂,基于UHPLC–QTOF–MS技术对五倍子单宁成分进行测定、并探讨单宁的裂解规律,以期为五倍子中活性物质的开发提供实验依据。
-
供试材料为盐肤木叶翅上着生的角倍,于2020年8月采于湖北省宜昌市五峰县。角倍采摘后进行清洗,并清除角倍内蚜虫及杂质,液氮速冻后保存在–80 ℃超低温冰箱,另一部分角倍放于烘箱内,105 ℃杀青30 min,之后80 ℃烘干至质量恒定。
-
乙醇、丙酮、甲酸(色谱纯)购自Sigma公司;乙腈购自Honeywell公司;质谱级超纯水(18.2MΩ·cm)由Milli–Q水净化系统制备。
-
没食子酸甲酯(CAS:99–24–1)、鞣花酸(CAS:476–66–4)购自普西堂生物有限公司,单宁酸(CAS:1401–55–4)、PGG(CAS:14937–32–7)、没食子酸(CAS:149–91–7)购自索莱宝生物有限公司。
-
试验仪器为Agilent6560Q UHPLC–Q–TOF液质联用系统,美国Agilent公司;PoroshellSB–AqC18(2.1 × 100 mm,2.7 µm)色谱柱,美国Agilent公司;KQ–500DE数控超声波清洗器,昆山市超声仪器有限公司;CPA224S电子天平,德国Sartorius公司;MLS–3750高压蒸汽灭菌锅,日本SANYO公司;Milli–Q水净化系统,德国MerckKGaA公司。
-
使用液氮研磨冷冻保存的角倍样本,研磨后的粉末过60目筛,称取均质后的五倍子粉末0.100 g;
将0.100 g五倍子粉末分散于50 mL纯水,放入高压蒸汽灭菌锅(121 ℃)提取30 min,滤纸过滤后重复提取30 min;
将0.100 g五倍子粉末分散于50 mL纯水,超声波提取,提取功率1 500 W,提取30 min,过滤后重复提取30 min;提取温度65 ℃。
将以上提取液放置室温后,使用超纯水定容至100 mL,0.22 µm滤膜过滤后获得待测液。
-
称取PGG、鞣花酸、没食子酸甲酯、没食子酸和单宁酸,分别使用超纯水配制为1.00 mg·mL–1的标准溶液,用来作对照品溶液,辅助化学物质的鉴定。
-
柱温35 ℃,进针体积5 µL。流动相为0.1%甲酸水溶液(A),乙腈(B)。流速:0.3 mL·min–1。梯度洗脱程序为0~5 min,98%A;5~8 min,90%A;8~40 min,75%A;40~45 min,10%A;保持5 min,后运行4 min停止。
-
离子源为ESI负离子源;扫描质量数范围为m/z 100~3200;干燥气温度320 ℃;干燥气流速8 L·min–1;鞘气温度350 ℃;鞘气流速12 L·min–1;雾化器压力40 psi;毛细管电压负离子3 500 V;去簇电压380 V;采集模式为Full scan Auto MS/MS。
-
UHPLC–QTOF–MS技术能够提供测定物质的精确分子质量和离子裂解碎片信息。在总离子流图的基础上,由提取离子流图和一级高分辨率质谱信息获得相应化合物的保留时间和精确的分子质量,使用软件对采集到的酚类化合物进行定性,产生化合物相应的分子式。获得化合物的特征裂解碎片信息后结合标准品及文献报道数据进行鉴定,并推测化合物可能的裂解途径。使用Chem Draw 20.0和Adobe Illustrator 2021软件进行化合物结构图的绘制。
-
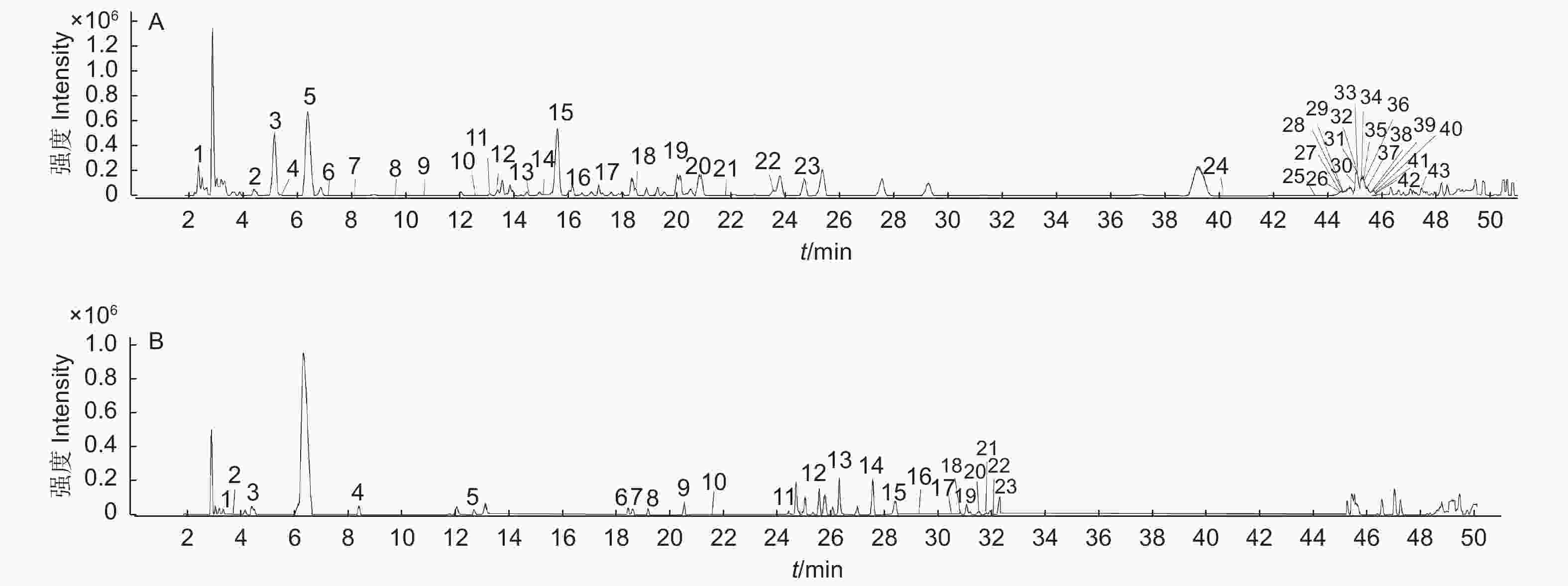
本试验关注的有效物质为多酚类化合物,负离子模式响应效果优于正离子模式。因此,选择负离子ESI进行电离。对五倍子的提取溶液进样分析,得到了负离子模式下的总离子流图(图2)。基于目标化合物的保留时间和高分辨率质谱数据,结合标准品及查阅文献进行确定。在高温121 ℃提取条件下,干五倍子和冻存五倍子提取液中均只鉴定到1–GG至8–GG,而在超声波辅助提取条件下,五倍子水提取液中均检测到1–GG至14–GG。除此之外,还检测到没食子酸、间双没食子酸、鞣花酸、橡碗酸二内酯、儿茶素及没食子酸甲酯。
-
在超声波辅助提取条件下均鉴定到了14种没食子单宁, 65 ℃水浴条件下鉴定到最多的单宁异构体,其中,2–GG检测到8个异构体(图3),3–GG检测到5个异构体,鞣花酸检测到5个异构体,4–GG检测到4个异构体,7–GG、9–GG、11–GG、12–GG分别检测到2个异构体(表1)。而在60 ℃和55 ℃条件下,仅3–GG和4–GG检测到异构体。
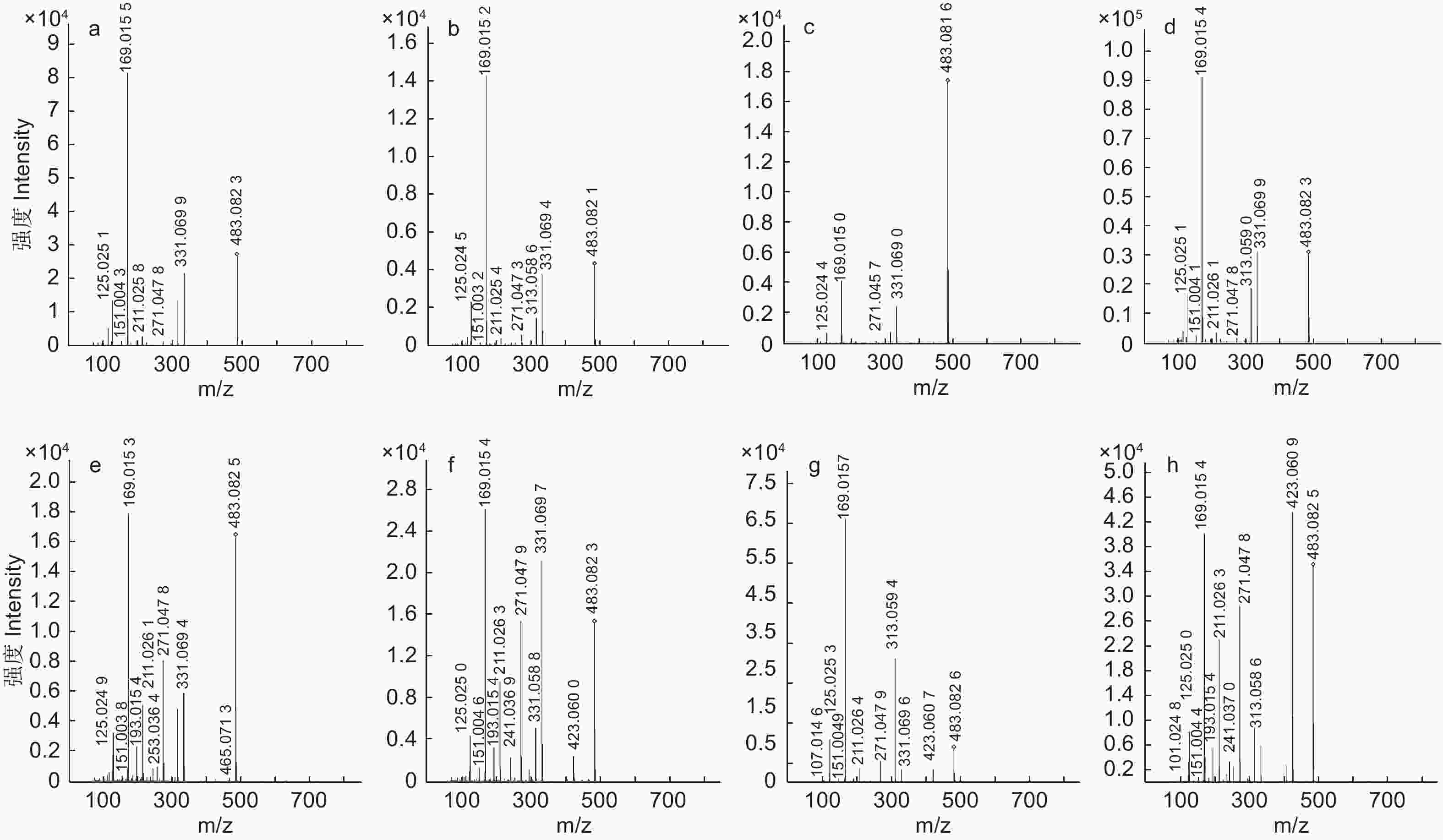
表1中的编号与总离子流色谱图中图A的编号相对应,编号为2的准分子离子峰为m/z331[M–H]–,确定该化合物的分子质量为332 Da,产生了m/z271[M–H–60]–、m/z169[M–H–162]–的裂解碎片,其中,母离子脱去一个特征性的葡萄糖苷(162 Da)得到m/z169碎片离子,表明该物质结构包含一个没食子酸的取代基,结合文献数据推测该化合物为1–GG[22],1–GG的裂解规律主要体现在糖苷的损失及C2H2O(60 Da)的特定中性损失。
表 1 超声波65 ℃条件下五倍子水提取物的酚类化合物
Table 1. Phenolic compounds of water extract in Chinese gallnut, as extracted by ultrasound 65 ℃ method
编号
No化合物
Compounds分子式
Formula保留时间
Rt/min测定值
Measured理论值
Calculated碎片离子
Fragments误差
Error1 橡碗酸二内酯 C21H10O13 2.38 469.010 6 469.004 8 451.094 3, 425.115 4, 407.104 5 2.56 2 1–GG C13H16O10 4.45 331.070 3 331.067 1 271.047 9, 169.014 4 9.67 3 2–GG C20H20O14 5.17 483.082 3 483.078 0 331.069 9, 271.047 8, 211.025 8, 169.015 5, 151.004 3, 125.025 1 8.90 4 没食子酸* C7H6O5 5.32 169.015 5 169.014 2 125.025 2, 107.030 3, 79.019 6 7.69 5 2–GG C20H20O14 6.55 483.082 2 483.078 0 331.069 4, 313.058 6, 271.047 3, 211.025 4, 169.015 2, 151.003 2, 125.024 5 8.69 6 2–GG C20H20O14 7.32 483.081 1 483.078 0 331.069 0, 271.045 7, 169.015 0, 125.024 4 6.42 7 鞣花酸* C14H6O8 8.03 301.000 2 300.998 9 169.014 2, 151.005 0, 123.009 3, 107.013 8 4.32 8 2–GG C20H20O14 9.64 483.082 6 483.078 0 331.069 9, 313.059 0, 271.047 8, 211.026 1, 169.015 4, 151.004 1, 125.025 1 9.52 9 2–GG C20H20O14 10.68 483.082 5 483.078 0 465.071 3, 331.069 4, 271.047 8, 253.036 4, 211.026 1, 193.015 4, 169.015 3, 151.003 8, 125.024 9 9.32 10 橡碗酸二内酯 C21H10O13 12.57 469.008 5 469.004 8 450.997 0, 425.019 0, 407.007 6, 379.012 4, 353.032 0, 299.993 2, 273.005 3 9.32 11 2–GG C20H20O14 13.19 483.082 7 483.078 0 423.060 0, 331.069 7, 313.058 8, 195.047 5, 271.047 9, 211.026 3, 193.015 4, 169.015 4, 151.004 6, 125.025 0 9.73 12 3–GG C27H24O18 13.34 635.085 3 635.088 9 483.082 3, 465.071 3, 313.058 9, 271.047 7, 193.015 3, 169.015 3, 125.025 1 –5.67 13 2–GG C20H20O14 14.65 483.080 0 483.078 0 423.060 7, 331.069 6, 313.059 4, 271.047 9, 211.026 4, 169.015 7, 151.004 9, 125.025 3, 107.014 6 4.14 14 2–GG C20H20O14 15.07 483.082 8 483.078 0 423.060 9, 313.058 6, 271.047 8, 211.026 3, 193.015 4, 169.015 4, 151.004 4, 125.025 0 9.94 15 间双没食子酸 C14H10O9 15.59 321.026 0 321.025 2 169.015 5, 125.025 3, 79.019 5 2.49 16 3–GG C27H24O18 16.50 635.095 2 635.088 9 617.083 0, 465.071 9, 423.060 4, 313.059 0, 271.026 2, 169.015 4, 125.024 9 9.92 17 3–GG C27H24O18 17.27 635.095 2 635.088 9 483.082 4, 423.060 3, 331.069 3, 211.026 1, 169.015 4, 125.025 0 9.92 18 4–GG C34H28O22 18.68 787.107 6 787.099 9 635.095 1, 617.084 5, 465.071 3, 295.048 2, 169.015 2, 125.024 9 9.78 19 3–GG C27H24O18 20.05 635.089 4 635.088 9 465.067 2, 321.024 4 0.79 20 3–GG C27H24O18 20.57 635.094 8 635.088 9 483.081 9, 465.071 7, 423.060 0, 313.058 8, 271.025 9, 169.015 2, 125.024 9 9.29 21 4–GG C34H28O22 21.77 787.107 7 787.099 9 635.094 8, 465.071 0, 295.048 1, 169.015 2, 125.024 9 9.91 22 4–GG C34H28O22 23.58 787.107 5 787.099 9 635.094 8, 465.071 4, 295.048 0, 169.015 2 9.66 23 4–GG C34H28O22 24.87 787.100 8 787.099 9 635.094 3, 617.084 5, 465.071 4, 295.048 2, 169.015 3 1.14 24 鞣花酸* C14H6O8 40.99 301.001 8 300.998 9 283.958 5, 257.011 1, 229.016 0, 185.025 7, 145.030 2 9.63 25 鞣花酸* C14H6O8 43.57 301.001 4 300.998 9 283.998 2, 257.011 0, 229.015 8, 201.020 5, 185.025 5, 145.030 2, 129.035 3 8.31 26 9–GG C69H48O42 44.33 773.080 0 773.073 7 769.095 0, 621.078 0, 545.062 5, 469.055 9, 393.049 4, 169.014 9 8.15 27 10–GG C76H52O46 44.38 849.088 2 849.079 2 769.095 0, 697.073 9, 621.068 3, 545.062 4, 469.056 4, 393.049 2, 169.014 9 10.06 28 11–GG C83H56O50 44.55 925.094 3 925.084 7 849.087 2, 773.081 4, 697.074 7, 621.068 2, 545.062 6, 469.056 1, 393.049 1 10.38 29 12–GG C90H60O54 44.62 1 001.102 0 1 001.090 1 925.090 5, 849.086 4, 773.081 3, 697.075 4, 621.068 4, 545.062 5, 469.056 2, 393.047 6 11.89 30 6–GG C48H36O30 44.96 1 091.122 4 1 091.121 3 939.110 5 1.01 31 鞣花酸* C14H6O8 45.09 301.001 3 300.998 9 283.998 1, 257.010 6, 229.015 6, 201.020 3, 185.025 5, 145.029 9, 129.034 5 7.97 32 PGG* C41H32O26 45.10 469.052 8 469.051 8 787.100 8, 635.089 9, 617.079 5, 465.068 3, 169.014 5 2.13 33 7–GG C55H40O34 45.13 1 243.133 2 1 243.132 3 1 091.121 0, 939.107 7 0.72 34 7–GG C55H40O34 45.35 1 243.133 2 1 243.132 3 1 091.123 7, 939.111 7 3.46 35 11–GG C83H56O50 45.42 925.083 8 925.084 7 1 699.163 1, 1 547.154 1, 1 395.144 4,
1 243.133 1, 849.078 7, 697.067 7,
621.062 1, 469.051 6, 301.000 0–0.97 36 8–GG C62H44O38 45.43 1 395.145 9 1 395.143 2 1 243.136 8, 1 091.123 6, 621.064 5, 545.058 2, 301.000 0 1.94 37 儿茶素 C15H14O6 45.49 289.071 3 289.071 7 261.005 8, 242.994 6, 217.015 5, 189.020 4, 161.025 2 1.38 38 9–GG C69H48O4 45.59 1 547.156 5 1 547.154 7 1 395.149 0, 1 243.138 6, 1 091.124 2, 697.070 9, 545.058 7, 301.000 7 1.16 39 10–GG C76H52O46 45.61 1 699.156 7 1 699.165 6 1 547.162 4, 1 395.085 8 –5.24 40 12–GG C90H60O54 45.67 1 001.091 6 1 001.090 1 1 699.167 1, 1 395.146 6, 849.080 4, 301.000 8, 183.030 6 1.50 41 13–GG C97H64O58 45.69 1 077.598 6 1 077.597 3 925.085 9, 301.000 8, 183.030 5 1.21 42 14–GG C104H68O62 45.69 1 153.603 6 1 153.602 8 925.085 7, 301.000 9, 183.030 6 0.69 43 鞣花酸 C14H6O8 47.44 301.001 4 300.998 9 229.015 5 8.31 注:“*”表示与标准品对照的化合物。
Note: “*” Represent identified by the standard compound.编号为3、5、6、8、9、11、13、14的化合物准分子离子峰为m/z483[M–H]–,确定其分子质量为484 Da,主要裂解离子为m/z313[M–H–170]–、m/z271[M–H–170–42]–、m/z211[M–H–170–42–60]–、m/z169[M–H–170–42–60–42]–、m/z151[M–H–170–42–60–42–18]–、m/z125.0243[M–H–170–42–60–42–18–44]–,m/z169的裂解离子表明该化合物存在没食子酸取代结构,m/z125的特征碎片离子是由没食子酸脱去一个羧基(44 Da)形成的。该化合物的裂解规律主要体现在没食子酸(170 Da)、羧基、H2O(18 Da)、C2H2O(60 Da)及42 Da的中性损失。化合物12、16、17、19、20的准分子离子峰为m/z635[M–H]–,确定其分子质量为636 Da,该化合物典型碎片离子有m/z617[M–H–18]–、m/z483[M–H–152]–、m/z465[M–H–18–152]–、m/z331[M–H–152–152]–、m/z313[M–H–18–152–152]–及m/z271、m/z211、m/z169、m/z125等特征性裂解碎片,mz/152的特征性损失是化合物脱去一个没食子酰基(152 Da)形成的。该化合物的裂解规律主要体现在没食子酰基的连续损失及水分子的损失。结合文献数据,这两种化合物分别鉴定为2–GG和3–GG[23]。
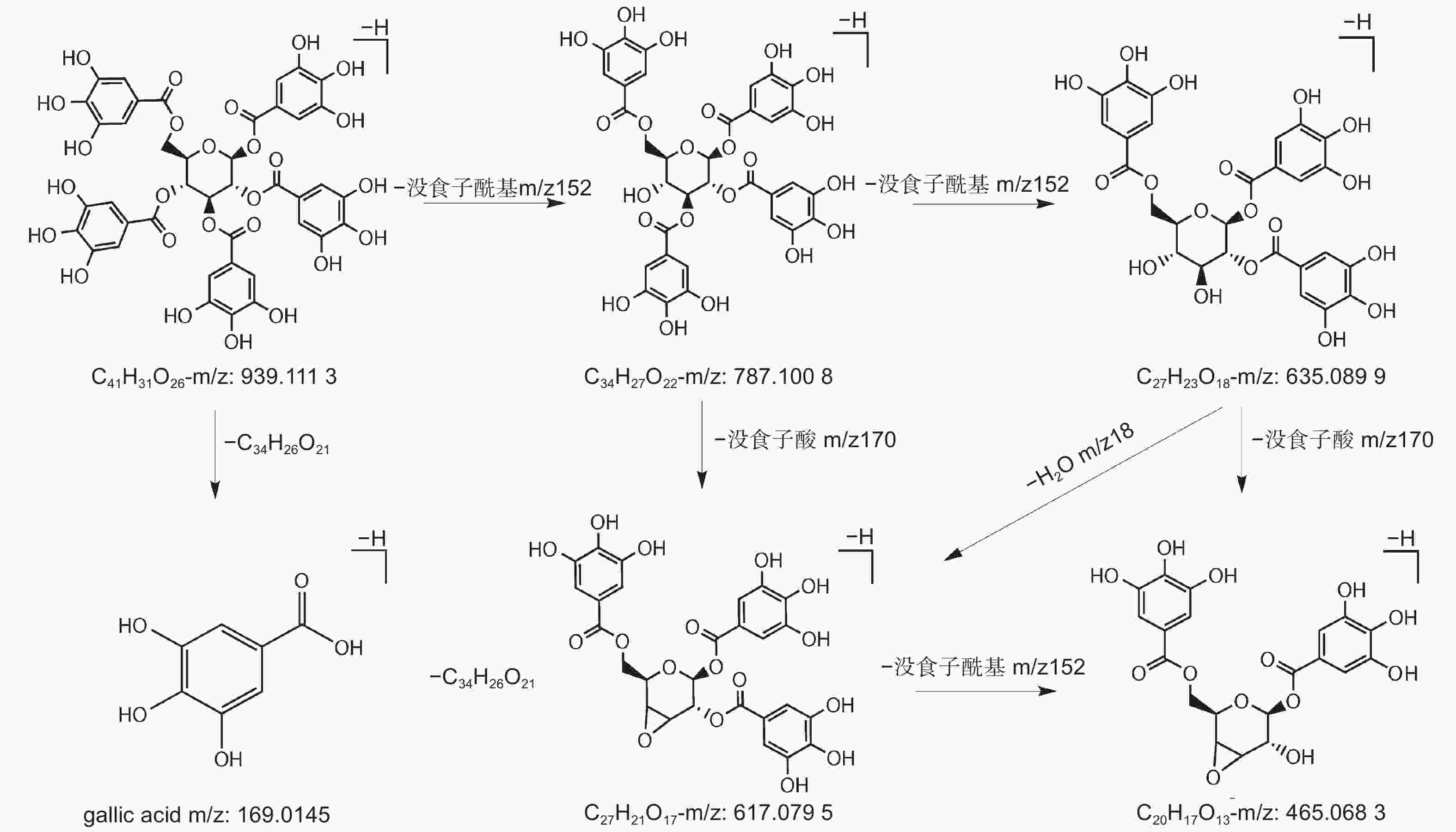
编号为18、21、22、23的化合物准分子离子峰为m/z787,化合物32的准分子离子峰为m/z469[M–2H]2–,两者特征裂解碎片主要表现出没食子酰基和水的损失,并产生了特征性碎片离子m/z169、m/z125。结合文献数据[24-25],将两种化合物鉴定为4–GG和PGG。对于PGG,m/z787碎片离子是由母离子脱去一个没食子酰基形成的,继续损失一个没食子酰基则生成m/z635碎片,再丢失一个水分子形成m/z617碎片,之后失去一个没食子酰基,则生成m/z465离子碎片,也可能由m/z635丢失没食子酸形成的(图4)。
编号为30的化合物准分子离子为m/z1 091[M–H]–,化合物33、34的准分子离子峰为m/z1 243[M–H]–,并在碰撞过程中连续失去没食子酰基。化合物36的准分子离子峰为m/z1395[M–H]–,经活化碰撞产生了裂解碎片m/z1 243[M–H–152]–、m/z1 091[M–H–152–152]–、m/z621[M–2H–152]2–、m/z545[M–2H–152–152]2–。结合文献信息,这3种化合物被推定为6–GG、7–GG和8–GG[23]。化合物26的准分子离子峰为m/z773[M–2H]2–、化合物38的准分子离子峰为1 547[M–H]–,两者的分子质量均为1 548 Da。化合物27的准分子离子峰为849[M–2H]2–,化合物39的准分子离子峰为m/z1 699[M–H]–、确定两者的分子质量均为1 700 Da。化合物35的准分子离子峰为m/z925[M–2H]2–,确定该物质的分子质量为1 852 Da,二级质谱显示它们都具备特征性的没食子酰基的丢失情况,这3种化合物分别被推定为9–GG、10–GG和11–GG[26]。化合物40的准分子离子峰为m/z1 001[M–2H]2–、确定其分子质量为2 004 Da,并产生了m/z1 699[M–H–152–152]–、m/z1 395[M–H–152–152–152–152]–及m/z301和m/z183.030等特征性裂解离子,被鉴定为12–GG。化合物41的准分子离子峰为为m/z1 077[M–2H]2–、确定其分子质量为2 156 Da,化合物42的准分子离子峰为m/z1 153[M–2H]2–、确定其分子质量为2 308 Da,两者产生了m/z925、m/z301、m/z183等特征性裂解离子,被推定为12–GG、13–GG和14–GG[18]。
-
在高温121 ℃条件下,烘干的五倍子和冻存的五倍子水提取溶液中都只能鉴定到1–GG至8–GG,其中3–GG鉴定到5个同分异构体,PGG鉴定到4个同分异构体,1–GG、4–GG、6–GG、7–GG均鉴定到2个同分异构体(表2)。表2中的编号与总离子流色谱图中图B的编号相对应。
表 2 高温121℃提取条件下五倍子水提取物的酚类化合物分析
Table 2. Phenolic compounds of water extract in Chinese gallnut, as extracted by high temperature 121℃ method
编号
No化合物
Compounds分子式
Formula保留时间
Rt/min测定值
Measured理论值
Calculated碎片离子
Fragments误差
Error1 1–GG C13H16O10 3.41 331.068 0 331.067 1 271.858 6, 169.014 1, 125.024 3 2.72 2 没食子酸* C7H6O5 3.71 169.014 6 169.014 2 125.025 1, 96.960 2 2.37 3 1–GG C13H16O10 4.24 331.067 9 331.067 1 271.048 2 2.42 4 2–GG C20H20O14 8.44 483.079 0 483.078 0 313.056 7, 271.942 5, 169.014 1, 125.0243 2.07 5 没食子酸甲酯* C8H8O5 12.70 183.030 3 183.029 4 — 4.92 6 3–GG C27H24O18 18.32 635.090 6 635.088 9 465.068 0, 331.025 4, 169.014 4 2.68 7 间双没食子酸 C14H10O9 18.54 321.025 0 321.025 2 169.013 7, 125.024 1 0.88 8 3–GG C27H24O18 19.21 635.090 3 635.088 9 465.071 7, 423.060 0, 313.058 8, 271.0260, 169.015 2, 125.024 9 2.20 9 3–GG C27H24O18 20.52 635.090 6 635.088 9 465.070 9, 313.058 7, 169.015 2 2.68 10 3–GG C27H24O18 21.62 635.090 4 635.088 9 483.081 9,313.058 7,169.015 3 2.36 11 3–GG C27H24O18 24.43 635.090 5 635.088 9 483.082 3, 195.047 9, 169.015 2 2.52 12 4–GG C34H28O22 25.56 787.101 9 787.099 9 635.094 4, 169.015 0 2.54 13 4–GG C34H28O22 26.20 787.101 9 787.099 9 635.094 3, 617.084 6, 465.071 4, 169.0150 2.54 14 PGG* C41H32O26 27.44 939.113 1 939.110 9 787.1049 , 469.052 9, 393.047 2, 321.0256 2.34 15 PGG* C41H32O26 28.31 939.112 8 939.110 9 787.102 5, 625.049 0, 469.052 9, 393.0471, 169.014 5 2.02 16 PGG* C41H32O26 29.27 469.053 1 469.051 8 787.100 7, 625.051 1, 469.053 0, 393.0469, 169.014 6 2.77 17 PGG* C41H32O26 30.47 939.113 2 939.110 9 621.064 1, 545.059 2, 469.053 0 2.45 18 7–GG C55H40O34 30.81 1 243.134 2 1 243.1323 1 091.124 8, 939.111 8, 621.065 0, 545.058 9, 469.053 0 1.53 19 6–GG C48H36O30 31.02 1 091.124 7 1 091.121 3 939.114 0, 787.188 9, 545.057 4 3.12 20 6–GG C48H36O30 31.46 1 091.124 5 1 091.1213 939.112 9 2.93 21 7–GG C55H40O34 31.70 1 243.136 0 1 243.132 3 1 091.130 9 2.98 22 鞣花酸* C14H6O8 32.02 300.999 6 300.998 9 — 2.33 23 8–GG C62H44O38 32.25 1 395.146 9 1 395.1459 1 243.135 8, 1 091.121 9, 697.070 6, 621.064 3, 545.058 5, 300.998 3 0.72 注:“*”表示与标准品对照的化合物,“–”表示未检出。
Note: “*” Represent identified by the standard compound, “–” indicated as not contain.值得注意的是,不同分子质量的没食子单宁之间存在规律的m/z152的差值,与化合物结构间相差一个没食子酰基(152 Da)相吻合,特定没食子酰基的中性损失是该类化合物的特征之一。
-
负离子模式下,鉴定到其他类化合物共6个。其中,没食子酸、鞣花酸、没食子酸甲酯是与标准品品比对确定的。表1中编号为1、10的化合物准分子离子峰为m/z469[M–H]–,并检测到碎片离子m/z451[M–H–18]–、m/z425[M–H–44]–、m/z407[M–H–44–18]–,该化合物的碎片离子主要依赖于水分子和羧基的损失,结合文献鉴定为橡碗酸二内酯[27-28]。化合物4被鉴定为没食子酸,该化合物在负离子模式下产生m/z169[M–H]–的准分子离子峰,羧基键能较弱,容易发生断裂,形成稳定性高的m/z125[M–H–44]–离子,之后,m/z125[M–H–44]–脱去一个水分子形成m/z107[M–H–44–18]–,损失一个CO后形成m/z79[M–H–44–18–28]–[29]。化合物15的准分子离子峰为m/z321、对应的分子质量为322 Da,产生特征裂解碎片m/z169、m/z125和m/z79,参照文献数据[17],推定为间双没食子酸。化合物7、24、25、31、43的准分子离子峰为m/z301[M–H]–,化合物7的特征裂解离子有m/z169、m/z151、m/z123、m/z107,除此之外,其他4个化合物的裂解离子为m/z283、m/z257、m/z229、m/z185、m/z145,结合文献数据鉴定为鞣花酸[30-31]。
-
解析五倍子中的化合物质成分,是五倍子进一步开发利用的基础。然而,单宁组成成分复杂,分子质量大,鉴定到高度没食子酰基化的单宁较为困难。据报道,乙醇、水、乙醇–水溶液、丙酮、丙酮水溶液、甲醇、乙酸乙酯都是提取植物单宁成分的良好溶剂[23, 32-34]。基于不同的提取溶剂对单宁提取效率的影响[35],选定了3种提取溶剂,丙酮、乙醇和水,提取方式为高温高压提取,分别采用了烘干的角倍样本和–80 ℃冷冻保存的角倍样本,经过高分辨质谱分析,获得的提取物中包含相似的单宁组分,主要为1–GG至8–GG。然而,经过大量的实验分析,均未鉴定到高分子质量的没食子单宁组分。
超声波辅助提取可显著减少处理时间,降低提取温度,具备更高的提取效率,是提取水解单宁的有效方法[36],本研究采用了超声波辅助提取方法,在五倍子水提取物中成功鉴定到了1–GG至14–GG。除此之外,考察了3种不同超声提取温度下五倍子水提取物的单宁成分。在55 ℃、60 ℃和65 ℃超声提取条件下,五倍子水提取物均含有1–GG至14–GG。其中,在65 ℃条件下,五倍子水提取物中包含最多的没食子单宁异构体,可能是因为温度的升高,有利于有效物质的溶解。有研究使用蒸馏水为提取溶剂,提取时间为20 h,在五倍子提取液中鉴定到1–GG至3–GG [15]。一种使用沸水回流提取的方法,提取时间为3 h,在五倍子水提取液中鉴定到1–GG至8–GG[16]。本研究基于超声波辅助提取方法,提取时间为1 h,在五倍子水提取液中测定到14种没食子单宁(表1)。本研究基于高分辨质谱技术,建立了一种有效的鉴定方法,在超声辅助的五倍子水提取液中检测到了高分子质量的单宁成分及大量的单宁同分异构体。
在五倍子提取物的高分辨质谱分析过程中,没食子单宁呈现规律的没食子酰基和没食子酸的丢失情况。[M–H–152]–或[M–H–170]–基峰离子的形成,表明没食子单宁中氧苷键的两种特征性断裂行为。一些碎片离子由糖苷丢失产生,没食子单宁中的氧苷键容易断裂,通过葡萄糖的交叉环切除反应,引起了C2H4O2(60 Da)的丢失,并伴随着H2O和羧基的损失。除此之外,没食子单宁及其同分异构体会产生较为一致的裂解离子。[M–H–152–18–152]–、[M–H–152–18–152–152]–是由于没食子酰基和水分子的相继损失,[M–H–152–152]–是由于没食子酰基的相继损失[33, 37]。对于PGG,同分异构体之间显示出不同的裂解模式。除了本实验中推测的裂解途径外,PGG还可以裂解为m/z769[M–170]–、m/z617[M–170–152]–、m/z465[M–170–152–152]–、m/z313[[M–170–152–152–152]–[38],主要是通过没食子酸和没食子酰基的连续损失进行裂解。
-
超声波辅助提取方法能够有效地提取五倍子中的水解类单宁物质,利用UHPLC–QTOF–MS技术分析五倍子中的单宁成分,成功检测到了1–GG至14–GG及大量的没食子单宁异构体。五倍子单宁主要通过没食子酸(C7H6O5)、没食子酰基(C7H4O4)、H2O、羧基、糖苷、60 Da和42 Da的中性损失进行裂解。该方法能够有效的鉴定到五倍子中的活性物质,质谱裂解模式可应用于其他植物中没食子单宁及其同系物的快速解析,本研究为植物中单宁成分的研究与开发提供科学依据。
基于UHPLC–QTOF–MS技术的五倍子单宁成分分析
Analysis of Tannin of Galla chinensis by UHPLC– QTOF–MS
-
摘要:
目的 基于超高效液相色谱–四极杆飞行时间–质谱(UHPLC–QTOF–MS)技术分析五倍子中单宁成分,建立一种有效的五倍子单宁成分测定方法,并解析单宁的裂解规律。 方法 使用高温和超声波辅助方法提取五倍子中的酚类化合物,基于二级质谱推定化合物的裂解途径。 结果 共鉴定到20种化合物,包含14种没食子单宁、3种酚酸、2种没食子酸酯和1种黄烷醇。以高温121℃为提取条件,均未鉴定到分子质量高于1 500 Da的没食子单宁,而在超声波辅助提取的五倍子水提取液中,成功地检测到1–O–没食子酰基葡萄糖至14–O–没食子酰基葡萄糖,其中,超声功率1 500 W,提取温度65℃条件下,鉴定到更多的没食子单宁异构体。MS/MS图谱显示,五倍子单宁主要通过没食子酸、没食子酰基、糖苷、水、羧基的损失进行裂解。 结论 本研究证明,超声波辅助提取条件下,应用UHPLC–QTOF–MS技术能够全面高效地分析五倍子中的单宁成分,本研究为富含单宁的植物的化学成分研究提供参考依据。 -
关键词:
- 五倍子
- / 没食子单宁
- / 超高效液相色谱–四极杆飞行时间–质谱
- / 裂解规律
Abstract:Objective To develop an effective method for characterizing tannin of Chinese gallnut by ultra-performance liquid chromatography–quadrupole time of flight mass spectrometry (UHPLC–QTOF–MS), and analyze the fragmentation behavior of gallotannins. Methods High temperature and ultrasonic–assisted methods were implemented for extracting phenolic compounds from Chinese gallnut, and the fragmentation pathway of gollotannins were characterized by MS/MS spectrometry. Results A total of 20 compounds were identified, including 14 gallotannins, 2 gallagyl esters, 3 phenolic acids, and 1 flavanol. Gallotannins with molecular mass higher than 1500 Da were not identified when high temperature 121 ℃ was used as extract method, while they were successfully detected by the ultrasound extract method, including 1–O–galloyl–β–D–glucose to 14–O–galloyl–β–D–glucose. Under the conditions of ultrasonic power of 1 500 W and extraction temperature of 65 ℃, more gallotannin isomers were identified. The MS/MS spectrum showed that gallotannins were mainly decomposed by the loss of glucoside, gallic acid, galloyl, H2O and carboxyl. Conclusion In the study, UHPLC–QTOF–MS technology coupled with ultrasonic extraction methods have been proved to determine gallnut tannin comprehensively and efficiently. The identification of gallnut tannin and the analysis of their fragmentation mechanism can provide a reference for research on the chemical composition of other plants rich in tannin. -
Key words:
- Chinese gallnut
- / gallotannins
- / UHPLC–Q–TOF–MS
- / fragmentation behavior
-
表 1 超声波65 ℃条件下五倍子水提取物的酚类化合物
Table 1. Phenolic compounds of water extract in Chinese gallnut, as extracted by ultrasound 65 ℃ method
编号
No化合物
Compounds分子式
Formula保留时间
Rt/min测定值
Measured理论值
Calculated碎片离子
Fragments误差
Error1 橡碗酸二内酯 C21H10O13 2.38 469.010 6 469.004 8 451.094 3, 425.115 4, 407.104 5 2.56 2 1–GG C13H16O10 4.45 331.070 3 331.067 1 271.047 9, 169.014 4 9.67 3 2–GG C20H20O14 5.17 483.082 3 483.078 0 331.069 9, 271.047 8, 211.025 8, 169.015 5, 151.004 3, 125.025 1 8.90 4 没食子酸* C7H6O5 5.32 169.015 5 169.014 2 125.025 2, 107.030 3, 79.019 6 7.69 5 2–GG C20H20O14 6.55 483.082 2 483.078 0 331.069 4, 313.058 6, 271.047 3, 211.025 4, 169.015 2, 151.003 2, 125.024 5 8.69 6 2–GG C20H20O14 7.32 483.081 1 483.078 0 331.069 0, 271.045 7, 169.015 0, 125.024 4 6.42 7 鞣花酸* C14H6O8 8.03 301.000 2 300.998 9 169.014 2, 151.005 0, 123.009 3, 107.013 8 4.32 8 2–GG C20H20O14 9.64 483.082 6 483.078 0 331.069 9, 313.059 0, 271.047 8, 211.026 1, 169.015 4, 151.004 1, 125.025 1 9.52 9 2–GG C20H20O14 10.68 483.082 5 483.078 0 465.071 3, 331.069 4, 271.047 8, 253.036 4, 211.026 1, 193.015 4, 169.015 3, 151.003 8, 125.024 9 9.32 10 橡碗酸二内酯 C21H10O13 12.57 469.008 5 469.004 8 450.997 0, 425.019 0, 407.007 6, 379.012 4, 353.032 0, 299.993 2, 273.005 3 9.32 11 2–GG C20H20O14 13.19 483.082 7 483.078 0 423.060 0, 331.069 7, 313.058 8, 195.047 5, 271.047 9, 211.026 3, 193.015 4, 169.015 4, 151.004 6, 125.025 0 9.73 12 3–GG C27H24O18 13.34 635.085 3 635.088 9 483.082 3, 465.071 3, 313.058 9, 271.047 7, 193.015 3, 169.015 3, 125.025 1 –5.67 13 2–GG C20H20O14 14.65 483.080 0 483.078 0 423.060 7, 331.069 6, 313.059 4, 271.047 9, 211.026 4, 169.015 7, 151.004 9, 125.025 3, 107.014 6 4.14 14 2–GG C20H20O14 15.07 483.082 8 483.078 0 423.060 9, 313.058 6, 271.047 8, 211.026 3, 193.015 4, 169.015 4, 151.004 4, 125.025 0 9.94 15 间双没食子酸 C14H10O9 15.59 321.026 0 321.025 2 169.015 5, 125.025 3, 79.019 5 2.49 16 3–GG C27H24O18 16.50 635.095 2 635.088 9 617.083 0, 465.071 9, 423.060 4, 313.059 0, 271.026 2, 169.015 4, 125.024 9 9.92 17 3–GG C27H24O18 17.27 635.095 2 635.088 9 483.082 4, 423.060 3, 331.069 3, 211.026 1, 169.015 4, 125.025 0 9.92 18 4–GG C34H28O22 18.68 787.107 6 787.099 9 635.095 1, 617.084 5, 465.071 3, 295.048 2, 169.015 2, 125.024 9 9.78 19 3–GG C27H24O18 20.05 635.089 4 635.088 9 465.067 2, 321.024 4 0.79 20 3–GG C27H24O18 20.57 635.094 8 635.088 9 483.081 9, 465.071 7, 423.060 0, 313.058 8, 271.025 9, 169.015 2, 125.024 9 9.29 21 4–GG C34H28O22 21.77 787.107 7 787.099 9 635.094 8, 465.071 0, 295.048 1, 169.015 2, 125.024 9 9.91 22 4–GG C34H28O22 23.58 787.107 5 787.099 9 635.094 8, 465.071 4, 295.048 0, 169.015 2 9.66 23 4–GG C34H28O22 24.87 787.100 8 787.099 9 635.094 3, 617.084 5, 465.071 4, 295.048 2, 169.015 3 1.14 24 鞣花酸* C14H6O8 40.99 301.001 8 300.998 9 283.958 5, 257.011 1, 229.016 0, 185.025 7, 145.030 2 9.63 25 鞣花酸* C14H6O8 43.57 301.001 4 300.998 9 283.998 2, 257.011 0, 229.015 8, 201.020 5, 185.025 5, 145.030 2, 129.035 3 8.31 26 9–GG C69H48O42 44.33 773.080 0 773.073 7 769.095 0, 621.078 0, 545.062 5, 469.055 9, 393.049 4, 169.014 9 8.15 27 10–GG C76H52O46 44.38 849.088 2 849.079 2 769.095 0, 697.073 9, 621.068 3, 545.062 4, 469.056 4, 393.049 2, 169.014 9 10.06 28 11–GG C83H56O50 44.55 925.094 3 925.084 7 849.087 2, 773.081 4, 697.074 7, 621.068 2, 545.062 6, 469.056 1, 393.049 1 10.38 29 12–GG C90H60O54 44.62 1 001.102 0 1 001.090 1 925.090 5, 849.086 4, 773.081 3, 697.075 4, 621.068 4, 545.062 5, 469.056 2, 393.047 6 11.89 30 6–GG C48H36O30 44.96 1 091.122 4 1 091.121 3 939.110 5 1.01 31 鞣花酸* C14H6O8 45.09 301.001 3 300.998 9 283.998 1, 257.010 6, 229.015 6, 201.020 3, 185.025 5, 145.029 9, 129.034 5 7.97 32 PGG* C41H32O26 45.10 469.052 8 469.051 8 787.100 8, 635.089 9, 617.079 5, 465.068 3, 169.014 5 2.13 33 7–GG C55H40O34 45.13 1 243.133 2 1 243.132 3 1 091.121 0, 939.107 7 0.72 34 7–GG C55H40O34 45.35 1 243.133 2 1 243.132 3 1 091.123 7, 939.111 7 3.46 35 11–GG C83H56O50 45.42 925.083 8 925.084 7 1 699.163 1, 1 547.154 1, 1 395.144 4,
1 243.133 1, 849.078 7, 697.067 7,
621.062 1, 469.051 6, 301.000 0–0.97 36 8–GG C62H44O38 45.43 1 395.145 9 1 395.143 2 1 243.136 8, 1 091.123 6, 621.064 5, 545.058 2, 301.000 0 1.94 37 儿茶素 C15H14O6 45.49 289.071 3 289.071 7 261.005 8, 242.994 6, 217.015 5, 189.020 4, 161.025 2 1.38 38 9–GG C69H48O4 45.59 1 547.156 5 1 547.154 7 1 395.149 0, 1 243.138 6, 1 091.124 2, 697.070 9, 545.058 7, 301.000 7 1.16 39 10–GG C76H52O46 45.61 1 699.156 7 1 699.165 6 1 547.162 4, 1 395.085 8 –5.24 40 12–GG C90H60O54 45.67 1 001.091 6 1 001.090 1 1 699.167 1, 1 395.146 6, 849.080 4, 301.000 8, 183.030 6 1.50 41 13–GG C97H64O58 45.69 1 077.598 6 1 077.597 3 925.085 9, 301.000 8, 183.030 5 1.21 42 14–GG C104H68O62 45.69 1 153.603 6 1 153.602 8 925.085 7, 301.000 9, 183.030 6 0.69 43 鞣花酸 C14H6O8 47.44 301.001 4 300.998 9 229.015 5 8.31 注:“*”表示与标准品对照的化合物。
Note: “*” Represent identified by the standard compound.表 2 高温121℃提取条件下五倍子水提取物的酚类化合物分析
Table 2. Phenolic compounds of water extract in Chinese gallnut, as extracted by high temperature 121℃ method
编号
No化合物
Compounds分子式
Formula保留时间
Rt/min测定值
Measured理论值
Calculated碎片离子
Fragments误差
Error1 1–GG C13H16O10 3.41 331.068 0 331.067 1 271.858 6, 169.014 1, 125.024 3 2.72 2 没食子酸* C7H6O5 3.71 169.014 6 169.014 2 125.025 1, 96.960 2 2.37 3 1–GG C13H16O10 4.24 331.067 9 331.067 1 271.048 2 2.42 4 2–GG C20H20O14 8.44 483.079 0 483.078 0 313.056 7, 271.942 5, 169.014 1, 125.0243 2.07 5 没食子酸甲酯* C8H8O5 12.70 183.030 3 183.029 4 — 4.92 6 3–GG C27H24O18 18.32 635.090 6 635.088 9 465.068 0, 331.025 4, 169.014 4 2.68 7 间双没食子酸 C14H10O9 18.54 321.025 0 321.025 2 169.013 7, 125.024 1 0.88 8 3–GG C27H24O18 19.21 635.090 3 635.088 9 465.071 7, 423.060 0, 313.058 8, 271.0260, 169.015 2, 125.024 9 2.20 9 3–GG C27H24O18 20.52 635.090 6 635.088 9 465.070 9, 313.058 7, 169.015 2 2.68 10 3–GG C27H24O18 21.62 635.090 4 635.088 9 483.081 9,313.058 7,169.015 3 2.36 11 3–GG C27H24O18 24.43 635.090 5 635.088 9 483.082 3, 195.047 9, 169.015 2 2.52 12 4–GG C34H28O22 25.56 787.101 9 787.099 9 635.094 4, 169.015 0 2.54 13 4–GG C34H28O22 26.20 787.101 9 787.099 9 635.094 3, 617.084 6, 465.071 4, 169.0150 2.54 14 PGG* C41H32O26 27.44 939.113 1 939.110 9 787.1049 , 469.052 9, 393.047 2, 321.0256 2.34 15 PGG* C41H32O26 28.31 939.112 8 939.110 9 787.102 5, 625.049 0, 469.052 9, 393.0471, 169.014 5 2.02 16 PGG* C41H32O26 29.27 469.053 1 469.051 8 787.100 7, 625.051 1, 469.053 0, 393.0469, 169.014 6 2.77 17 PGG* C41H32O26 30.47 939.113 2 939.110 9 621.064 1, 545.059 2, 469.053 0 2.45 18 7–GG C55H40O34 30.81 1 243.134 2 1 243.1323 1 091.124 8, 939.111 8, 621.065 0, 545.058 9, 469.053 0 1.53 19 6–GG C48H36O30 31.02 1 091.124 7 1 091.121 3 939.114 0, 787.188 9, 545.057 4 3.12 20 6–GG C48H36O30 31.46 1 091.124 5 1 091.1213 939.112 9 2.93 21 7–GG C55H40O34 31.70 1 243.136 0 1 243.132 3 1 091.130 9 2.98 22 鞣花酸* C14H6O8 32.02 300.999 6 300.998 9 — 2.33 23 8–GG C62H44O38 32.25 1 395.146 9 1 395.1459 1 243.135 8, 1 091.121 9, 697.070 6, 621.064 3, 545.058 5, 300.998 3 0.72 注:“*”表示与标准品对照的化合物,“–”表示未检出。
Note: “*” Represent identified by the standard compound, “–” indicated as not contain. -
[1] 査玉平, 雷朝亮, 陈京元. 五倍子蚜与寄主树的互作研究进展[J]. 应用昆虫学报, 2019, 56(2):195-201. doi: 10.7679/j.issn.2095-1353.2019.024 [2] 杨子祥, 张燕平. 中国传统林特产品——五倍子[J]. 生物资源, 2017, 39(5):389-390. [3] CHEN H, LIU J, CUI K, et al. Molecular mechanisms of tannin accumulation in rhus galls and genes involved in plant-insect interactions[J]. Scientific Reports, 2018, 8(1): 9841. doi: 10.1038/s41598-018-28153-y [4] REN Y, ZHANG X, LI T, et al. Galla chinensis, a traditional chinese medicine: comprehensive review of botany, traditional uses, chemical composition, pharmacology and toxicology[J]. Journal of Ethnopharmacology, 2021, 278(1): 114247. [5] FRAGA-CORRAL M, OTERO P, CASSANI L, et al. Traditional applications of tannin rich extracts supported by scientific data: chemical composition, bioavailability and bioaccessibility[J]. Foods (Basel, Switzerland), 2021, 10(2): 251. [6] FALCÃO L, ARAÚJO M E M. Vegetable tannins used in the manufacture of historic leathers[J]. Molecules, 2018, 23(5): 1081. doi: 10.3390/molecules23051081 [7] RUSSELL, ALFRED. The natural tannins[J]. Chemical Reviews, 1935, 17(2): 155-186. doi: 10.1021/cr60057a002 [8] NISHIZAWA M, YAMAGISHI T, NONAKA G I, et al. Tannins and related compounds. part 5. isolation and characterization of polygalloylglucoses from chinese gallotannin[J]. Journal of the Chemical Society Perkin Transactions, 1982: 2963-2968. [9] BEASLEY T H, ZIEGLER H W, BELL A D. Determination and characterization of gallotannin by high performance liquid chromatography[J]. Analytical Chemistry, 1977, 49(2): 238-243. doi: 10.1021/ac50010a016 [10] GRUNDHÖFER P, NIEMETZ R, SCHILLING G, et al. Biosynthesis and subcellular distribution of hydrolyzable tannins[J]. Phytochemistry, 2001, 57(6): 915-927. doi: 10.1016/S0031-9422(01)00099-1 [11] KHANBABAEE K, VAN REE T. Tannins: classification and definition[J]. Natural Product Reports, 2001, 18(6): 641-649. doi: 10.1039/b101061l [12] NIEMETZ R, GROSS G G. Gallotannin biosynthesis: β-glucogallin: hexagalloyl 3-O-galloyltransferase from Rhus typhina leaves[J]. Phytochemistry, 2001, 58(5): 657-661. doi: 10.1016/S0031-9422(01)00300-4 [13] CAI Y, ZHANG J, CHEN N G, et al. Recent advances in anticancer activities and drug delivery systems of tannins[J]. Medicinal Research Reviews, 2017, 37(4): 665-701. doi: 10.1002/med.21422 [14] VUOLO M M, LIMA V S, JUNIOR M. Phenolic compounds: structure, classification, and antioxidant power - sciencedirect[J]. Bioactive Compounds, 2019: 33-50. [15] HUANG X L, LIU M D, LI J Y, et al. Chemical composition of Galla chinensis extract and the effect of its main component(s) on the prevention of enamel demineralization in vitro[J]. International Journal of Oral Science, 2012, 4(3): 146-151. doi: 10.1038/ijos.2012.44 [16] HWANG Y H, JANG S A, KIM T, et al. Anti-osteoporotic and anti-adipogenic effects of Rhus chinensis nutgalls in ovariectomized mice fed with a high-fat diet[J]. Planta Medica, 2019, 85(14-15): 1128-1135. [17] MA S, QIN H, JIANG M, et al. Identification and comparison of tannins in gall of Rhus chinensis Mill. and gall of Quercus infectoria Oliv. by high-performance liquid chromatography-electrospray mass spectrometry[J]. Journal of Chromatographic Science, 2020, 58(5): 403-410. doi: 10.1093/chromsci/bmz096 [18] XIANG P, LIN Y, LIN P, et al. Effect of cationization reagents on the matrix-assisted laser desorption/ionization time-of-flight mass spectrum of chinese gallotannins[J]. Journal of Applied Polymer Science, 2007, 105(2): 859-864. doi: 10.1002/app.26373 [19] GABELICA V, LIVET S, ROSU F. Optimizing native ion mobility q-tof in helium and nitrogen for very fragile noncovalent structures[J]. Journal of the American Society for Mass Spectrometry, 2018, 29(11): 2189-2198. doi: 10.1007/s13361-018-2029-4 [20] TUOMINEN A, SUNDMAN T. Stability and oxidation products of hydrolysable tannins in basic conditions detected by hplc/dad-esi/qtof/ms[J]. Phytochemical Analysis, 2013, 24(5): 424-435. doi: 10.1002/pca.2456 [21] ENGSTRÖM M T, PÄLIJÄRVI M, SALMINEN J P. Rapid fingerprint analysis of plant extracts for ellagitannins, gallic acid, and quinic acid derivatives and quercetin-, kaempferol- and myricetin-based flavonol glycosides by uplc-qqq-ms/ms[J]. Journal of Agricultural and Food Chemistry, 2015, 63(16): 4068-4079. doi: 10.1021/acs.jafc.5b00595 [22] ZHU T, LIU X, WANG X, et al. Profiling and analysis of multiple compounds in rhubarb decoction after processing by wine steaming using uhplc-q-tof-ms coupled with multiple statistical strategies[J]. Journal of Separation Science, 2016, 39(15): 3081-3090. doi: 10.1002/jssc.201600256 [23] TIAN F, LI B, JI B, et al. Identification and structure–activity relationship of gallotannins separated from Galla chinensis[J]. LWT - Food Science and Technology, 2009, 42(7): 1289-1295. doi: 10.1016/j.lwt.2009.03.004 [24] 马尚智, 秦惠玉, 龙 飞. 没食子多酚类化合物的鉴定及其在uplc-ms/ms中的裂解规律研究[J]. 中草药, 2017, 48(22):4632-4638. doi: 10.7501/j.issn.0253-2670.2017.22.007 [25] HOOI POAY T, SUI KIONG L, CHENG HOCK C. Characterisation of galloylated cyanogenic glucosides and hydrolysable tannins from leaves of Phyllagathis rotundifolia by lc-esi-ms/ms[J]. Phytochemical analysis:PCA, 2011, 22(6): 516-525. doi: 10.1002/pca.1312 [26] ZHU F, CAI Y, XING J, et al. Rapid identification of gallotannins from chinese galls by matrix-assisted laser desorption/ionization time-of-flight quadrupole ion trap mass spectrometry[J]. Rapid Communications in Mass Spectrometry RCM, 2010, 23(11): 1678-1682. [27] TARONE A, GOUPY P, GINIES C, et al. Advanced characterization of polyphenols from Myrciaria jaboticaba peel and lipid protection in in vitro gastrointestinal digestion[J]. Food Chemistry, 2021, 359: 129959. doi: 10.1016/j.foodchem.2021.129959 [28] IWAOKA Y, SUZUKI S, KATO N, et al. Characterization and identification of bioactive polyphenols in the Trapa bispinosa Roxb. pericarp extract[J]. Molecules, 2021, 26(19): 5802. doi: 10.3390/molecules26195802 [29] HOFMANN T, TÁLOS-NEBEHAJ E, LEVENTE A. Antioxidant properties and detailed polyphenol profiling of european hornbeam (Carpinus betulus L. ) leaves by multiple antioxidant capacity assays and high-performance liquid chromatography/multistage electrospray mass spectrometry[J]. Industrial Crops and Products, 2016, 87(1): 340-349. [30] MEDIC A, JAKOPIC J, HUDINA M, et al. Identification and quantification of the major phenolic constituents in Juglans regia L. peeled kernels and pellicles, using hplc-ms/ms[J]. Food Chemistry, 2021, 352: 129404. doi: 10.1016/j.foodchem.2021.129404 [31] LI L, SONG L, SUN X, et al. Characterisation of phenolics in fruit septum of Juglans regia Linn. by ultra performance liquid chromatography coupled with orbitrap mass spectrometer[J]. Food Chemistry, 2019, 286: 669-677. doi: 10.1016/j.foodchem.2019.02.054 [32] CHAO B, LIU R, ZHANG X, et al. Tannin extraction pretreatment and very high gravity fermentation of acorn starch for bioethanol production[J]. Bioresource Technology, 2017, 241(1): 900-907. [33] BOULEKBACHE-MAKHLOUF L, MEUDEC E, MAZAURIC J P, et al. Qualitative and semi-quantitative analysis of phenolics in Eucalyptus globulus leaves by high-performance liquid chromatography coupled with diode array detection and electrospray ionisation mass spectrometry[J]. Phytochemical Analysis, 2013, 24(2): 162-170. doi: 10.1002/pca.2396 [34] ENGELS C, GÄNZLE M G, SCHIEBER A. Fractionation of gallotannins from mango (Mangifera indica L. ) kernels by high-speed counter-current chromatography and determination of their antibacterial activity[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 775-780. doi: 10.1021/jf903252t [35] TIAN F, LI B, JI B, et al. Antioxidant and antimicrobial activities of consecutive extracts from Galla chinensis: The polarity affects the bioactivities[J]. Food Chemistry, 2011, 113(1): 173-179. [36] LIANG X, JIANG Y, GUO Z, et al. Separation, uplc-qtof-ms/ms analysis, and antioxidant activity of hydrolyzable tannins from water caltrop (Trapa quadrispinosa) pericarps[J]. LWT - Food Science and Technology, 2020, 133: 110010. doi: 10.1016/j.lwt.2020.110010 [37] WANG S, CHEN L, LENG J, et al. Fragment ion diagnostic strategies for the comprehensive identification of chemical profile of gui-zhi-tang by integrating high-resolution ms, multiple-stage ms and uv information[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 98(1): 22-35. [38] WATRELOT A, LE GUERNEVÉ C, HALLÉ H, et al. Multimethod approach for extensive characterization of gallnut tannin extracts[J]. Journal of Agricultural and Food Chemistry, 2020, 68(47): 13426-13438. doi: 10.1021/acs.jafc.9b08221 -




 下载:
下载: