-
据不完全统计,全球盐渍化土地约1.0 × 109 hm2,达到了世界土地面积的10%[1-2],全球20%的耕地和水浇地受到盐渍化的影响,而且数量还在持续上升[3]。我国盐渍化情况尤为严重,盐渍土总面积高达3.6 × 107 hm2 ,占可用耕地的4.88%,且有9.2 × 107 hm2 的耕地正面临着盐渍化的威胁[4]。因此,在林业生产领域,选育耐盐碱林木新品种工作迫在眉睫。杨树是世界上最重要的纸浆原料和工业原料之一[5],并广泛应用于生态防护、道路绿化和园林景观等用途。毛白杨(Populus tomentosa Carr.)是我国特有的乡土树种,生长速度快,主干通直粗壮,抗病虫害,适应能力强[6-7]。毛白杨属于轻度耐盐树种,当土壤中NaCl含量超过0.3%时就会影响其正常生长,这也是影响其在我国进一步推广的原因[8]。所以,培育耐盐毛白杨新品种更能充分发挥其生态和生产效益。相较于传统育种手段,基因工程育种可以突破种属限制,具有高效和专一的特点[9]。自1986年杨树首次实现遗传转化和外源基因表达[10]以来,杨树转基因研究发展迅速。我国于1996年培育出第一批具有较高抗盐性的转化杨树植株[11],截至目前,有10例转基因杨树进入田间试验阶段,有2例进入商品化应用阶段[12]。
化感作用是指各种植物所释放的化学物质引起的直接或者间接作用[13]。化感物质主要是在植物体内通过生物途径合成的次生代谢物质,以游离或特定的形式贮存于植物体内各组织器官、周围根际土壤及其凋落物中,能直接或间接的影响自身或周围其它生物的生存及生长发育[14]。杨树作为我国重要的经济林木,对生态系统的影响也是备受瞩目的问题[15-16]。本试验用Sandwich方法选择常用的十字花科、芸薹属植物白菜(Brassica pekinensis (Lour.) Rupr.)的种子作为萌发试验处理对象[17-18]。
随着转基因技术越来越多的应用于林木遗传改良工作,转基因林木的生物安全性也日益受到关注。现阶段转基因安全性评价主要包括4各方面:(1)外源基因是否稳定存在;(2)转基因过程中载体携带的抗性基因转移;(3)外源基因的转移;(4)转基因林木可能通过植物残体或根际代谢影响土壤微生物数量,从而破坏土壤微生物群落多样性[19-22]。
AhDREB1基因是从一种盐生植物山菠菜(Atriplex hortensis L.)中分离出来的DREB转录因子,是植物特有且含有一个高度保守的AP2结构域,可以通过正调控下游胁迫相关基因的表达和提高活性氧清除能力,提高植物盐胁迫下耐盐能力。本实验室杜宁霞于2003年成功将AhDREB1基因转入三倍体毛白杨杂种((Populus tomentosa × P. bolleana) × P. tomentosa)中,获得多个转基因株系,实验室继代保存14年后于2017年开展野外试验。本研究以2017年栽植于天津滨海的转基因毛白杨自根苗株系(T12、T46、T转)和河北沧州的转基因毛白杨嫁接苗株系(T12、T46、T转)为对象,通过PCR技术,检测天津和沧州转基因毛白杨外源基因稳定性和水平转移问题,对天津基地转基因与非转基因毛白杨根际土壤微生物数量进行连续检测,并对两地转基因毛白杨对非目标植物化感作用进行研究,以期能够较为全面的研究转基因毛白杨生态安全性问题。
-
2017年春,将转AhDREB1基因毛白杨自根苗株系T12、T46、T转种植于天津市滨海新区耐盐碱植物科技园区,种植面积2 500 m2,株行距3 m × 1.5 m,土壤盐碱度0.2%。嫁接苗株系T12、T46、T转种植在河北省沧州市盐山县国家抗盐碱树种良种基地,砧木小叶杨(Populus simonii Carr.)种植面积10 000 m2,株行距3 m × 3 m,土壤盐碱度0.4%~0.6%。
-
外源基因在受体植物中长期稳定存在且表达是转基因植物新品种培育的重要依据[23]。本课题组采集了4年生的转基因杨树和非转基因杨树叶片,共4个株系,每个株系随机采集3棵样本植物的幼嫩叶片,放置于干冰盒中带回实验室低温保存。使用天根生物植物基因组DNA提取试剂盒,提取叶片基因DNA,对目的片段进行PCR扩增。
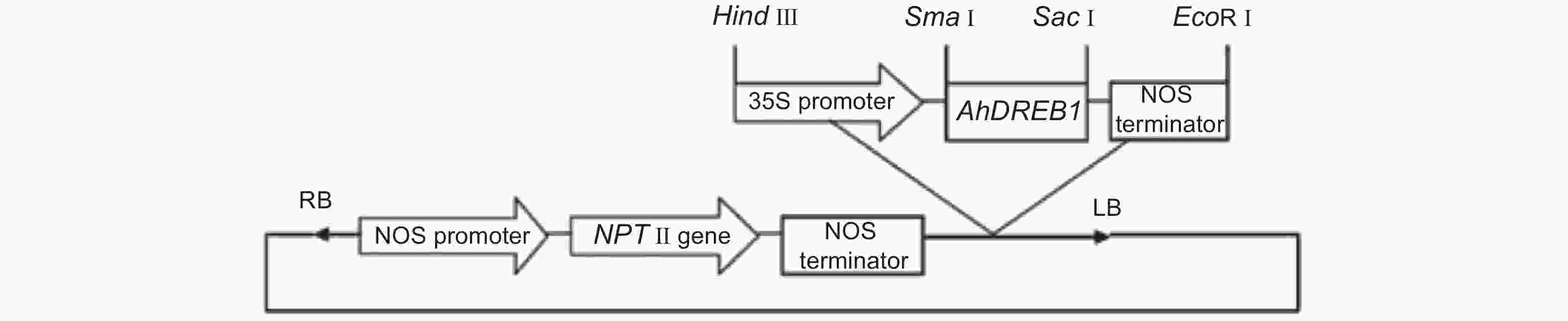
本研究中转基因毛白杨采用植物表达载体PBI121,该载体携带35S启动子控制下的AhDREB1和胭脂碱合酶(NOS)启动子控制下的新霉素磷转移酶基因(NPT Ⅱ)(图1)。在本实验中,利用软件Primer 5.0中根据AhDREB1基因(GenBank accession No.AF274033)序列设计特异性引物:
F: 5′-GAAGAAAGATGTTGCTAATAATAAC-3′; R: 5′-AATAATAATACTTCACTAAAAATGATC-3′。
PCR扩增条件如表1,预期扩增片段长度为666 bp。扩增产物在1%琼脂糖凝胶中进行电泳,电泳结果使用UVP凝胶成像系统进行观察拍照。
表 1 PCR扩增条件
Table 1. PCR conditions
反应体系 各成分量 PCR程序 ddH2O 7.0 μL 94 ℃ 5 min 引物F(10 μmol·L−1) 1.0 μL 94 ℃ 30 s $\left. {array}{l}\;\\\;\\\;\\\;\\\;{array} \right\}$35 cycles 引物R(10 μmol·L−1) 1.0 μL 52 ℃ 40 s 模板(20 ng·μL−1) 1.0 μL 72 ℃ 90 s 2 × Taq PCR Mix 10.0 μL 72 ℃ 10 min Total 20.0 μL 4 ℃ + ∞ -
为了检测转基因毛白杨对土壤微生物的影响,对天津实验地土壤于2021年3、4、5月进行连续动态监测。每个月采集土壤样品,培养土壤微生物并进行计数。细菌采用牛肉膏蛋白胨培养基(3.0 g·L−1牛肉膏 + 10.0 g·L−1蛋白胨 + 5.0 g·L−1 NaCl + 15.0 g·L−1琼脂,pH = 7.4~7.6),真菌用马丁氏培养基(10.0 g·L−1葡萄糖 + 5.0 g·L−1蛋白胨 + 1.0 g·L−1 KH2PO4 + 0.5 g·L−1 MgSO4·7H2O + 20.0 g·L-1琼脂 + 3.0 mL·L−11%孟加拉红水溶液),放线菌使用改良高氏一号培养基(20.0 g·L−1可溶性淀粉 + 1.0 g·L−1 KNO3 + 0.5 g·L−1 K2PO4 + 0.5 g·L−1 MgSO4·7H2O + 0.5 g·L−1 NaCl + 0.01 g·L−1 FeSO4·7H2O + 20.0 g·L−1 琼脂,pH = 7.4~7.6)。
土壤采样具体方法:每个系号随机选取样树3棵,以样树为中心,选取距离主干30 cm距离的等边三角形的3个顶点,采集10~20 cm土层处土壤样品约100 g,该土层处微生物最为丰富[1]。将采集好的土壤样本装入自封袋中密封保存,并置于冰盒中干冰低温保存运输带回实验室,冰箱4 ℃存放。
准确称取新鲜土样10 g,倒入装有90 mL无菌水的培养瓶中,在恒温摇床上200 r·min−1、25 ℃、震荡 10 min,使微生物细胞充分分散,然后静置5 min,得到10−1土壤稀释液,再吸取10 mL悬浮液加入90 mL无菌水得到10−2土壤稀释液,照此方法获得每个样本的10−3土壤稀释液。用移液器吸取100 μL的10−3土壤悬浮液接种于培养基上,每个样本3次重复,放入恒温培养箱中倒置培养。细菌37 ℃培养1 d计数,真菌25 ℃下培养4 d计数,放线菌28 ℃培养3 d计数。
土壤可培养微生物数量计数方法:菌落数量(CFU)=(微生物数量 × 稀释倍数)/土壤干质量。
-
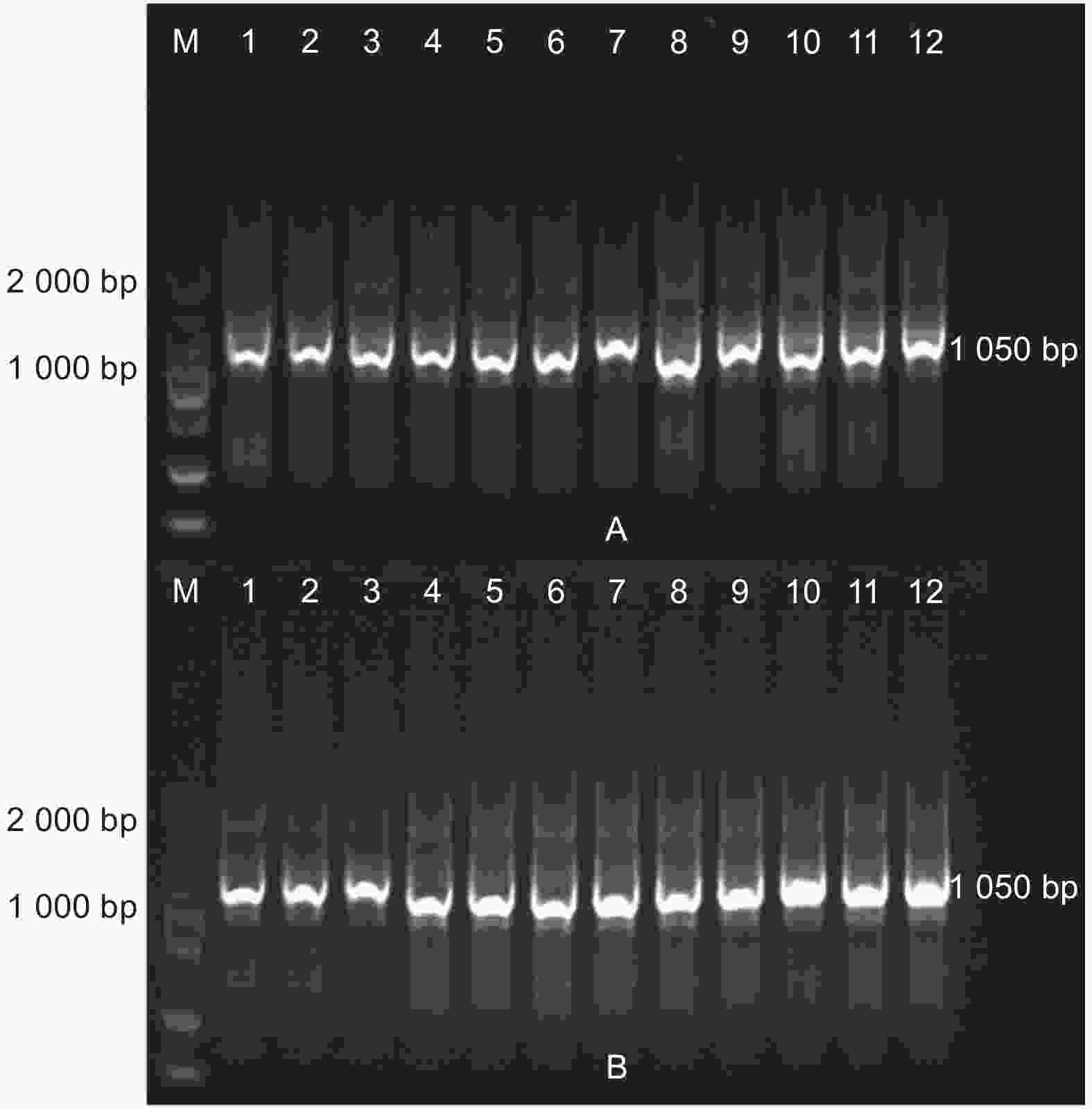
监测土壤总DNA的提取:使用天根生物公司的土壤基因组DNA提取试剂盒,以土壤总DNA为模板,用原核生物16S DNA通用引物(F: 5′-ACG GGC GGT GTG TAC-3′; R: 5′-CCT ACG GGA GGC AGC AG-3′)进行PCR扩增,检测土壤总DNA提取质量,预期扩增片段长度为1 050 bp。以根系土壤总DNA为模板,使用AhDREB1基因特异性引物和NPT Ⅱ基因引物(F:5′- ATG ATT GAA CAA GAT GGA TTG C-3′; R:5′- TCA GAA GAA CTC GTC AAG AAG G-3′)进行PCR扩增,检测外源基因和抗性基因。
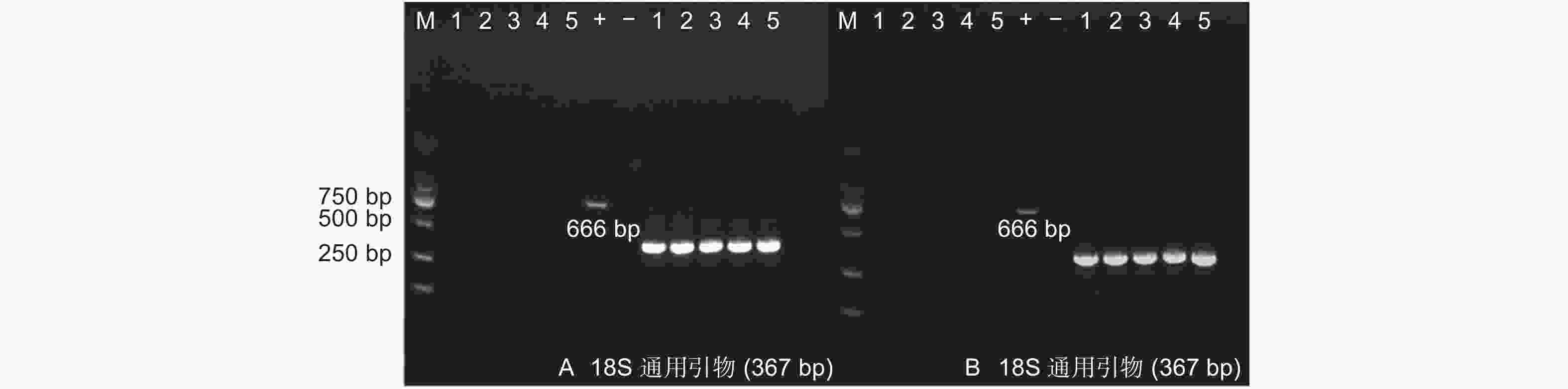
抗性菌株基因组DNA提取:分别用添加有50 mg·L−1卡那霉素的细菌、真菌、放线菌培养基筛选抗性菌株,使用天根生物公司植物基因组DNA提取试剂盒提取真菌基因组DNA,真核生物18S DNA通用引物(F: 5′-GGG GGA GTA TGG TCG CAA GGC-3′; R: 5′-TCA GTG TAG CGC GCG TGC GGC-3′)检测质量,预期扩增片段367 bp。使用天根生物公司细菌基因组DNA提取试剂盒提取细菌和放线菌DNA,原核生物16S DNA通用引物检测质量。分别使用AhDREB1基因特异性引物和NPT Ⅱ基因引物进行PCR扩增,检测外源基因和抗性基因。进行PCR扩增,检测外源基因和抗性基因。
为检测沧州嫁接苗转基因毛白杨外源基因是否转移到砧木当中,采集沧州转基因株系砧木根系样本,提取总DNA,用外源基因特异性引物检测。
-
2020年9月和2021年3月在沧州和天津实验林中开展转基因毛白杨枯落物降解试验,模拟野外中转基因植株自然掉落情况,分别采集每个系号茎(新生嫩芽,多年生枝条)、根(新生根尖、多年生侧根)、叶片(新生嫩叶、当年生老叶)分别装入带孔网兜中,然后用钉子固定于样树下杂草表面、土壤表面和土壤中(深度20 cm),2个月后回收提取DNA检测外源基因。
-
分别采集沧州和天津转基因毛白杨和非转基因毛白杨叶片,在烘箱中60 ℃烘干处理24 h后在粉碎机中打碎成叶粉。配制0.5%的琼脂溶液,加热至琼脂完全溶解后先在6 cm一次性无菌培养皿中加入5 mL琼脂溶液,然后在培养皿中加入100 mg毛白杨叶粉,待下层琼脂冷凝后再向培养皿中加入5 mL琼脂溶液。放置培养皿至琼脂凝固冷却至室温,选取种粒饱满的白菜种子,用尖嘴镊子夹取白菜种子均匀放置于培养基表面,每个培养皿放置5粒种子,每个系号5次重复。空白对照为不加入叶粉,仅加入10 mL0.5%的琼脂的培养皿,其他处理与实验组相同。将所有培养皿放入人工气候箱中遮光培养3 d,人工气候箱的条件设置为温度25 ℃、相对湿度60%、黑暗72 h,3 d后测量萌发白菜种子的胚根和胚轴长度。
-
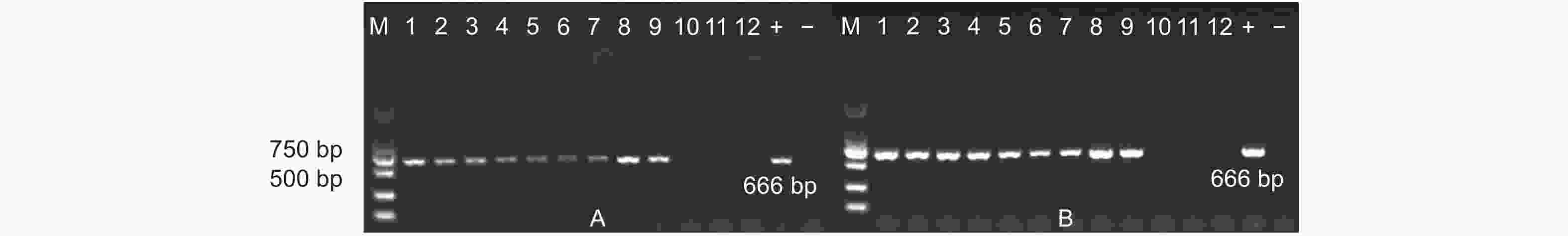
从天津和沧州两地实验田的转基因以及非转基因杨树植株叶片中提取基因组DNA,设计特异性引物,对目的片段进行PCR扩增。结果显示:天津和沧州(图2)两地的转基因杨树植株基因组DNA中均能扩增出与预期片段长度相符的PCR产物。初步证明AhDREB1外源基因依旧稳定存在于转基因植株当中。
-
对天津转基因毛白杨株系T12、T46、T转和非转基因毛白杨的根际土壤微生物(细菌、放线菌、真菌)进行连续3个月的计数监测(表2),不同株系毛白杨的根际微生物种群数量变化趋势一致,不同微生物的数量都呈现增长趋势,猜测可能和季节变化相关。细菌、放线菌、真菌的群落数量随时间变化存在差异,但转基因与非转基因毛白杨之间根际土壤微生物的菌落数量没有显著差异。这一结果表明转基因毛白杨对土壤中可培养的微生物(细菌、放线菌、真菌)数量没有造成显著影响。
表 2 天津实验田根际土壤可培养微生物统计(平均菌落数)
Table 2. Statistics of soil culturable microorganisms in Tianjin trial plots
时间(月)
Time
(Month)细菌/107 T12 T46 T转 CK 3 2.06 ± 0.11 b 2.03 ± 0.13 b 2.20 ± 0.07 b 2.05 ± 0.11 b 4 3.48 ± 0.05 a 3.22 ± 0.14 a 3.36 ± 0.05 a 3.34 ± 0.10 a 5 3.80 ± 0.12 a 3.94 ± 0.17 a 3.68 ± 0.14 a 4.06 ± 0.16 a 时间(月)
Time
(Month)放线菌/107 T12 T46 T转 CK 3 1.98 ± 0.05 b 2.05 ± 0.05 b 2.10 ± 0.06 b 1.97 ± 0.10 b 4 3.25 ± 0.13 a 3.14 ± 0.08 a 3.24 ± 0.09 a 3.25 ± 0.10 a 5 3.49 ± 0.01 a 3.45 ± 0.01 a 3.44 ± 0.14 a 3.48 ± 0.14 a 时间(月)
Time
(Month)真菌/106 T12 T46 T转 CK 3 2.29 ± 0.18 b 2.20 ± 0.17 b 2.25 ± 0.31 b 2.14 ± 0.24 b 4 3.55 ± 0.24 a 3.40 ± 0.12 a 3.48 ± 0.18 a 3.34 ± 0.18 a 5 3.86 ± 0.29 a 3.83 ± 0.24 a 3.99 ± 0.29 a 3.81 ± 0.24 a 注:表中数据为平均值 ± 标准差,数据后字母不同表示差异显著(P<0.05)
Notes: The data in the table are average values ± the standard deviation.Different letters after the data indicate significant differences(P<0.05) -
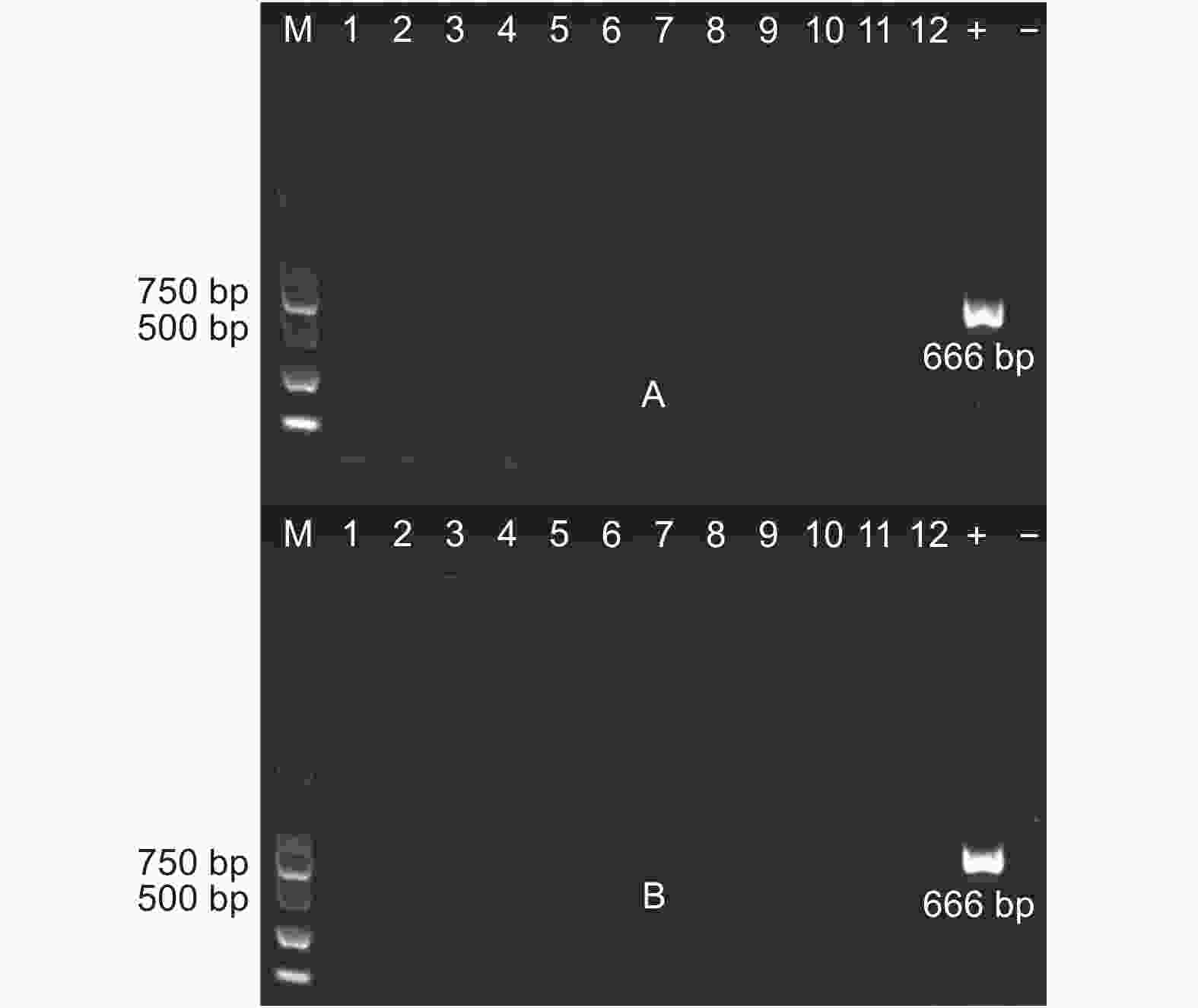
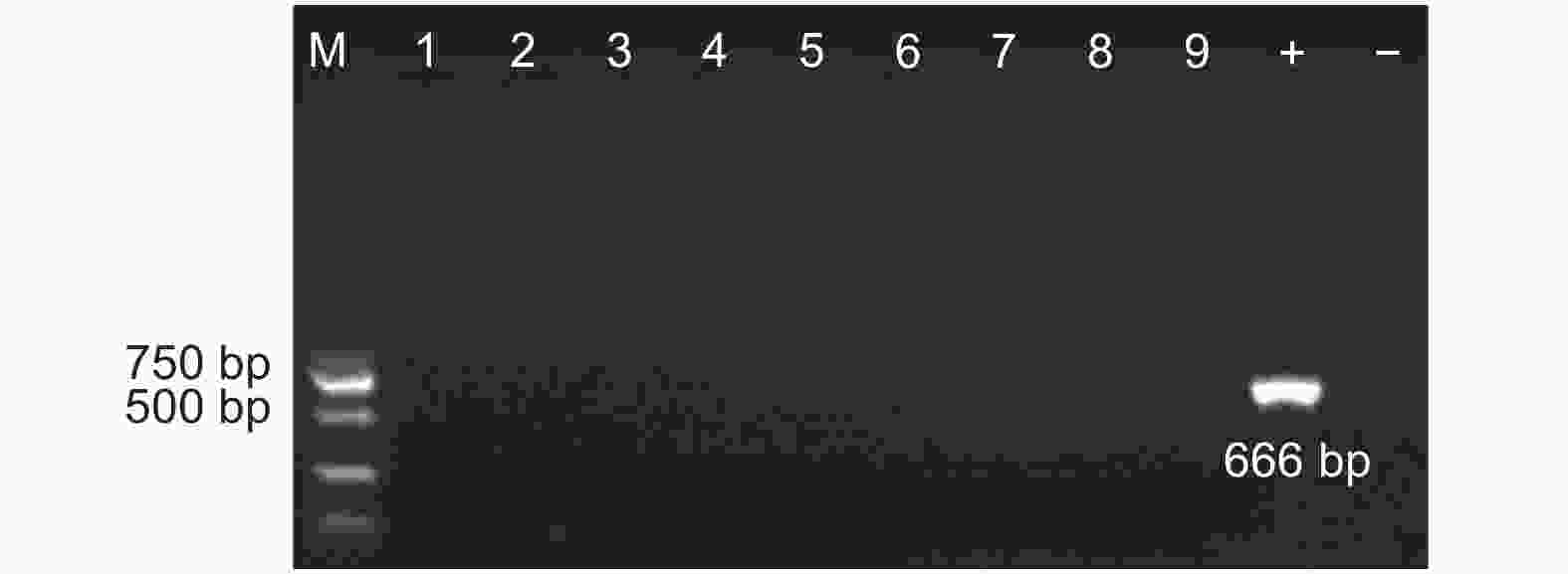
提取两地转基因杨树植株根际土壤DNA(图3),使用原核生物16S rDNA通用引物和外源基因特异性引物以及NPT Ⅱ基因引物进行PCR扩增(图4~6),结果显示:转基因毛白杨植株根际土壤DNA提取质量良好,但并未扩增出与外源基因预期目的片段长度相符的扩增产物,初步断定天津和沧州两地均没有外源基因以及抗性基因的转移。
-
对转基因杨树植株根际土壤中微生物用卡那霉素进行筛选。天津土壤样本共筛选出28株抗性细菌、18株抗性真菌、15株抗性放线菌;沧州土壤样本筛选出23株抗性细菌、16株抗性真菌、11株抗性放线菌。以筛选出抗性菌株(细菌、真菌、放线菌)DNA为模板,PCR检测外源基因。结果(图7~8)显示:转基因毛白杨根际土壤中的抗性微生物DNA中,没有扩增出外源基因片段长度相符的PCR产物,初步判断外源基因没有转移到根际微生物中。
-
采集沧州基地转基因株系砧木根系样本,提取基因组DNA,使用AhDREB1基因特异性引物进行PCR扩增,电泳结果(图9)显示:没有扩增出目的片段,外源基因没有转移到砧木中。
-
2020年11月和2021年5月对转基因毛白杨枯落物中外源基因进行检测,结果(图10)表明:天津自根苗与沧州嫁接苗转基因毛白杨不同发育阶段的不同器官,无论是飘落在杂草上,飘落在土表面,还是埋在土里,在2个月后腐烂的材料里都不能检测到外源基因。
-
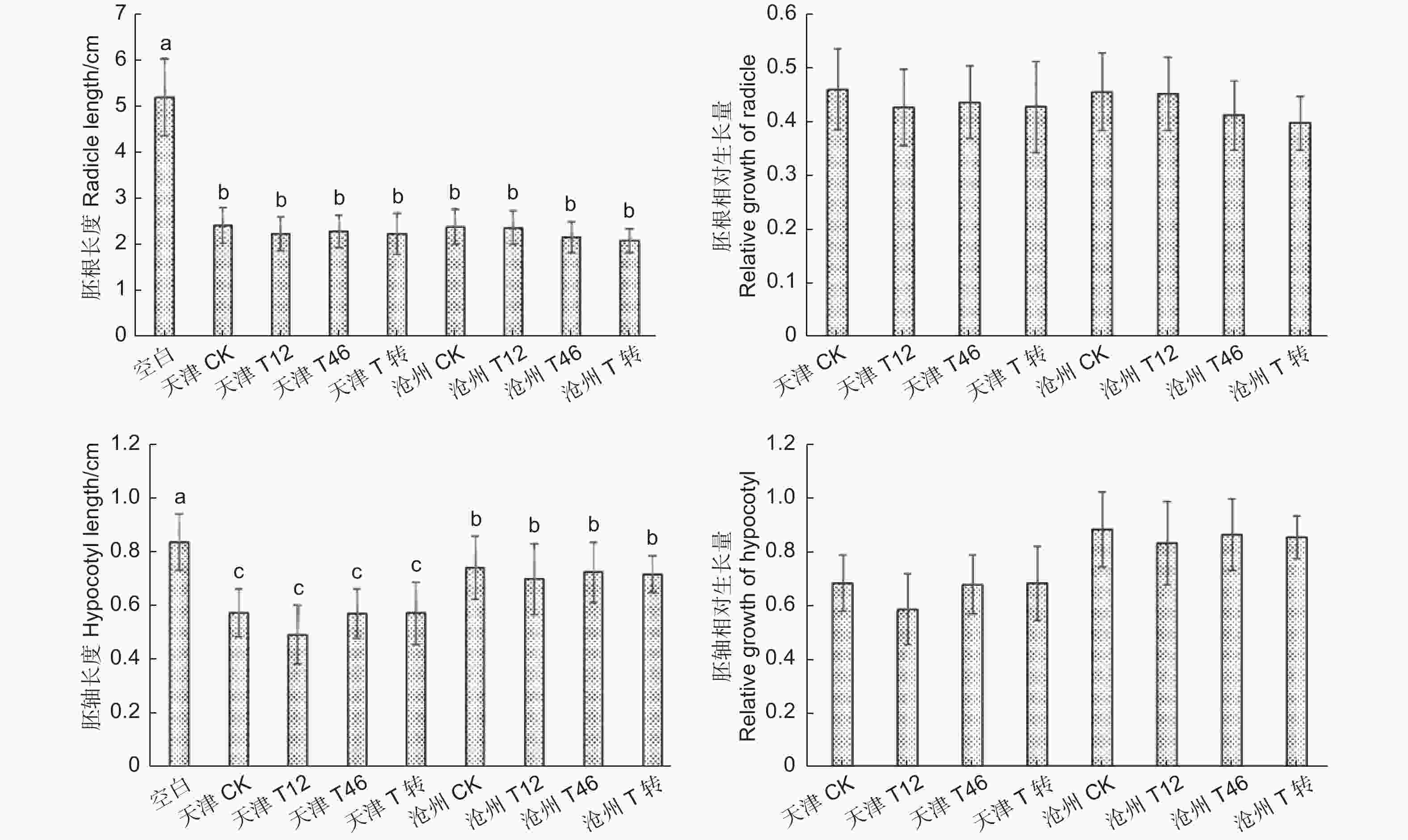
利用imageJ软件测量不同处理白菜种子的胚根和胚轴长度,结果(图11)显示:加入转基因毛白杨叶粉和非转基因毛白杨叶粉的胚根、胚轴长度均无显著差异。通过计算白菜种子胚根、胚轴相对生长量,添加转基因和非转基因毛白杨叶粉处理的胚根、胚轴生长均受到抑制,胚根生长受抑制情况更严重。通过对比发现:天津转基因自根苗和沧州转基因嫁接苗叶粉对胚根生长的影响没有显著差异,但是胚轴长度有一定差异。本实验初步断定转基因毛白杨叶片对白菜种子的抑制与非转基因毛白杨叶片相比差异不明显,转基因毛白杨不会对环境中其他植物生长产生额外的抑制,两地转基因苗叶粉对胚轴生长的差异影响还需进一步探索。
-
转基因植物中外源基因稳定表达和遗传是商品化的首要条件。甲基化、基因沉默、共抑制、外界环境的变化都可能会影响外源基因的稳定性。Lu等通过荧光定量PCR检测发现,外源基因在实验室继代保存9 a的转AhDREB1基因毛白杨组培苗各器官中均稳定表达[24]。本研究通过对转基因毛白杨叶组织基因组 DNA 进行PCR特异性扩增检测,初步证明经过实验室14 a继代与4 a田间环境生长后转AhDREB1基因毛白杨外源基因仍然存在。
土壤是整个生态系统的重要组成部分,土壤微生物是保持土壤生态系统健康和稳定的基础。转基因植物可能对土壤微生物产生影响[25]。马晓星等研究1年生转基因PeTLP 基因‘南林 895’杨株系,朱文旭等研究 8 年生转基因库安托杨(P. × euramericana ‘Guariento’),吕秀华等研究转基因银中杨(P. alba‘Berolinensis’)结果均显示转基因植物对其根际土壤微生物主要类群的数量影响不显著[26-28] 。本实验对天津不同系号转基因以及非转基因毛白杨根际微生物数量进行连续3个月的动态监测,研究结果显示转基因毛白杨没有对实验地土壤微生物群落结构造成显著影响。
外源基因的转移主要包括通过花粉向非转基因或野生近缘植物传播的垂直转移[29-31]和遗传物质通过枯落物或分泌物等向土壤环境转移的水平转移[32]。北京林业大学吕威等对种植13年生的转AhDREB1基因三倍体毛白杨T46进行花粉活力检测以及杂交实验,结果表明花粉可育性极低,因此,通过花粉传播水平转移外源基因的可能性也很低[33]。转基因植物凋落的器官、花粉以及分泌物进入土壤环境存在一定的降解周期,在这个阶段中,外源基因以及抗性标记基因存在转移的可能性。土壤中的微生物也有可能通过转导、转化、结合等方式,摄入外源基因甚至抗性基因。外国学者曾发现,转基因黑芥菜(Brassica nigra (L.) Czern. et Coss. )、油菜(Brassica napus L.)中抗性基因转移到了黑曲霉(Aspergillus niger v.Tiegh.)中[34]。本研究利用外源基因与抗性基因特异性引物,采用PCR方法检测土壤以及抗性微生物DNA,结果显示转基因毛白杨没有发生水平转移。通过对两地转基因毛白杨不同生长阶段的不同器官的田间降解试验,结果表明转基因毛白杨枯落物中的外源基因在自然条件下2个月后无法被检测到。
嫁接是常见的林木培育方式,接穗和砧木之间存在重要的物质运输与交流。陈发毅发现,部分mRNA可以在嫁接柑橘(Citrus reticulata Blanco)的砧木和接穗间移动,陈盼飞等利用酶联免疫法证实Bt毒蛋白可以在同砧嫁接8年生转基因741杨(Populus alba × (P. davidiana + P. simonii) × P. tomen-tosa)的接穗和砧木间运输,陈兴浩等研究发现,在异砧嫁接的转基因欧美杨107杨(Populus × euramericana cv. 'Neva')中,外源基因的mRNANA不能在砧木和接穗间运输,但是Bt毒蛋白可以运输[35-37]。所以,也存在外源基因通过转基因接穗进入砧木中的可能。本实验对沧州嫁接苗砧木的检测,没有检测到外源基因。
转基因毛白杨的生理生化特征是否会因为外源基因插入而改变,使其与非转基因树种相比,化感作用对环境中其他植物生长产生更强的影响。孙伟博等通过“三明治”方法研究了三类转基因‘南林895杨’(Populus deltoides × P. euramericana cv. ‘Nanlin 895’)对莴苣(Lactuca sativa Linn.)种子的影响,研究发现,莴苣种子胚根和胚轴生长并未受到影响[38]。本实验通过对比不同系号的转基因毛白杨与非转基因毛白杨影响下白菜种子胚轴和胚根的生长长度与相对生长量,结果显示转基因毛白杨没有对环境造成额外的影响。
-
本研究通过对种植在天津滨海和河北沧州的4年生转AhDREB1基因毛白杨3个株系和非转基因毛白杨株系进行研究,获得对外源基因稳定性检测、外源基因水平转移、根际可培养微生物数量监测以及叶片化感作用等初步结果,表明无论是自根苗还是嫁接苗,转AhDREB1基因毛白杨都没有对环境造成明显影响。
实验田4年生转基因毛白杨嫁接苗和自根苗安全性研究
Study on Safety of Grafted and Self-rooted Seedlings of 4-year-old Transgenic Populus tomentosa in Trial Plots
-
摘要:
目的 对种植于天津滨海的自根苗转AhDREB1基因毛白杨((Populus tomentosa × P. bolleana) × P. tomentosa)以及种植于沧州盐山的嫁接苗转基因株系进行安全性研究,评估转基因毛白杨对环境可能造成的影响。 方法 利用PCR扩增以及电泳技术,对种植在天津滨海和沧州盐山实验田的4年生转基因毛白杨基因组DNA、土壤DNA、沧州嫁接苗砧木DNA以及抗性微生物基因组DNA进行PCR特异性检测。对天津实验田土壤中根际微生物数量进行连续动态监测(3月、4月、5月)。分别在天津滨海和沧州盐山实验田模拟自然条件下转基因毛白杨植株枯落物掉落,检测不同生长阶段的不同器官(新生嫩芽、多年生枝条、新生根尖、多年生侧根、新生嫩叶、当年生老叶)的降解时间。通过化感实验,检测天津滨海和沧州盐山实验田转基因毛白杨植株叶片对白菜(Brassica pekinensis)种子的生长是否造成影响。 结果 电泳结果显示:外源基因稳定存在于转基因毛白杨基因组中,实验田土壤DNA、抗性微生物DNA样品以及沧州嫁接苗砧木DNA中均未出现目的基因片段;天津非转基因植株和转基因植株的根际土壤中可培养微生物数量没有显著差异;转基因毛白杨的枯落物,无论是飘落在杂草表面、土壤表面还是埋入土壤,2个月后外源基因均被降解。化感实验结果显示:非转基因植株以及转基因植株对白菜种子的胚轴和胚根生长的影响没有显著差异。 结论 未发现实验田种植4 a的转基因毛白杨对周围的环境造成影响。 Abstract:Objective To study the safety of transgenic Populus tomentosa with AhDREB1 gene from self-rooted seedlings planted in Binhai of Tianjin and transgenic seedlings planted in Yanshan of Hebei in order to evaluate the possible impact of transgenic Populus tomentosa on the environment. Method PCR amplification and electrophoresis were used to detect the genomic DNA of the 4-year-old transgenic P. tomentosa, soil DNA, root DNA of grafted seedlings from Yanshan and the genomic DNA of resistant microorganisms in Binhai. The amount of rhizosphere microorganisms in the soil of Binhai trial plot was monitored continuously (March, April and May). The degradation time of different organs (new shoots, perennial branches, new root tips, perennial lateral roots, new young leaves and old leaves) at different growth stages of transgenic P. tomentosa plants were measured in Binhai and Yanshan trial plots under simulated natural conditions. The allelopathic test was conducted to determine whether the transgenic leaves of P. tomentosa had any effect on the growth of Brassica pekinensis seeds. Result The electrophoretic results showed that exogenous genes stably existed in the genome of transgenic P. tomentosa, and no target gene fragment was found in soil DNA, root stock DNA of Yanshan grafted seedlings and DNA samples of resistant microorganisms. There was no significant difference in the amount of culturable microorganisms in the rhizosphere soil between non-transgenic plants and transgenic plants in Binhai. Exogenous genes were degraded in the litter of transgenic P. tomentosa after 2 months, whether it fell on the weed surface, soil surface or buried in soil. The allelopathic results showed that there was no significant difference between the non-transgenic plants and the transgenic plants on the growth of the hypocotyl and radicle of Brassica pekinensis seed. Conclusion No effect of transgenic P. tomentosa on the surrounding environment is found after 4 years of planting in the trial plot . -
表 1 PCR扩增条件
Table 1. PCR conditions
反应体系 各成分量 PCR程序 ddH2O 7.0 μL 94 ℃ 5 min 引物F(10 μmol·L−1) 1.0 μL 94 ℃ 30 s $\left. {array}{l}\;\\\;\\\;\\\;\\\;{array} \right\}$35 cycles 引物R(10 μmol·L−1) 1.0 μL 52 ℃ 40 s 模板(20 ng·μL−1) 1.0 μL 72 ℃ 90 s 2 × Taq PCR Mix 10.0 μL 72 ℃ 10 min Total 20.0 μL 4 ℃ + ∞ 表 2 天津实验田根际土壤可培养微生物统计(平均菌落数)
Table 2. Statistics of soil culturable microorganisms in Tianjin trial plots
时间(月)
Time
(Month)细菌/107 T12 T46 T转 CK 3 2.06 ± 0.11 b 2.03 ± 0.13 b 2.20 ± 0.07 b 2.05 ± 0.11 b 4 3.48 ± 0.05 a 3.22 ± 0.14 a 3.36 ± 0.05 a 3.34 ± 0.10 a 5 3.80 ± 0.12 a 3.94 ± 0.17 a 3.68 ± 0.14 a 4.06 ± 0.16 a 时间(月)
Time
(Month)放线菌/107 T12 T46 T转 CK 3 1.98 ± 0.05 b 2.05 ± 0.05 b 2.10 ± 0.06 b 1.97 ± 0.10 b 4 3.25 ± 0.13 a 3.14 ± 0.08 a 3.24 ± 0.09 a 3.25 ± 0.10 a 5 3.49 ± 0.01 a 3.45 ± 0.01 a 3.44 ± 0.14 a 3.48 ± 0.14 a 时间(月)
Time
(Month)真菌/106 T12 T46 T转 CK 3 2.29 ± 0.18 b 2.20 ± 0.17 b 2.25 ± 0.31 b 2.14 ± 0.24 b 4 3.55 ± 0.24 a 3.40 ± 0.12 a 3.48 ± 0.18 a 3.34 ± 0.18 a 5 3.86 ± 0.29 a 3.83 ± 0.24 a 3.99 ± 0.29 a 3.81 ± 0.24 a 注:表中数据为平均值 ± 标准差,数据后字母不同表示差异显著(P<0.05)
Notes: The data in the table are average values ± the standard deviation.Different letters after the data indicate significant differences(P<0.05) -
[1] Zhang M, Qin Z, Liu X. Remote Sensed Spectral Imagery to Detect Late Blight in Field Tomatoes[J]. Precision Agriculture, 2005, 6(6): 489-508. doi: 10.1007/s11119-005-5640-x [2] 任 宁, 夏幽泉, 谢 青, 等. 蛋白磷酸酶ABI2调节SOS1蛋白的耐盐性[J]. 分子植物育种, 2019, 17(23):7750-7756. [3] 朱云峰, 刘银弟, 谢 青, 等. AtCIPK8超表达增强拟南芥耐盐性[J/OL]. 分子植物育种: 1-16[2021-12-02]. http://kns.cnki.net/kcms/detail/46.1068.S.20210526.1323.002.html. [4] 齐 琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J]. 分子植物育种, 2020, 18(8):2741-2746. [5] Boerjan W. Biotechnology and the domestication of forest trees[J]. Current Opinion in Biotechnology, 2005, 16(2): 159-166. doi: 10.1016/j.copbio.2005.03.003 [6] 朱之悌, 张志毅. 毛白杨遗传改良研究进展(英文)[J]. 中国林学(英文版), 1997(1):3-8. [7] 朱之悌, 林惠斌, 康向阳. 毛白杨异源三倍体B301等无性系选育的研究[J]. 林业科学, 1995, 31(6):499-505 + 579. [8] 罗子敬, 卢 楠, 刘 欣, 等. 种植与组培9年的转AhDREB1基因毛白杨耐盐性比较[J]. 核农学报, 2017, 31(8):1475-1485. doi: 10.11869/j.issn.100-8551.2017.08.1475 [9] 丁莉萍, 王宏芝, 魏建华. 杨树转基因研究进展及展望[J]. 林业科学研究, 2016, 29(1):124-132. doi: 10.3969/j.issn.1001-1498.2016.01.018 [10] Parsons T J, Sinkar V P, Stettler R F, et al. Transformation of Poplar by Agrobacterium tumefaciens[J]. Nature Biotechnology, 1986, 4(6): 533-536. doi: 10.1038/nbt0686-533 [11] 尹建道, 孙仲序, 王玉祥, 等. 转抗盐碱基因八里庄杨大田释放试验[J]. 东北林业大学学报, 2004, 32(3):23-25. doi: 10.3969/j.issn.1000-5382.2004.03.007 [12] 吕 威. 转AhDREB1基因毛白杨田间苗性状对比分析和安全性评价[D]. 北京: 北京林业大学, 2019. [13] 国家药典委员会. 中华人民共和国药典: 2005年版. 二部[M]. 北京: 化学工业出版社, 2005. [14] 穆向荣, 马逾英, 杨枝中, 等. 药用植物根腐病防治的研究进展[J]. 中药与临床, 2014, 5(2):5-8. [15] 万开元, 陈 防, 陶 勇, 等. 杨树对莴苣的化感作用[J]. 东北林业大学学报, 2009, 37(1):21-22. doi: 10.3969/j.issn.1000-5382.2009.01.008 [16] 高汝勇. 杨树落叶对白菜化感作用的研究[J]. 现代农村科技, 2019(11):57-58. [17] Fujii Y, Parvez S S, Parvez M M, et al. Screening of 239 medicinal plant species for allelopathic activity using the sandwich method[J]. Weed Biology and Management, 2010, 3(4): 233-241. [18] Fujii Y, Shibuya T, Nakatani K, et al. Assessment method for allelopathic effect from leaf litter leachates[J]. Weed Biology and Management, 2010, 4(1): 19-23. [19] Lu G H, Hua X M, Cheng J, et al. Impact of Glyphosate on the Rhizosphere Microbial Communities of An EPSPS-Transgenic Soybean Line ZUTS31 by Metagenome Sequencing[J]. Current Genomics, 2018, 19(1): 36-49. [20] Wang X J, Zhang X, Yang J T, et al. Effect on transcriptome and metabolome of stacked transgenic maize containing insecticidal cry and glyphosate tolerance epsps genes[J]. The Plant Journal, 2018, 93(6). [21] 贾士荣, 袁潜华, 王 丰, 等. 转基因水稻基因飘流研究十年回顾[J]. 中国农业科学, 2014, 47(1):1-10. doi: 10.3864/j.issn.0578-1752.2014.01.001 [22] Wei M, Tan F, Hong Z, et al. Impact of Bt-transgenic rice (SHK601) on soil ecosystems in the rhizosphere during crop development[J]. Plant Soil & Environment, 2012, 58(5): 217-223. [23] 张晓磊, 章秋艳, 熊 炜, 等. 转基因植物检测方法及标准化概述[J]. 中国农业大学学报, 2020, 25(9):1-12. [24] Nan Lu, Bing Wei, Yuhan Sun, et al. Field Supervisory Test of DREB-Transgenic Populus: Salt Tolerance, Long-Term Gene Stability and Horizontal Gene Transfer[J]. Forests, 2014, 5(5): 1106-1121. doi: 10.3390/f5051106 [25] 李海峰, 刘 岩, 康 颖, 等. 转基因小黑杨对土壤微生物群落结构的影响[J]. 南京林业大学学报:自然科学版, 2014, 38(2):75-80. [26] 马晓星, 孙伟博, 魏 辉, 等. 转PeTLP基因'南林895'杨对土壤微生物的影响及外源基因分子检测[J]. 浙江林业科技, 2018, 38(4):31-40. [27] 朱文旭, 丁昌俊, 张伟溪, 等. 8年生转基因库安托杨外源基因转移及对土壤微生物数量影响的检测[J]. 林业科学研究, 2017, 30(2):349-353. [28] 吕秀华. 转基因银中杨对根际土壤微生物的影响[J]. 基因组学与应用生物学, 2018, 37(5):1965-1970. [29] Devos Y, Aguilera J, Diveki Z, et al. EFSA's scientific activities and achievements on the risk assessment of genetically modified organisms (GMOs) during its first decade of existence: looking back and ahead.[J]. Transgenic Research, 2014, 23(1): 1-25. doi: 10.1007/s11248-013-9741-4 [30] 梁艳丽. 林木转基因技术的生态风险及伦理责任规制研究[D]. 南京: 南京林业大学, 2018. [31] 姜金仲, 李 云, 薛诺稳, 等. 林木遗传转化及其潜在生态风险研究进展[J]. 西北林学院学报, 2012, 27(1):103-108,123. doi: 10.3969/j.issn.1001-7461.2012.01.21 [32] Goodyear K L. Comment on: An assessment of the risks associated with the use of antibiotic resistance genes in genetically modified plants: report of the Working Party of the British Society for Antimicrobial Chemotherapy[J]. Journal of Antimicrobial Chemotherapy, 2004, 53(3): 418-31. doi: 10.1093/jac/dkh087 [33] 吕 威, 孙宇涵, 张华新, 等. 转基因三倍体毛白杨花粉活力及枯落物外源基因检测[J]. 北京林业大学学报, 2019, 41(7):91-100. [34] Hoffmann T, Golz C, Schieder O. Foreign DNA sequences are received by a wild-type strain of Aspergillus niger after co-culture with transgenic higher plants[J]. Current Genetics, 1994, 27(1): 70-76. doi: 10.1007/BF00326581 [35] 陈发毅. 利用转录组分析研究柑橘砧穗间mRNA的移动[D]. 武汉: 华中农业大学, 2017. [36] 陈盼飞, 任亚超, 张 军, 等. 8年生嫁接转基因杨树Bt毒蛋白的表达与运输[J]. 林业科学, 2016, 52(7):46-52. [37] 陈兴浩, 张 军, 李 政, 等. 异砧嫁接转基因杨树中外源Bt-Cry1Ac蛋白的运输及抗虫性检测[J]. 农业生物技术学报, 2019, 27(5):836-843. [38] 孙伟博, 魏朝琼, 马晓星, 等. 3类转基因南林895杨田间试验的安全性评估[J]. 林业科学, 2020, 56(10):53-62. doi: 10.11707/j.1001-7488.20201006 -




 下载:
下载: