-
土壤重金属污染是我国当前最突出的环境污染问题,2014年原环境保护部和原国土资源部联合发表的《全国土壤污染状况调查公报》显示,镉的点位超标率为7%[1]。镉(Cd)是毒性最强的重金属之一,具有分解周期长、毒性大、难降解的特点,容易在植物中富集[2],可通过食物链进入人体,进而危害人类健康[3]。针对土壤重金属污染,植物修复技术具有成本低、对环境友好等优势,修复土壤的同时净化空气与水体,改善环境,成为了当下研究热点[4]。目前,对于重金属富集植物研究多限于草本植物,如鱼腥草(Houttuynia cordata Thunb.)[5]等,而草本植物因根系浅、生物量小对重金属富集有一定的局限性。木本植物因其生物量大、生长周期长、根系发达等特征[6],日趋成为土壤重金属污染修复的新方向。研究发现,在镉胁迫中植物光合作用非常敏感,是鉴定植物对镉耐受性的一种良好途径[7]。在镉胁迫下,桑树(Morus alba L.)幼苗净光合速率下降,抑制了光合作用过程中产物的输送,最终导致桑树幼苗植株矮小[8]。
刺槐(Robinia pseudoacacia L.)属于豆科落叶乔木,因其耐旱、耐贫瘠、耐铅镉污染[9-10],同时具备生物量大、生长速度快、观赏价值高等特点,是一种理想的环境污染修复树种。本研究以刺槐为对象,研究不同浓度镉处理对刺槐的幼苗生长、叶绿素含量、叶绿素荧光特性、呼吸速率及气孔变化特性的影响,了解刺槐对镉胁迫的耐受能力,并通过随机森林回归分析镉胁迫对刺槐叶片光合生理的损伤途径及刺槐幼苗对镉胁迫的适应机制,为进一步探索刺槐抗镉机理提供依据,同时也为强化刺槐在镉污染土壤修复中应用奠定基础。
-
取腐叶土、蛭石、珍珠岩、普通园土按照1:1:1:3配制栽培土,其土壤理化性质为:pH值 6.3,总有机碳15.30 g·kg−1,全氮1.10 g·kg−1,速效磷为15.38 mg·kg−1。河南省土壤镉含量背景值为0.06 mg·kg−1[11],本试验从刺槐种子萌芽阶段进行胁迫,植株个体较小,故设置0、5、10、20 mg·kg−1等镉浓度处理,每个处理设置3次重复,每次重复4钵。随后在土壤中加入CdCl2,充分混合混匀。将混匀的供试土壤装入栽培钵(口径13 cm,高度12 cm),每钵0.7 kg土壤。选取饱满刺槐种子,浸泡24 h,待1/3种子露白后,播种于栽培钵,覆土0.5~1 cm,每钵5粒种子。其中,0、5、10、20 mg·kg−1等处理的发芽率分别为85.00%、76.67%、68.33%、85.00%。出苗后,每2周用1/4浓度的Hoagland营养液浇灌1次;将幼苗放置于温室,室温设置为白天28 ℃,晚间25 ℃。等幼苗发育5个月时取样,测定相关指标。
-
从各处理中选取3盆中的3棵具有代表性的幼苗,用直尺测量幼苗株高,利用游标卡尺测量茎粗,重复5次。用水冲洗植株并吸干水分,将幼苗放至烘箱内,105 ℃杀青5 min,80 ℃恒温处理10 h,烘至质量不变后称其干质量,重复3次。
-
称取0.1 g干样,放入聚四氟乙烯烧杯中,为了更好地消解植物依次加入10:5:3比例的硝酸-氢氟酸-高氯酸,并搅拌混合均匀;然后置于180 ℃的电热板上进行消解3 h,消解成黄豆粒大小时加入0.2%稀硝酸定容至刻度。采用Optima 2100 DV离子发光谱仪测定,3次重复。
-
采用丙酮-无水乙醇提取法测定叶绿素、类胡萝卜素含量。称取新鲜叶片0.3 g左右,剪碎;将组织加入离心管的丙酮与乙醇混合溶液(V:V=2:1)中;用报纸包裹离心管,置于黑暗条件下14 h,直至组织变白。取上清液在可见分光光度计440、644、662 nm处比色,每组重复3次。
计算公式如下:
叶绿素a含量Ca=9.78╳A662−0.99╳A644
叶绿素b含量Cb=21.43╳A644−4.65╳A662
总叶绿素含量Ca+b=5.13╳A662 + 20.44╳A644
类胡萝卜素=4.7╳A440−0.27╳Ca+b
-
采用便携式Yaxin-1161G叶绿素荧光仪测定叶绿素荧光指标。选取样本植株中上部的全展叶,用叶片夹夹住叶片,暗处理20 min;随后4 000 μmol·m−2·s−1光强饱和脉冲处理1 s,1 500 μmol·m−2·s−1光化光处理9 s,测得F0、Fv/Fm、Fm、qN、ΦPSII,每组重复3次。
-
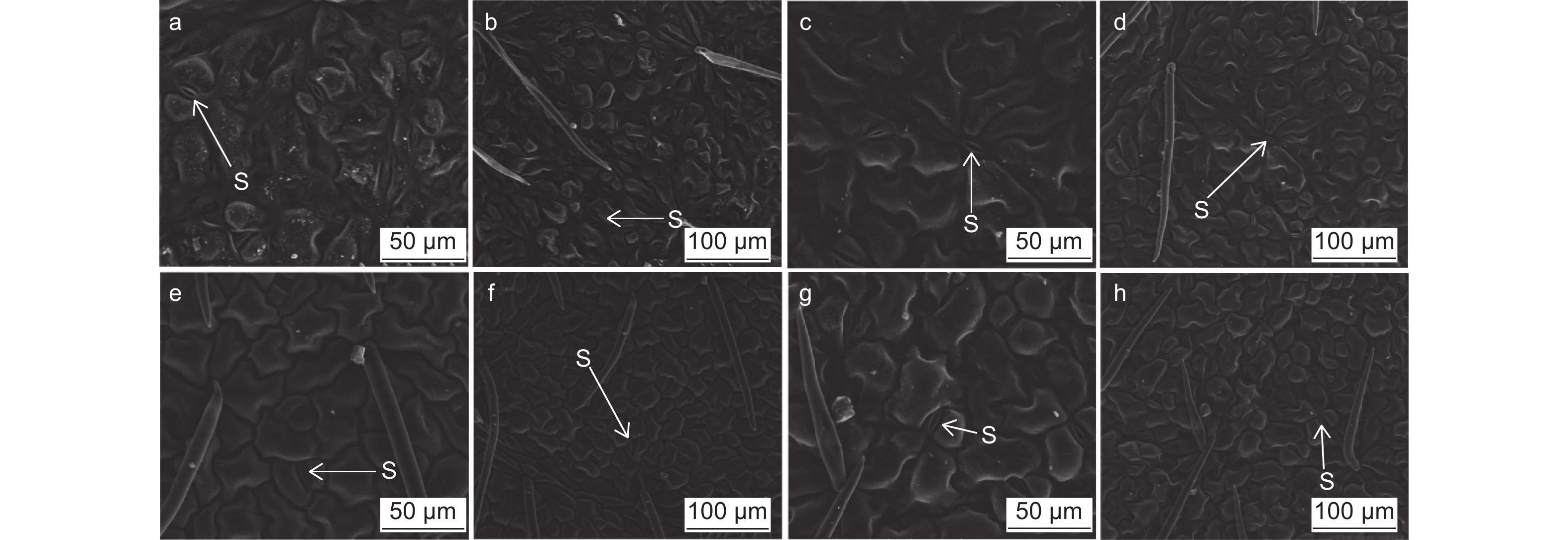
现场剪取样本中上部叶片,用打孔器取下样品叶片,将叶片黏在含导电胶的样品台上,粘贴叶片时注意仅用镊子小心按压叶片四周,不要全叶按压,以免破坏叶片的结构。在QUANTA 250扫描电子显微镜下观察叶面气孔的形态,每组重复3次。用ImageJ1.8.0定量软件测定叶片气孔长、宽度及面积,每张图片重复测量3次。
-
采用Yaxin-1151雅欣生物氧仪测定叶片呼吸速率。从不同处理样株上部取1 cm2叶片样品,置入恒温反应室,反应体系为8 mL去离子水与2 mL 5%Na2SO3;将搅拌子放入反应室,以1200 r·min−1转速搅拌3 min,随后插入电极。遮蔽反应室,暗处理2 min,即可进行呼吸速率测定,每组重复3次。
-
采用Origin2018软件制图;用SPSS 23.0软件进行单因素方差分析(P<0.05);用Metabo Analyst5.0软件包进行主成分分析、相关性分析及森林回归分析。
-
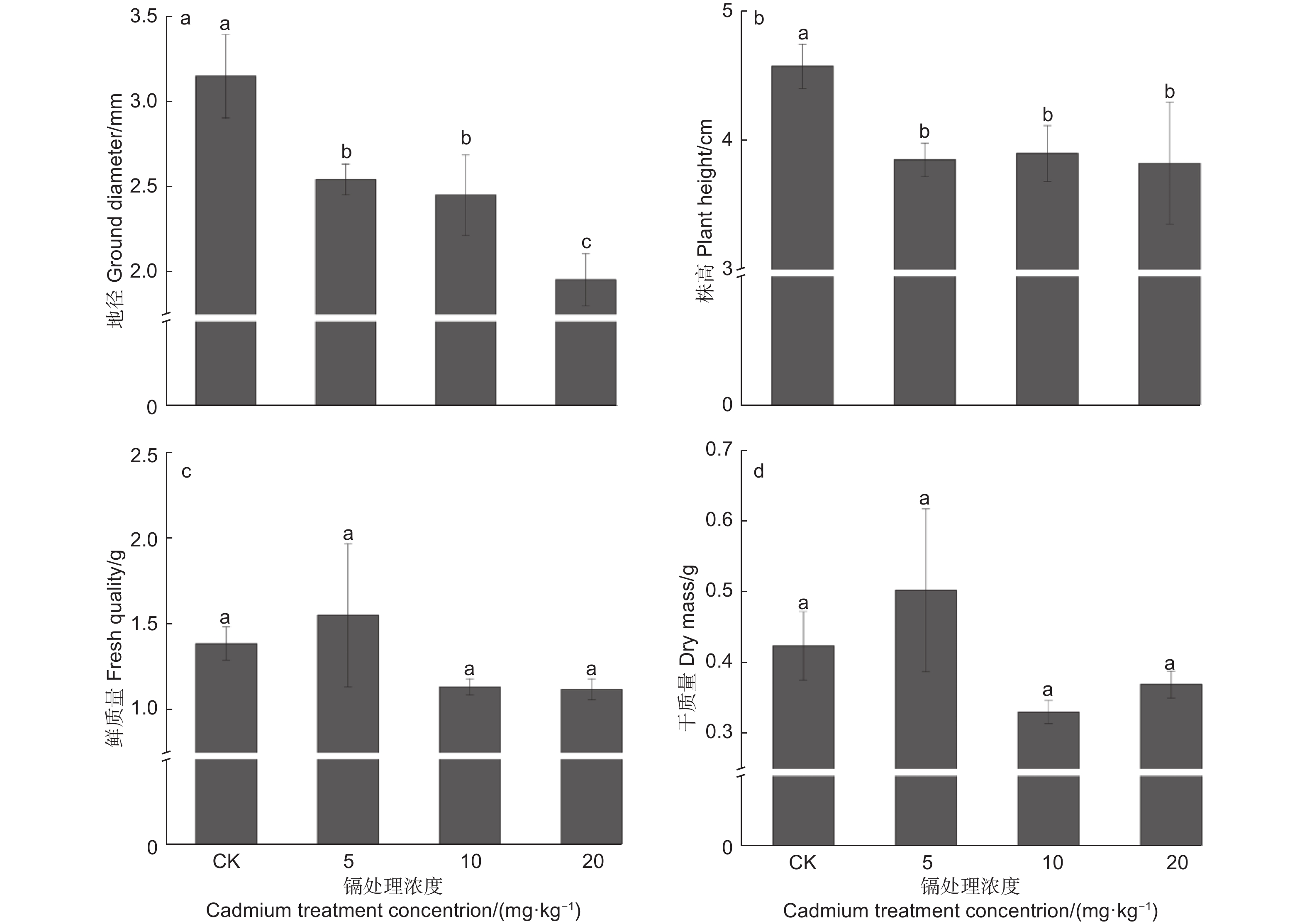
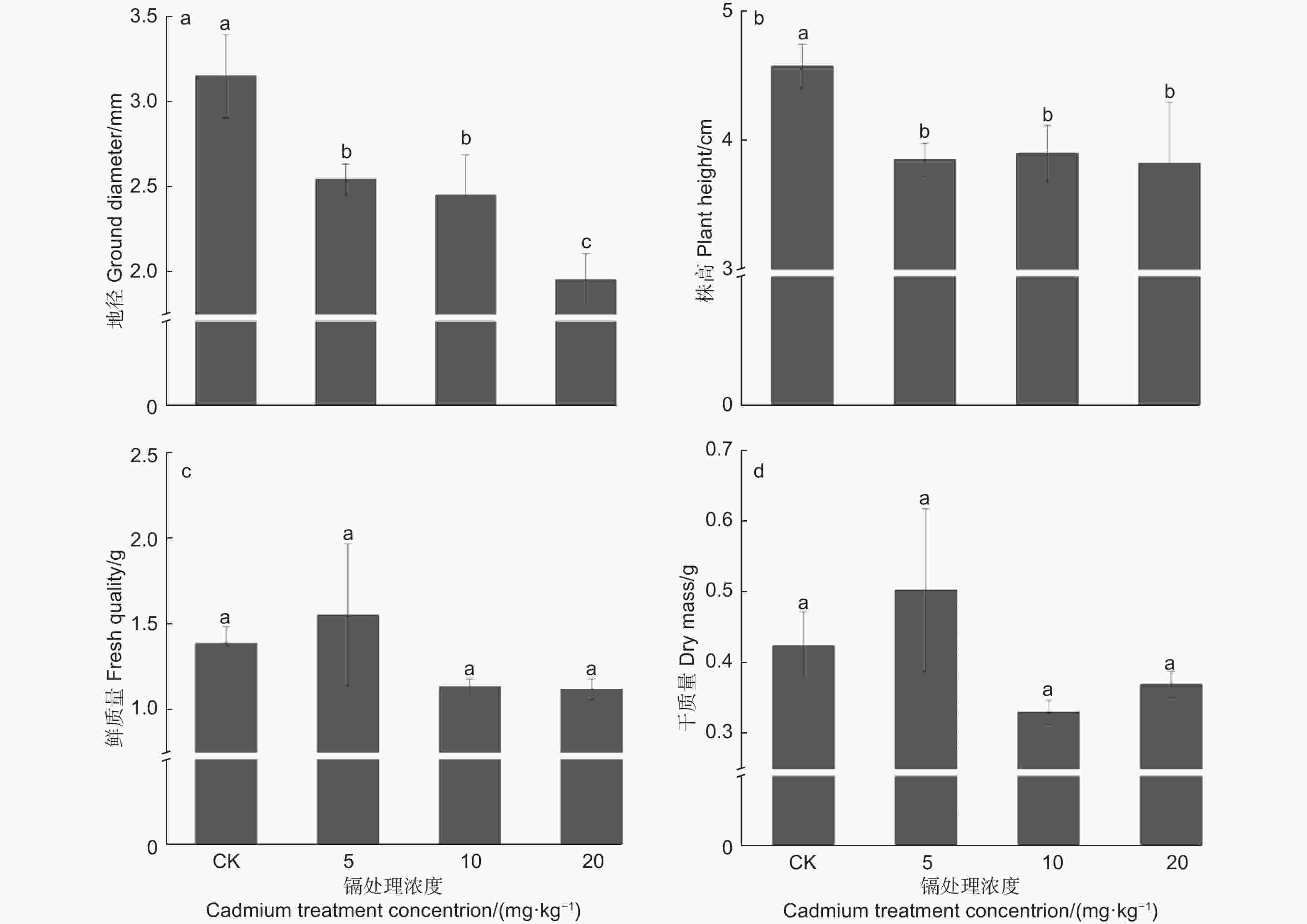
本试验中,镉胁迫植株的地径与株高表现相似,随着镉浓度增加而逐步降低,并显著低于对照(P<0.05),在20 mg·kg−1处理中,其地径与株高最低,分别低于对照37.89%和16.39%9(图1a、b)。此外,刺槐鲜质量与干质量表现相似(见图1c、d),中高浓度处理植株的生物量低于对照植株,而5 mg·kg−1 镉处理植株的生物量最高,其鲜质量与干质量分别高于对照11.94%、18.57%,但差异均不显著(P>0.05)。
-
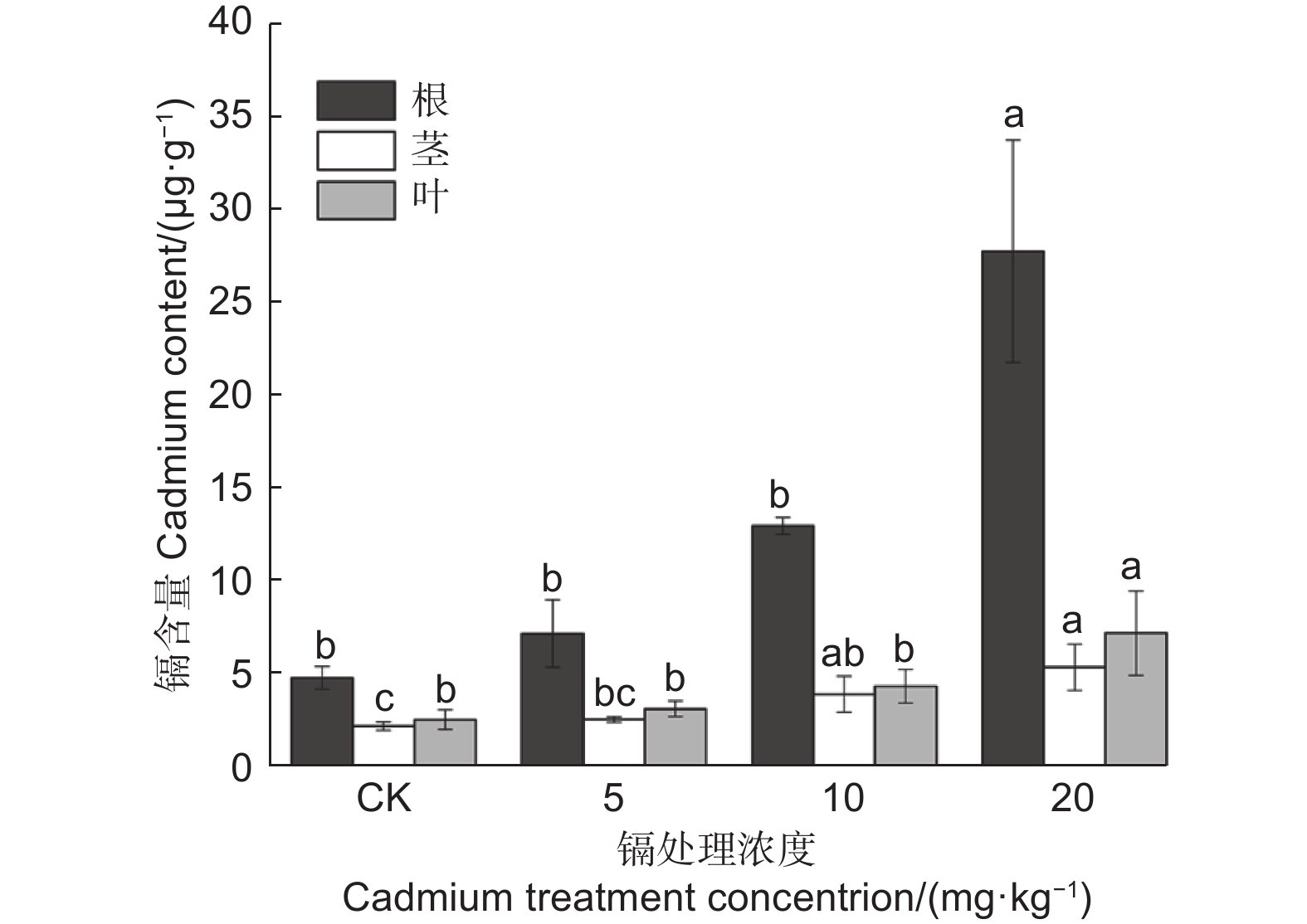
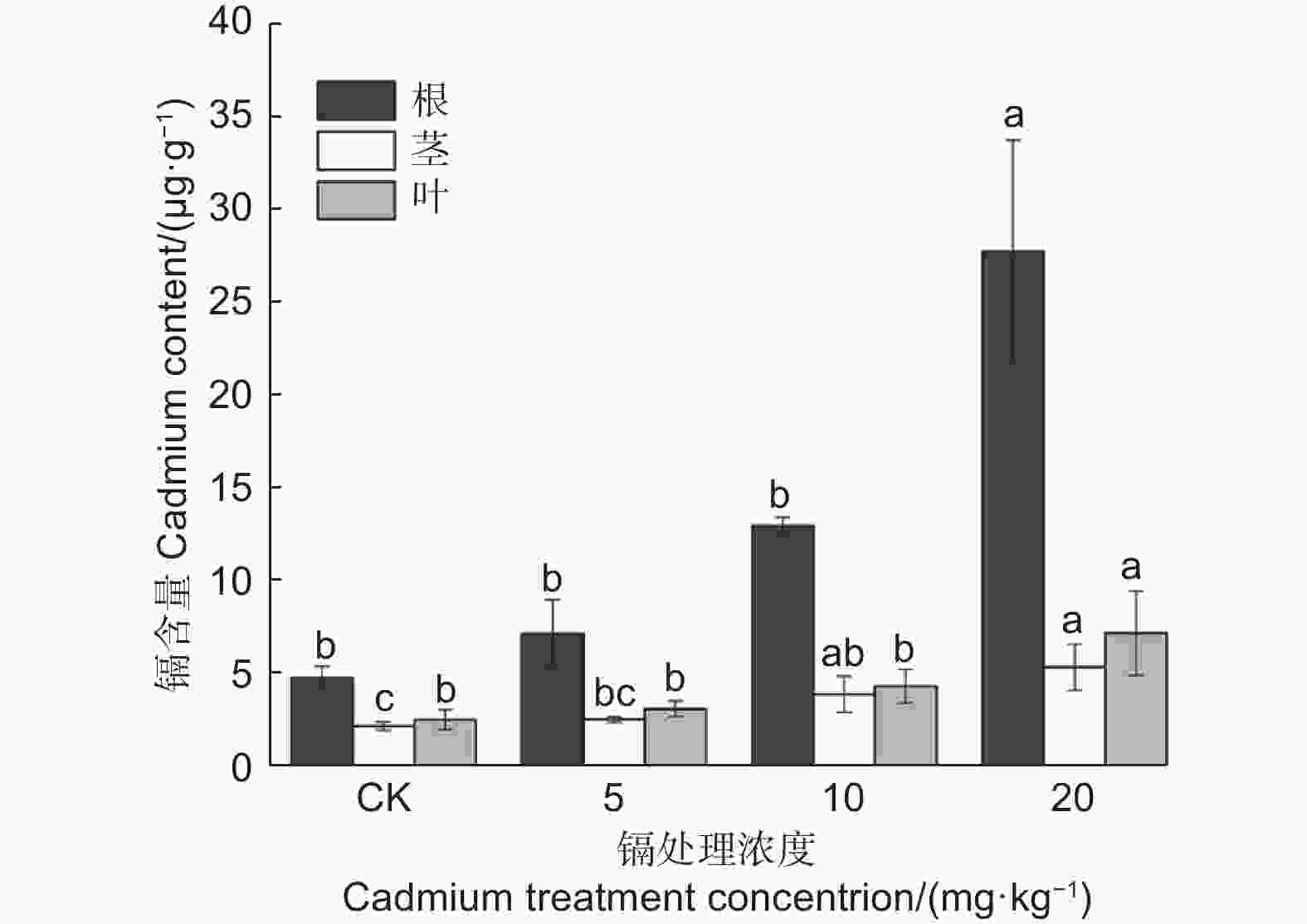
图2表明:各处理刺槐幼苗的根系镉含量均高于地上部,其镉含量大小为根>叶>茎。随着镉处理浓度增加,刺槐幼苗根、叶、茎的镉含量均逐步上升,其中,在20 mg·kg−1处理时达到最大值,相对于对照植株分别增加4.8、1.83、1.45倍且差异显著(P<0.05)。
-
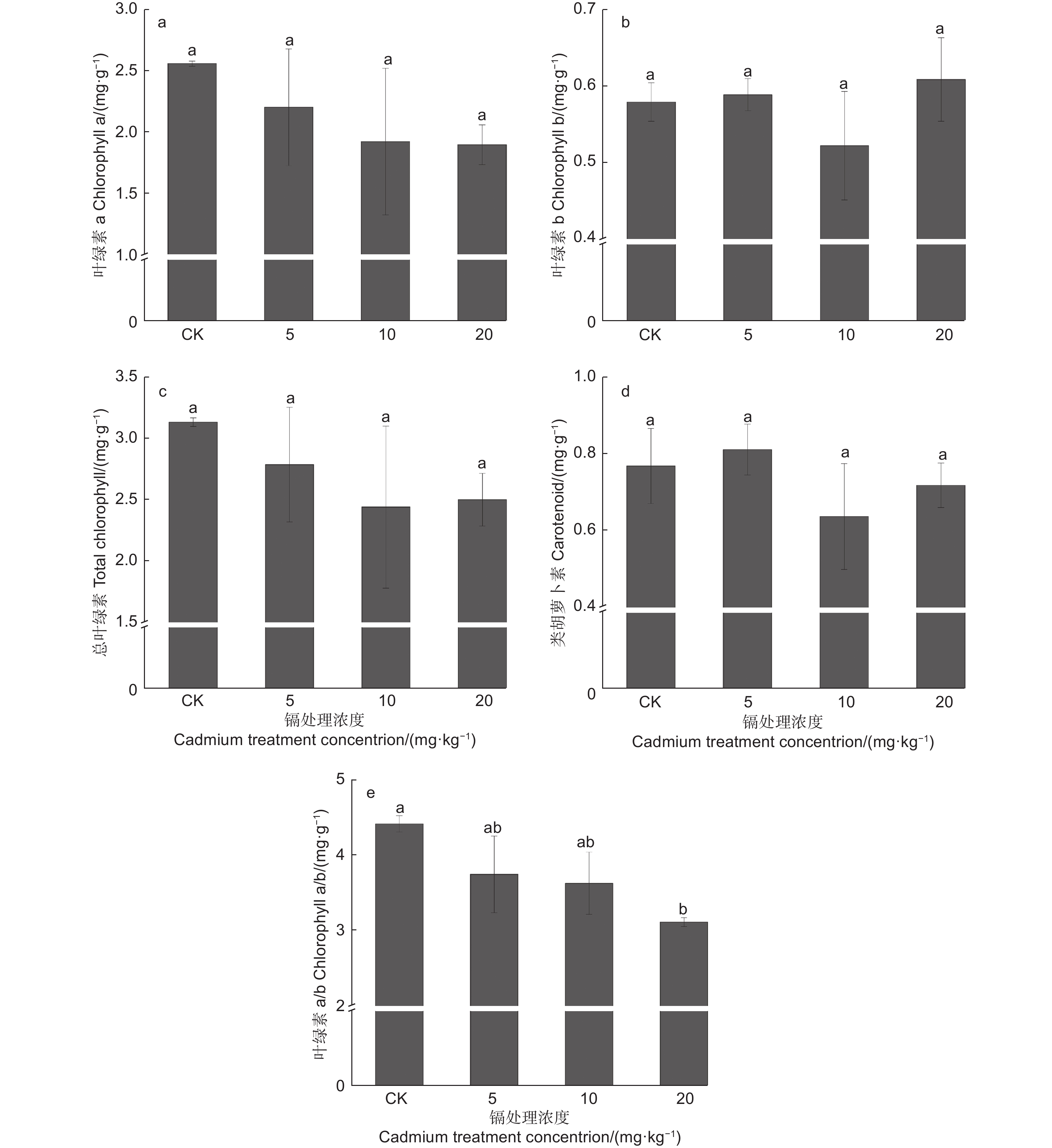
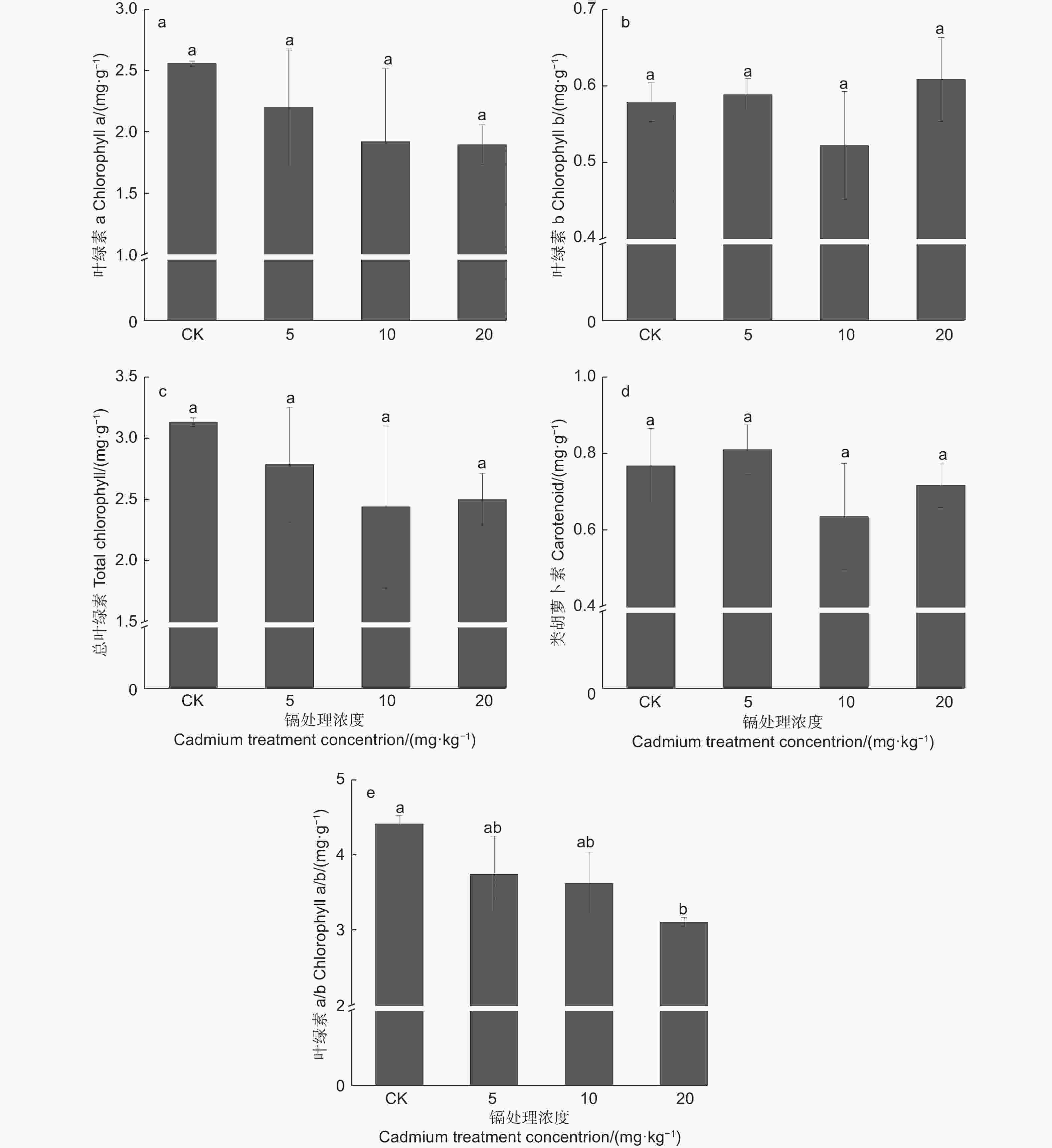
由图3a、c可知:胁迫刺槐的叶绿素a、总叶绿素含量表现相似,其含量随镉浓度增加而逐步降低,但与对照差异不显著(P>0.05),其中,20 mg·kg−1镉处理植株的叶绿素a和总叶绿素分别降低25.94%和20.21%。叶绿素b与类胡萝卜素变化相似,随镉浓度增加,其含量先降后升,呈“V”型变化(图3b、d),但与对照差异均不显著(P>0.05),其中,10 mg·kg−1镉处理植株含量最低,分别低于对照9.84%、17.18%。此外,叶绿素a/b值随着镉浓度的升高呈下降趋势,在20 mg·kg−1镉处理中,其值显著低于对照29.57%(P<0.05)(图3e)。
-
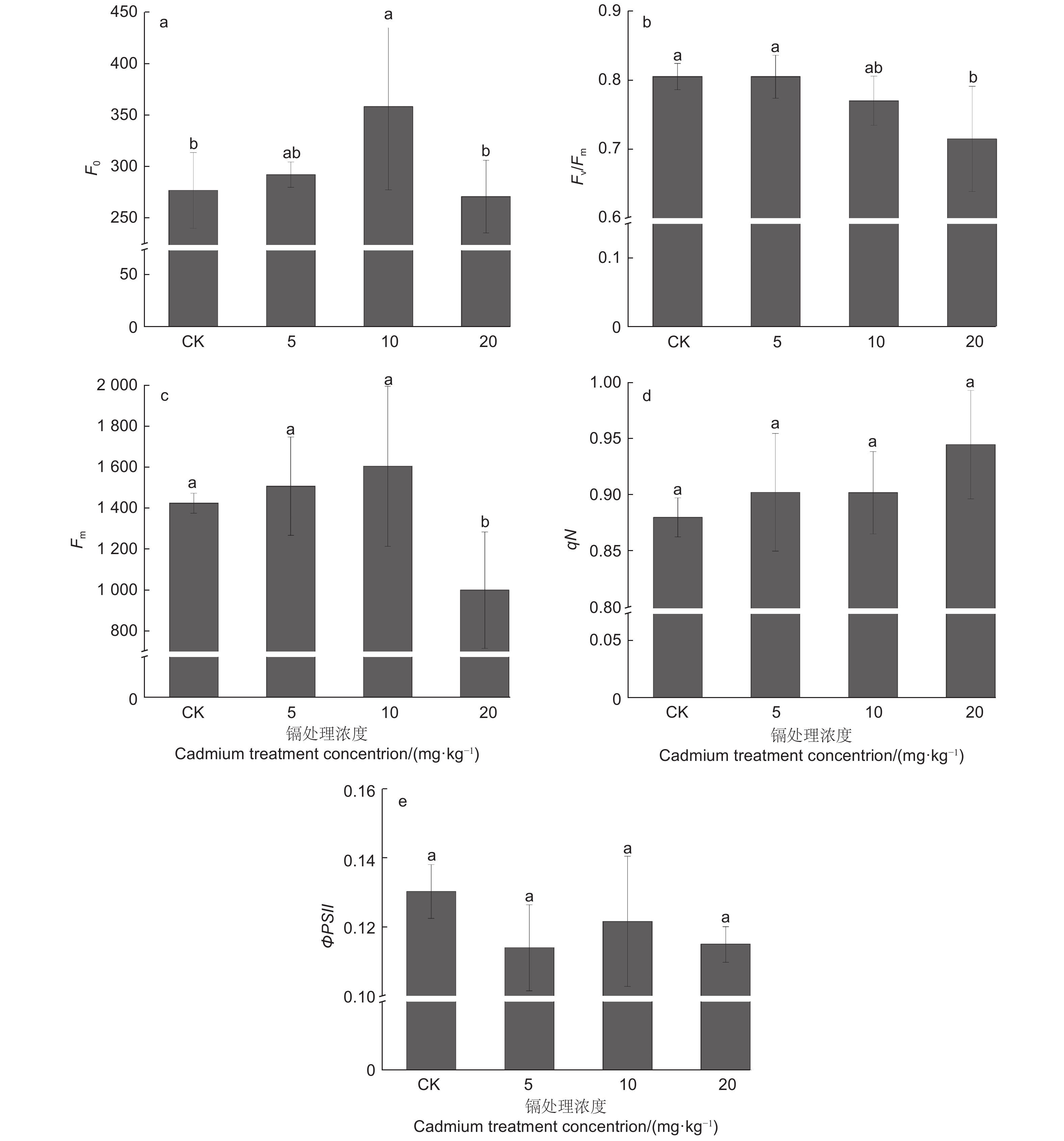
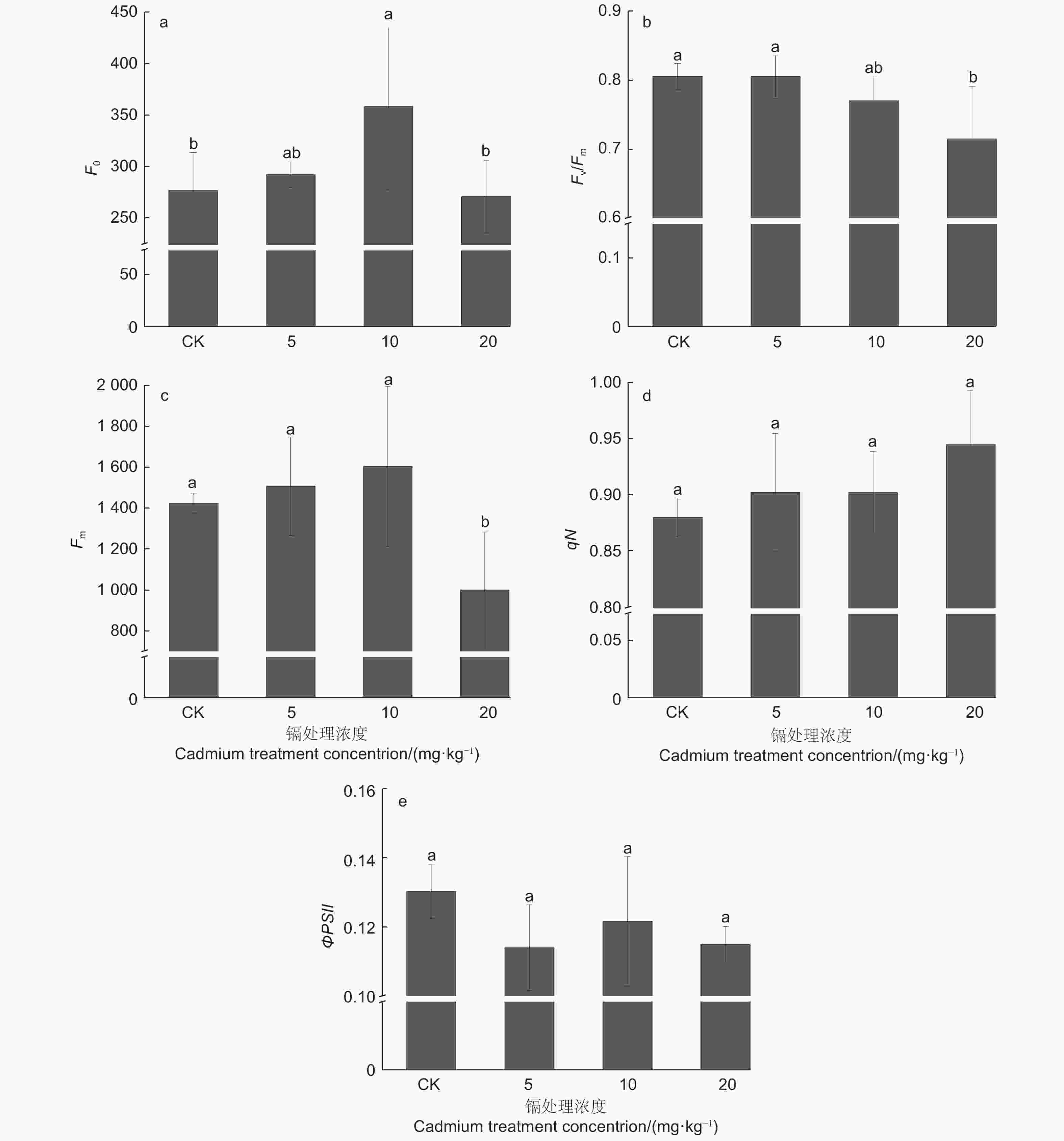
由图4a、c、d可知:随着镉浓度的增加,刺槐叶片F0、Fm整体呈现先上升后下降的趋势,但F0变化趋势明显大于其他参数。在镉浓度为10 mg·kg−1时,刺槐叶片的F0较CK增加了5.49%(P<0.05);在镉浓度为20 mg·kg−1时,叶片的Fm较CK减少了29.88%(P<0.05);不同处理下刺槐叶片qN无显著变化(P>0.05)。Fv/Fm与ΦPSII变化相似,随着镉浓度的增加,其值呈现下降趋势(图4b、e),ΦPSII与对照无显著差异(P>0.05),在镉浓度5 mg·kg−1时植株含量最低,低于对照12.53%;而Fv/Fm在镉浓度20 mg·kg−1时,其值显著低于对照11.18%(P<0.05)。
-
由表1、图5可知:从镉处理后刺槐的气孔特征看,表面存在较多气孔、凹凸不平等。随着镉浓度的增加,刺槐叶面气孔长度与面积表现相似,均呈先升高后降低趋势,叶面气孔长度和气孔面积在镉浓度5 mg·kg−1时最大,与其他处理差异显著(P<0.05),其中,在镉浓度10 mg·kg−1和20 mg·kg−1时,叶面气孔长度和气孔面积分别较CK降低了2.93%、55.18%、21.84%和61.10%。叶面气孔宽度随着镉浓度的增加呈现下降趋势,在镉浓度10 mg·kg−1和20 mg·kg−1时,均比CK显著降低了54.58%(P<0.05)。
处理浓度
Treatment
concentration/
(mg·kg−1)长度
Length/μm宽度
Width/μm面积
Area/μm2CK 9.89 ± 0.35 ab 2.84 ± 0.18 a 21.44 ± 1.88 a 5 11.07 ± 0.82 a 2.52 ± 0.08 a 21.83 ± 1.59 a 10 9.60 ± 0.33 b 1.29 ± 0.31 b 9.61 ± 1.82 b 20 7.73 ± 0.90 c 1.29 ± 0.19 b 8.34 ± 0.50 b Table 1. Effects of different cadmium concentrations on stomata of Robinia pseudoacacia leaves
-
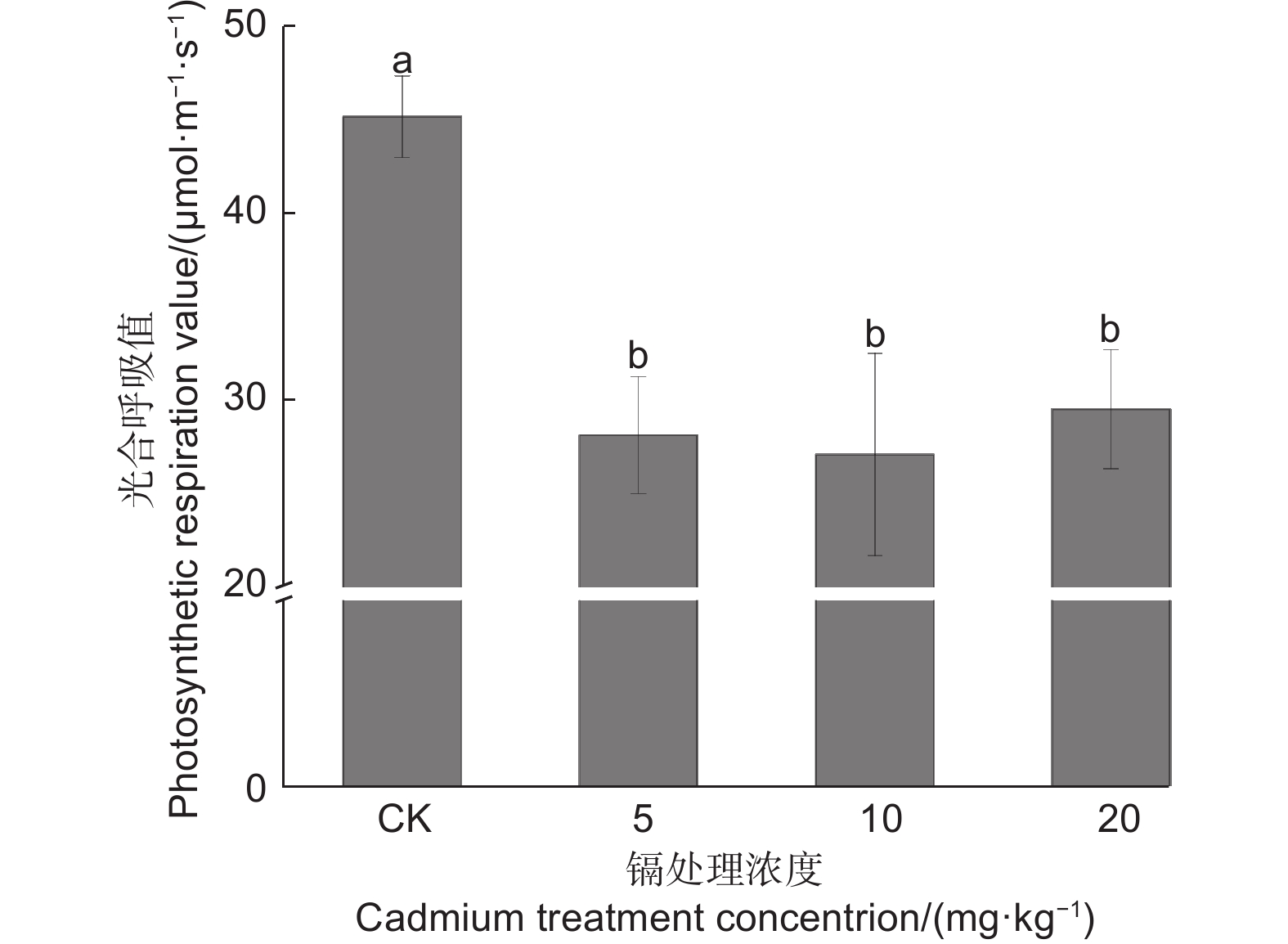
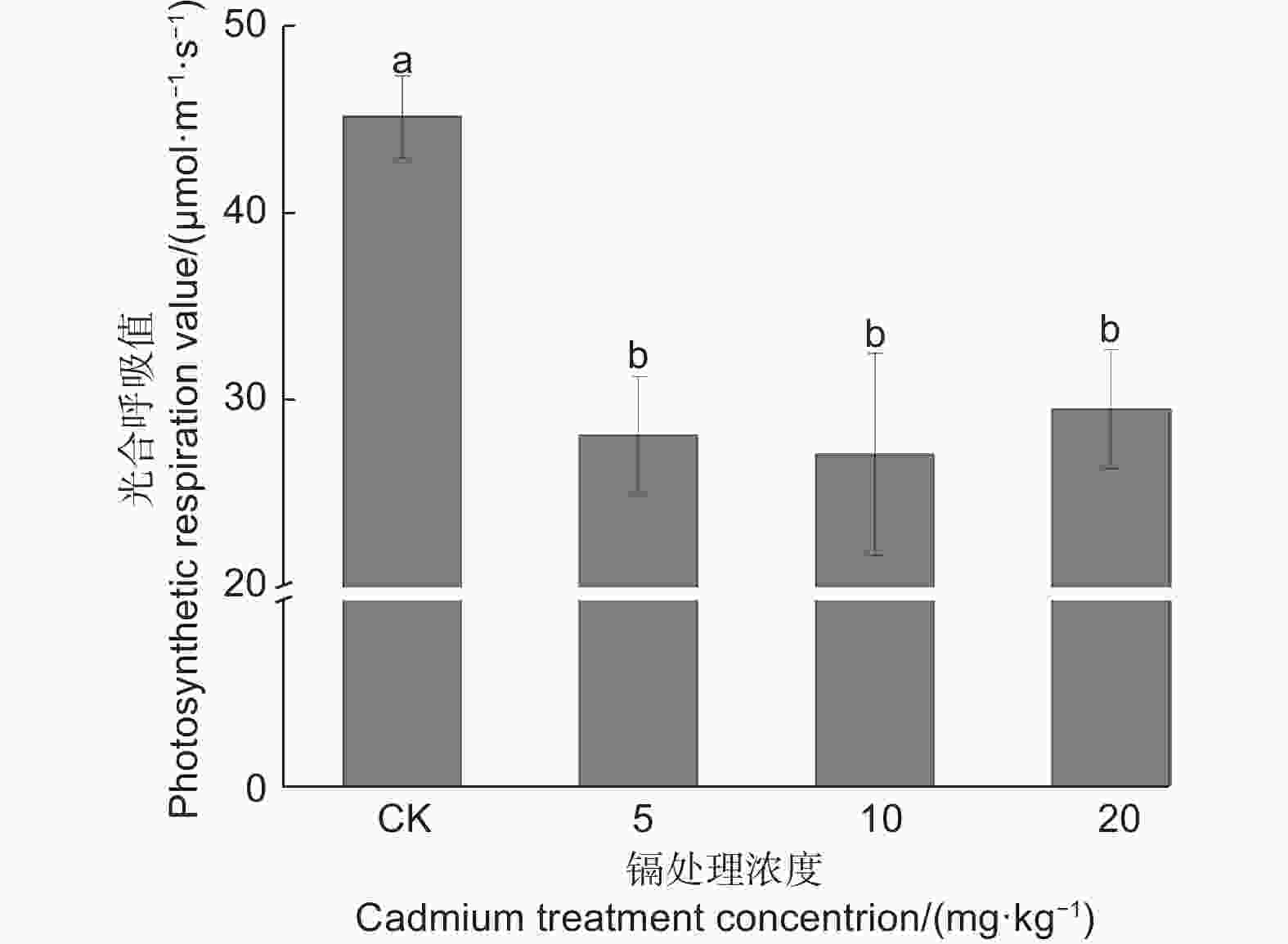
由图6可知:与CK相比,随着镉浓度的变化都不同程度地降低了刺槐幼苗叶片的呼吸速率,呼吸速率与镉浓度呈负相关;其各处理与对照均差异显著(P<0.05),在镉浓度10 mg·kg−1时对呼吸速率的影响最大,与对照相比降低了40.00%,但镉浓度处理之间呼吸速率无明显差异(P>0.05)。
-
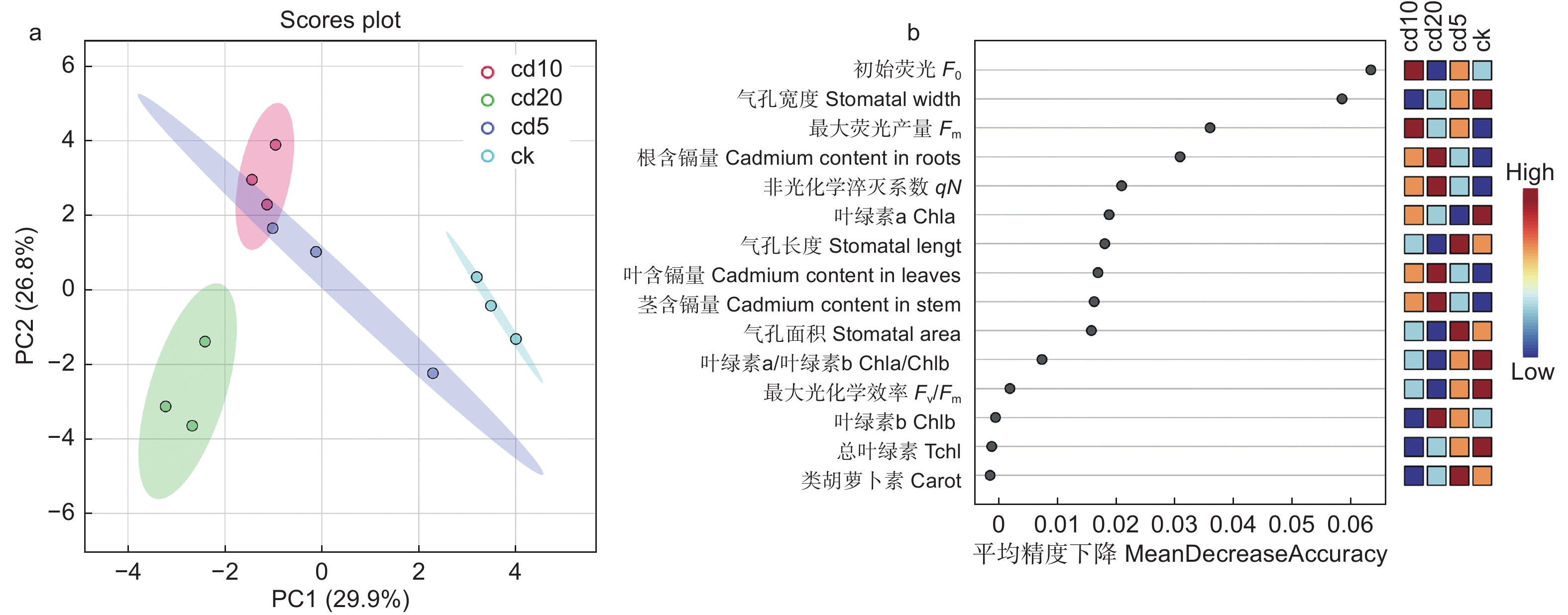
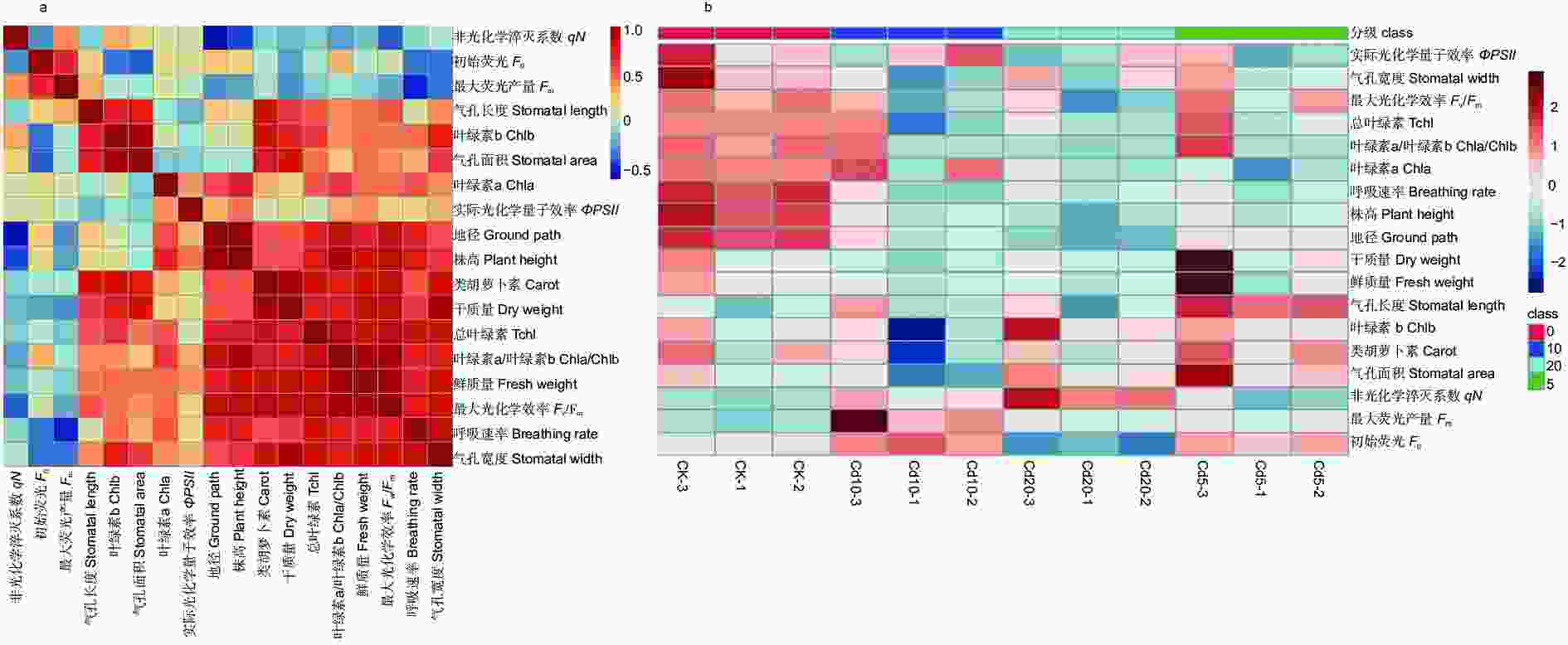
利用主成分分析进一步探究了Cd胁迫对刺槐幼苗生长与光合生理特性的影响。由表2可知:PC1占据了总方差的29.9%,PC2占据了总方差的26.8%。4个处理(CK、Cd5、Cd10、Cd20)被PC2 显著分离,其中,CK、Cd20处理与其他处理显著分离(图7a)。
指标
Index第1主成分
Prin1第2主成分
Prin2第3主成分
Prin3第4主成分
Prin4第5主成分
Prin5方差贡献率 Variance contribution rate/% 29.9 26.8 17.8 11.6 6.4 累计贡献率 Cumulative contribution rate/% 29.9 56.7 74.5 86.1 92.5 Table 2. Analysis of principal components of Robinia pseudoacacia under different cadmium concentrations
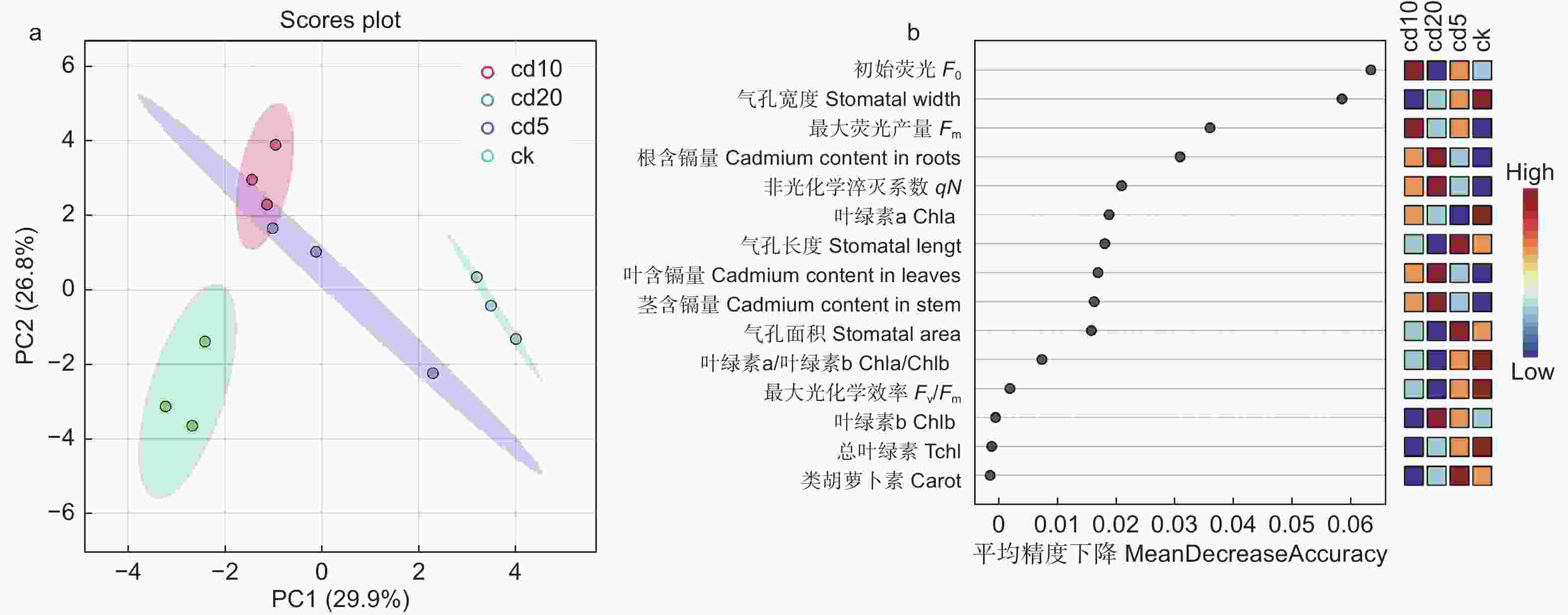
Figure 7. Principal Component Analysis II (b) and random forest regression analysis (b) of Robinia pseudoacacia seedling index changes under different concentrations of cadmium stress.
由随机森林回归结果可知:对于刺槐幼苗叶绿素含量来说,Chla的平均精度值最高;对于刺槐幼苗叶绿素荧光来说,初始荧光(F0)的平均精度值最高;对于叶面气孔来说,气孔宽度的平均精度值最高;对于植株镉含量来说,其根系镉含量的平均精度值最高(图7b)。
根据相关性分析结果(图8a、b)可知:其干质量和Chlb、Tchl、Chla/Chlb以及气孔长度呈显著正相关(P<0.05),与气孔面积、气孔宽度、类胡萝卜素呈极显著正相关(P<0.01);最大光化学效率(Fv/Fm)与刺槐幼苗的株高、地径、鲜质量、呼吸速率呈极显著正相关(P<0.01)。
-
作为毒性最强的重金属元素之一,镉浓度较低时就可以引起植物中毒,常见症状为生长速率降低[12]。本试验中,随着Cd胁迫增强,刺槐幼苗株高及地径都受到明显的抑制作用,表明在较高含量镉胁迫下刺槐幼苗受到一定程度的毒害作用。可能是随着Cd2 + 进入植物细胞,破坏细胞结构,阻碍植株细胞分裂和伸长,抑制了植物细胞分裂[13]及Cd2 + 与植物生长中的关键酶、含氮和硫基团及蛋白中心巯基结合,导致硫代巴比妥酸反应物过量堆积以及生物大分子损伤而抑制生长发育[14]。这与镉胁迫下紫花地丁(Viola philippica Cav.) [15]、巨桉(Eucalyptus grandis Hill ex Maiden )[16]等幼苗变化规律相似。然而,本试验中,低浓度Cd胁迫植株的干质量和鲜质量略微上升,而中高浓度镉胁迫植株则低于对照,但差异不显著,表明刺槐胁迫植株的光合功能与有机物积累没有受到明显影响,也体现出刺槐植株对镉胁迫具有较强的耐受性,这与巨桉结果一致[17]。在本试验中,20 mg·kg−1镉处理下刺槐根、叶的镉浓度分别为26.80、7.21 μg·g−1;而常用修复植物——火炬树(Rhus typhina L.)在25 mg·kg−1镉处理下,其根、叶镉浓度为15.05、0.33 μg·g−1[18],表明刺槐具有较强的镉富集能力。根据随机森林回归分析,刺槐根部镉含量的平均精度值最高,表明根中镉的重要性最强,对植株生长的影响程度大于叶与茎中的镉。应该是刺槐幼苗在逆境环境中,根系吸收的镉通过共质体和原生质体途径到达木质部,运输到地上部分,对地上部分造成镉毒害,影响地上部分生物量的积累[13];在较低浓度镉胁迫下,地下部可能由于Cd2 + 刺激根细胞壁中交换位点而排斥Cd2 + ,从而促进地下部的生长,这与胁迫环境中植物改变其生物量的分配方式,将其资源分配到不同器官以达到适应逆境环境 [19-20]。
-
光合色素是光合作用所必需的物质,其含量高低影响着植物的有机合成,叶片光合色素含量也直接反映了植物的生长状态[21]。相关试验证明,重金属胁迫影响叶片光合色素含量和捕光色素分子数,从而抑制植物光合作用[22]。在本试验中,镉胁迫刺槐幼苗的叶绿素a与叶绿素总量随着镉浓度升高均呈下降趋势,这与巨桉[17]等植物研究结果相似。叶绿素下降可能是镉离子进入植株体内后,抑制了植物细胞的正常分裂[23];同时增加了叶绿素降解酶活性,降低参与叶绿素生物合成的δ-氨基乙酰丙酸生物合成和原叶绿素还原酶复合物[24],导致叶绿素合成降低。相关研究表明,光合强度与叶绿素a/b值密切相关[25]。本试验中,镉处理下叶绿素a下降趋势明显强于叶绿素b,其叶绿素a/b值随着镉浓度增加呈降低趋势。根据随机森林回归发现,其刺槐叶绿素a的精度值最高,表明叶绿素a是影响光合作用的关键因子。说明刺槐叶绿素总量降低主要是叶绿素a合成受到抑制,进而影响刺槐光能利用能力。然而,各处理组植株的叶绿素含量与对照植株差异不显著,表明对刺槐光能利用能力的影响不明显,进而反应出刺槐对镉胁迫的强耐受能力。
叶绿素荧光参数可反应植物光合系统Ⅱ特性及其对光能的利用能力[26],进而可体现外界逆境对PⅡ产生的危害 [27]。随机森林回归结果显示,叶绿素荧光中F0精度值最大,表明胁迫过程中初始荧光F0重要性在叶绿素荧光指标中最强,表明PSⅡ反应中心的损害程度是影响刺槐光合功能的最关键因子。初始荧光F0表示的是光系统Ⅱ (PSⅡ) 反应中心处于完全开放时的荧光产量[28]。本试验中,镉胁迫刺槐F0增加,表明刺槐叶片PSⅡ天线色素吸收的能量流向光化学的部分减少, 以荧光形式等散失的能量增加,随着浓度的增加,破坏程度越高。因而,镉胁迫导致刺槐PSⅡ反应中心受损,影响到光量子捕捉与光反应链中电子传递,从而降低胁迫植株的PSⅡ光能转化与光合能力,使得刺槐叶片的光合效率变低,这与Fv/Fm值逐步下降一致。F v/ F m下降反应出PSII反应中心受损,大部分激化能以热能形式耗散[29-30]或光合电子传递受阻[31]。过剩激化能压力是损伤PSII的关键因素[32];而qN反映出激化能以热形式耗散的情况,与叶黄素循环途径密切相关[33]。热耗散可以避免过剩激化能对PSII的损伤[34]。在本试验中,镉胁迫刺槐qN逐步增加,表明激化能通过热耗散途径消耗的比例上升,进而缓解了激化能对PSII的压力。总之,镉胁迫降低了刺槐光系统对光能捕获效率,抑制其光化学效率,这与镉胁迫下龙葵(Solanum nigrum L.)、桢楠(Phoebe zhennan S. Lee et F.N.Wei )[35-36]等表现相似。
-
气孔是植物与环境进行水分与气体交换的重要门户[37],其孔径大小直接影响植物光合作用,也与其他生理过程密切相关[38],如蒸腾、呼吸作用等生理过程[39],而气孔特征也常作为一种指标来阐明植物在逆境中的适应性对策[40]。随机森林分析结果显示,气孔宽度的重要性在气孔特征中最强,表明气孔闭合程度是影响刺槐叶片水分与气体交换的关键因子。在本试验中,镉胁迫使得叶片气孔逐步闭合,水气交换能力与气孔导度逐步减弱,进而叶面通气性变差抑制刺槐光合作用,从而影响植株有机物积累,这与刺槐鲜质量、干质量及最大光化学效率的结果一致。然而,在低浓度镉处理中,刺槐气孔面积大于对照,这可能是因为镉对植物胁迫程度较弱,引起细胞膨胀,气孔阻力减小,蒸腾速率增大[23],将会增强水气交换能力与光合效率,促进刺槐有机物合成与生物量积累,这应该是刺槐对Cd胁迫的适应机制。当胁迫浓度超过一定范围后,植物耐性减弱,其细胞气孔阻力增大甚至关闭,从而限制外界CO2进入叶肉细胞,导致细胞胞间CO2浓度降低,即气孔对光合产生限制[41-42]。
-
镉胁迫抑制刺槐幼苗株高、地径生长,但对生物量积累影响不大;影响叶绿素合成,导致光化学反应减弱,热耗散增强,但程度不明显;降低刺槐呼吸强度,逐步闭合叶片气孔,表明刺槐幼苗生长与光合生理受到一定影响,但刺槐仍表现出较强的镉胁迫耐受性,虽然与其他超积累植物存在差距,但其根表现出较强的镉积累能力,在镉污染土壤植物修复中具有较好的应用潜力。
Effects of Cadmium Stress on Growth and Photosynthetic Physiological Characteristics of Robinia pseudoacacia Seedlings
- Received Date: 2022-09-12
- Accepted Date: 2022-12-17
- Available Online: 2023-06-20
Abstract:





 DownLoad:
DownLoad: