-
杜仲(Eucommia ulmoides Oliv.)属于杜仲科杜仲属,进化上相对保守,是一种古老的树种。杜仲在我国已有2000多年栽培历史,广泛分布于我国多省区。杜仲组织中存在一定数量的含胶细胞,含胶细胞中储存有天然橡胶的异构体杜仲胶(反式-1,4-聚异戊二烯),故以杜仲叶片和果实作为主要原料提取杜仲胶。天然橡胶作为一种重要的战略物资,由于国际橡胶市场供需关系日趋紧张,严重影响我国天然橡胶资源安全,因此,大力发展杜仲胶产业对于保障我国的天然橡胶资源安全具有重要意义[1-4]。大力开发杜仲胶产业,需要发展杜仲种植业、提升杜仲种质资源品质,这就要求研究人员从植株、细胞和分子等水平系统地研究杜仲产胶过程,为杜仲胶生成机制研究提供支撑,从而能够在根本上提升杜仲的胶产量和品质。目前,对于杜仲产胶机制的相关研究主要集中在基因、蛋白质、代谢组和植株水平[5-9],细胞形态学水平研究较为缺乏。
杜仲含胶细胞主要分布在茎、叶、根、果实及雄蕊组织中[10-11]。早在古代,我国的劳动人民就已经发现杜仲茎皮存在“折之内有白丝相连”的现象[12]。史自强等[13]采用溴-碘-冰醋酸变性试剂处理后进行石蜡切片的方法观察到了棕色变性橡胶丝。田兰馨等[14-15]采用石蜡切片法在杜仲1年生茎初生韧皮部观察到含胶细胞,采用薄切片法对杜仲1年生茎中含胶细胞发生和发育进行了研究,并描述了茎中含胶细胞自原始细胞发育至成熟过程的细胞内部结构变化。崔跃华等[16] 、申延等[17]也在1年生茎和当年生果实中观察到了类似细胞内部结构变化。崔跃华等还采用碱溶液离析组织的方法对果皮、叶片和叶柄的含胶细胞长度进行了离析测量[18];周莉英等[19]采用溴-碘-冰醋酸试剂变性处理后以碱溶液离析叶片中含胶细胞束的方法,对不同月份叶片中含胶细胞的长度进行了动态分析。Nakazawa等[20]采用激光共聚焦显微技术对杜仲茎组织切片进行荧光染色分析,认为杜仲含胶细胞内部橡胶粒子的融合过程和反式-1,4-聚异戊二烯的积累同时进行,并提出了一种含胶细胞反式-1,4-聚异戊二烯合成及积累过程的模型,分为细胞分化和伸长、橡胶粒子堆积、橡胶粒子充满乳管并融合三个阶段;利用扫描电子显微镜技术对杜仲茎中含胶细胞断面进行研究,认为反式-1,4-聚异戊二烯最初以棒状粒子形式在含胶细胞中合成,并随着细胞成熟而转变为纤维状结构,最终充满细胞腔。赵喜源[4]也通过断面表征观察到含胶细胞内部的橡胶粒子。杜仲含胶细胞的内部橡胶粒子是积累天然高分子聚异戊二烯的细胞器,其发育机制尚未有相关文献报道。橡胶粒子的基本结构与脂质体一致,内部为疏水橡胶球芯,外部为单层生物膜。单层生物膜作为相界面防止颗粒聚集[21]。杜仲含胶细胞在乳管分类中属无分支-非铰接型乳管[22]。无分支-非铰接型乳管在生长中原基伸长成一个不分枝的管道,通过侵入性生长方式生长[22-23]。前人对杜仲含胶细胞的解剖结构、起源分化和杜仲胶积累机制进行了一定的研究,但关于杜仲含胶细胞的起源、发育和成熟过程的细胞形态特征变化过程尚且不足。本研究通过利用整体观察法和组织切片法对杜仲茎、种子萌芽期子叶和幼苗期子叶的含胶细胞的起源、发育和成熟过程的细胞形态特征进行了更深一步的研究,以期为解释含胶细胞起源、发育和成熟过程提供细胞形态学证据。
-
实验材料:2年生杜仲茎(2021年5月15日取自北京市杜仲公园内野生杜仲成树,取样后于FFA固定液中固定7 d);当年生杜仲嫩茎(取自播种204 d的杜仲幼苗,取样后于FFA固定液中固定7 d);杜仲种子(杜仲果实于2021年10月采集于北京市杜仲公园,去壳后备用);杜仲叶片(2020年7月29日取材于北京大学内野生杜仲成树)。
实验仪器:Leica CM1950冰冻切片机(徕卡公司,德国),徕卡DMi1倒置数码显微镜(徕卡公司,德国)。
实验试剂:次氯酸钠溶液-盐酸变性试剂(等体积的23.2 mmol·L−1 NaClO溶液和2.0 mol·L−1 HCl溶液,使用时混匀),苏丹III染色液(3.4 mmol·L−1的苏丹III的乙醇溶液),FFA固定液(福尔马林:冰醋酸:70%酒精:丙三醇=5:5:90:5)。
-
取直径3 mm左右杜仲茎,切下节间并完整环剥杜仲茎皮,以去离子水清洗;加入次氯酸钠溶液-盐酸变性试剂,混匀后静置3 d完成变性;变性后茎皮去除木栓层保留皮层,使用去离子水清洗2 次;使用苏丹III染色液对变性后皮层染色12 h,以8.6 mol·L−1乙醇溶液洗去浮色,制作临时装片;染色后的杜仲茎皮层压平并干燥后,使用二甲苯(天津大茂)透明30 min,后采用中性树胶封片剂(上海懿洋)封固制成永久装片;采用数码生物显微镜对装片中的含胶细胞结构进行拍照,后用Adobe Photoshop CC 2019对提取的图像进行拼合。
-
含胶细胞直线长度l为含胶细胞2个膨大端最远点之间距离,代表含胶细胞在组织中占据的空间位置;含胶细胞轴长度为2个膨大端的长轴长 a1、a2和为胞体切线垂线被胞体所截线段中点连线s(以下简称中线)长度之和共同构成,代表着胞体实际生长所占据的内部空间长度;直线长度与轴长度之比代表着含胶细胞胞体的曲折程度。基于以上定义对1.2.1过程提取的含胶细胞图像进行形态数据提取。
杜仲含胶细胞是一种“十分细长、两端膨大、内部充满硬橡胶颗粒的丝状单细胞”[15],故将含胶细胞2个膨大端近似为椭球体,胞体近似为圆柱体,含胶细胞中体积V估算式为式 (1)。对1.2.1过程提取的含胶细胞图像的参考图1D并按照式(1)进行体积估算。
式中:s为含胶细胞胞体轴长度,a1、a2为2个椭球体的长轴长,b1、b2为2个椭球体的短轴长,
$\bar{d}$ 为胞体平均直径。 同时对含胶细胞体积和膨大端体积占比进行计算。采用Adobe Photoshop CC 2019软件对含胶细胞胞体像素进行统计并换算为X-Y平面的投影面积S。将X-Y平面的投影面积S除以含胶细胞胞体轴长度s得到胞体平均直径$\bar{d}$ 。 -
取当年生杜仲茎样品,以去离子水清洗;加入次氯酸钠溶液-盐酸变性试剂,混匀后静置24 h完成变性;变性后样品使用去离子水清洗后,以苏丹III染色液整体染色12 h,使用8.6 mol·L−1乙醇溶液洗去浮色;使用冷冻包埋剂垂直包埋变性整体染色后的样品,采用冷冻切片机对样品进行切片,在湿润的载玻片上展开切片,用数字显微成像系统对杜仲组织进行拍照。
-
恒温培养箱中萌发的杜仲种子以FFA固定液固定2 d;取固定后种子萌芽期子叶,以去离子水清洗,加入11.4 mmol·L−1 NaClO溶液,静置2 d至子叶至透明无色完成去除脂质并变性;将处理后子叶样品徒手剥离上表皮,制作临时装片;用数码生物显微镜对含胶细胞结构进行拍照,Adobe Photoshop CC 2019对提取的图像进行拼合及数据测量。
取固定后种子萌芽期子叶,以去离子水清洗;加入次氯酸钠溶液-盐酸变性试剂,混匀后静置2 d完成变性;使用去离子水清洗,以苏丹III染色液染色12 h,使用8.6 mol·L−1乙醇溶液浸泡1 h洗去浮色;将整体染色后子叶移至培养皿内的载玻片上,滴加1.31 mol·L−1 NaOH溶液覆盖子叶表面处理1 h,之后吸去NaOH溶液;使用棉签破坏子叶表皮细胞并用去离子水洗去组织碎片,留下染色后的丝状物制作临时装片;用数码生物显微镜对含胶细胞结构进行拍照,Adobe Photoshop CC 2019对提取的图像进行拼合及数据测量。
-
萌发的杜仲种子栽种于土壤中,1个月后得到杜仲幼苗。杜仲幼苗期子叶以FFA固定液固定2 d;取固定后幼苗期子叶样品,以去离子水清洗;加入次氯酸钠溶液-盐酸变性试剂,混匀后静置1 d完成变性;使用去离子水清洗,以苏丹III染色液染色12 h,使用8.6 mol·L−1乙醇溶液洗去浮色,制作临时装片;用数码生物显微镜对含胶细胞结构进行拍照,Adobe Photoshop CC 2019对提取的图像进行拼合及数据测量。
-
新鲜杜仲叶片组织投入固定液后,送样武汉赛维尔生物科技有限公司对叶片主脉制作切片并以生物透射电镜进行检测。
-
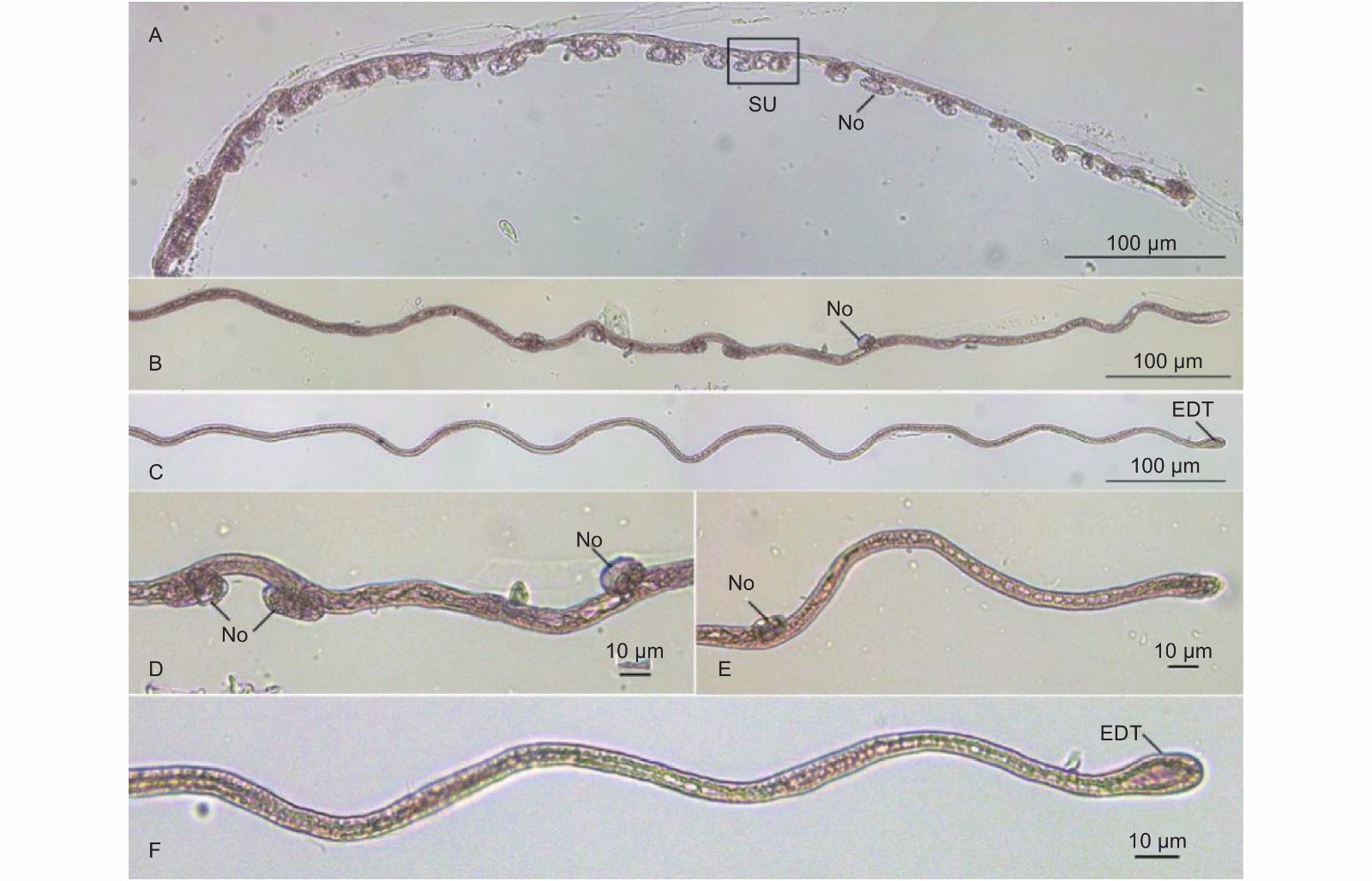
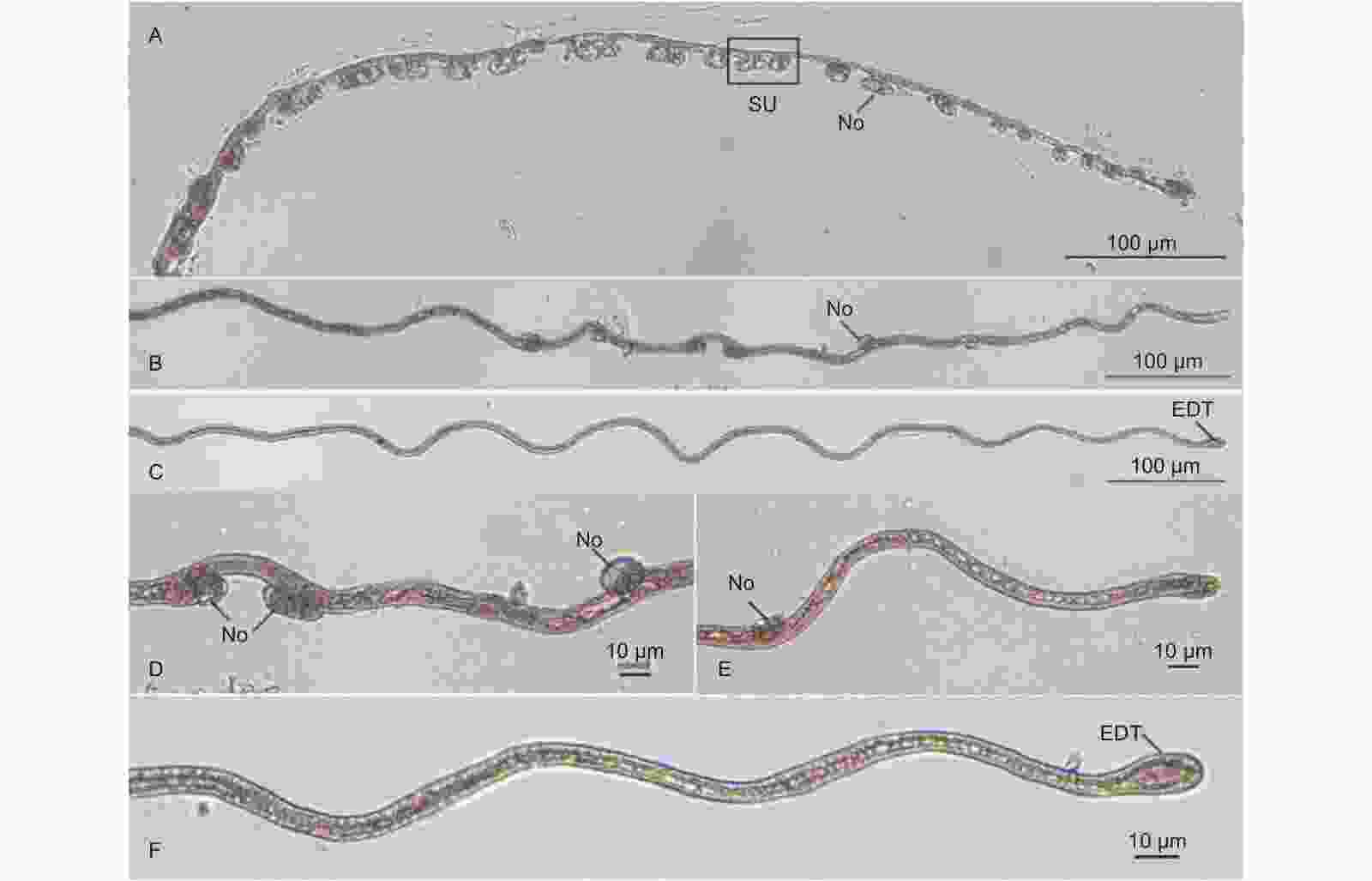
含胶细胞在杜仲茎皮层内大量存在,部分含胶细胞单独生长,与其他含胶细胞无纠缠。取得的3个单独生长的含胶细胞外部形态的完整高分辨率图像见图1。杜仲含胶细胞由宽度均匀的细长胞体和近似为椭球体的2个膨大端构成;胞体基本与杜仲茎的轴方向平行,结构呈近似直线状或折线状;自然状态下的含胶细胞整体无色透明,经变性整体染色法处理后细胞整体被苏丹III染成红色。含胶细胞形态结果符合以往文献中对成熟含胶细胞形态的叙述,故其为含胶细胞的成熟形态。
对取得的14个成熟含胶细胞照片进行统计分析。统计结果显示:茎皮层中杜仲成熟的含胶细胞轴长度范围为981 ~ 3 167 μm,直线长度范围为813 ~ 3 149 μm,直线长度与轴长度之比范围为1:1.00 ~ 1:1.21,平均轴长度为2 086.9 μm。
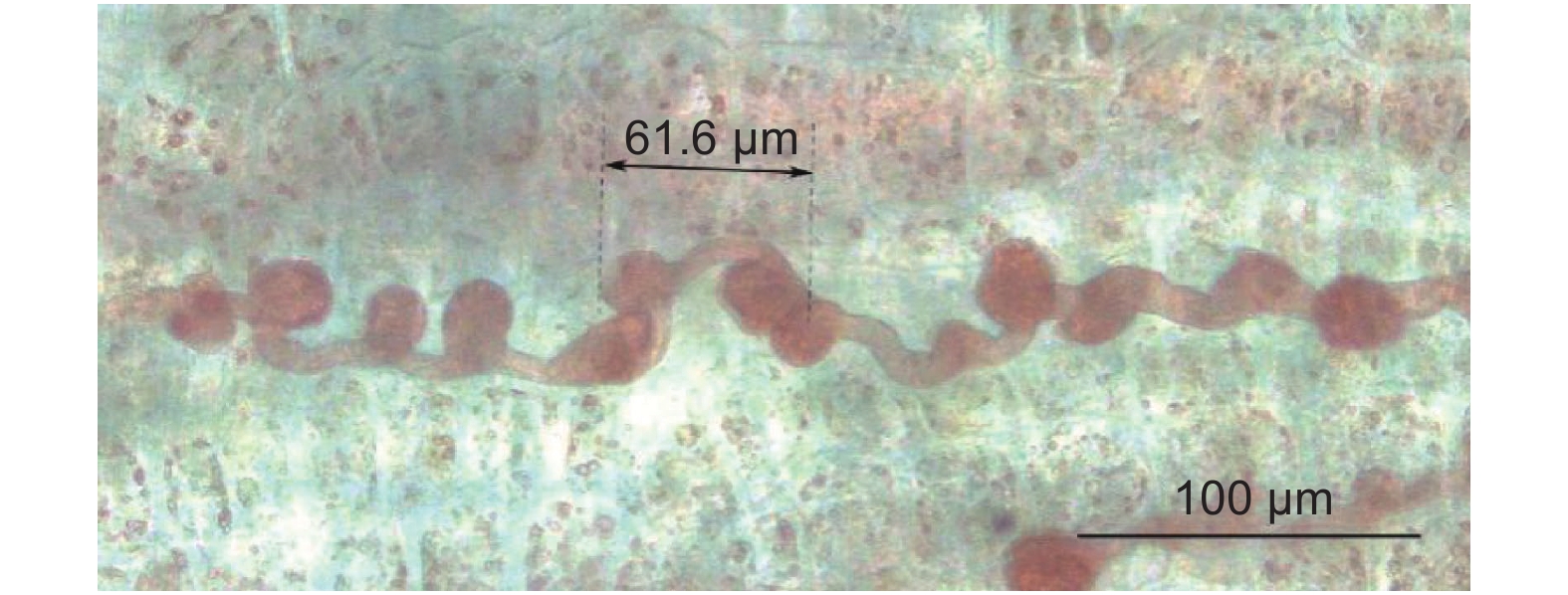
在杜仲茎皮层中观察到与含胶细胞具有相同染色的特殊结构见图2、图3。图2表明:结构具有两端膨大、胞体细长的特征,与成熟的含胶细胞特征相同;直线长度为1 196.8 μm,达到成熟含胶细胞直线长度,故这种特殊结构属于含胶细胞;含胶细胞在其细长的胞体上具有多个膨大节,成熟含胶细胞并不具备,因此,图2属于含胶细胞的成熟过程中间形态,是成熟中的含胶细胞。图3显示:该结构存在10个较为密集的膨大节,相邻膨大节之间直接相连或由一段长度较短的胞体相连,因此,是另一个成熟中含胶细胞的局部图像。图3中虚线标注的亚结构呈哑铃状,由一段28.9 μm的细长胞体和2个膨大节构成,结构两端最远处距离为61.6 μm;哑铃状结构右端膨大节与另一个膨大节直接相连;左端膨大节与膨大节同样直接相连,但在2个膨大节间出现了长度为18 μm的胞体结构。图3中哑铃状亚结构与其直接相连的2个膨大节间存在无胞体结构和有胞体结构2种情况,代表相邻亚结构的膨大节之间的相连过程先于相邻的哑铃状结构之间胞体出现的过程。对比图2和图3结果,图2含胶细胞膨大节更少、分布更稀疏,膨大节间胞体长度更长。
对46个含胶细胞膨大端照片进行统计分析,结果显示:膨大端椭球体短轴长度(膨大端宽度)范围为8.6 ~ 22.4 μm,椭圆形的长轴与短轴之比范围为1.08 ~ 1.77。
茎皮层中含胶细胞局部图像见图4所示。含胶细胞周围有一定的空隙(图4A);经二甲苯透明后含胶细胞膨大端大部分胞质均匀无内部结构(图4B),少部分在椭球体中心处有球状结构,在显微镜光源照射下显得十分明亮(图4C);大多数胞体无内部结构(图4D黑色箭头处),少部分在中线处有连续的内部结构,在显微镜光源照射下显得十分明亮(图4D白色箭头处),其余部分胞质染色均匀。
图4C和图4D中含胶细胞内部存在光照下显得明亮的结构现象,类似于玻璃经光照后夹杂的气泡呈明亮状的现象。分析光在含胶细胞内外的传播情况:显微镜光源发出的光由于受到周围环境影响,到达含胶细胞表面时光线方向各异。将含胶细胞胞体近似为圆柱体,当光于细胞表面进入细胞质时,此时含胶细胞细胞质的亮度与周围组织未有明显差异,代表永久装片中覆盖在样品表面的中性树胶封片剂(nD,20: 1.521 6 ~ 1.524 0)和二甲苯(nD,25: 1.493 25 ~ 1.502 95[24])透明处理后的周围组织与二甲苯透明处理后的含胶细胞细胞质的折射率差异较小,光只发生了曲面折射。当光由含胶细胞细胞质进入内部结构时,此时观察到含胶细胞胞体中线处具有呈明亮内部结构,代表相当一部分的光在二甲苯透明后的细胞质与内部结构两相界面上发生了全反射现象。全反射现象的发生条件之一为光由光密介质进入光疏介质,故含胶细胞内部结构的折射率小于含胶细胞细胞质的折射率。综上所述,该内部结构在光源照射的情况下显得十分明亮,是因为其折射率小于二甲苯透明后的含胶细胞细胞质的折射率,故该内部结构与二甲苯透明的细胞质折射率更低且存在明显的相界面。
当年生杜仲茎的整体染色冷冻切片结果见图5,含胶细胞(染色后呈红色部分)主要分布在皮层韧皮部,有的含胶细胞单独生长,有的含胶细胞聚集生长。单独生长的含胶细胞胞体垂直于轴方向生长时其胞体截面近似圆形,故含胶细胞胞体可近似为圆柱状处理(图5白色箭头处)。
-
茎皮层中3个单独生长含胶细胞图像见图1A、B、C所示,对其进行形态学数据测量,参考图1D并按照式(1)进行体积估算,同时计算膨大端体积占含胶细胞体积比例ω,结果见表1。
项目
Project图1测量数据
Fig. 1 Measurement dataA B C 直线长度l/μm 2 030.0 1 765.8 1 922.6 左膨大端长轴长a1/μm 30.1 34.7 25.1 右膨大端长轴长a2/μm 22.4 22.4 22.2 左膨大端短轴长b1/μm 22.5 25.1 18.4 右膨大端短轴长b2/μm 17.1 22.2 15.9 胞体长度s/μm 2 074.3 1 708.7 1 875.3 轴长度Axis length/μm 2 126.8 1 803.3 1 997.3 胞体平均宽度$\bar{d}$/μm 12.2 10.1 9.6 含胶细胞体积V/mm3 2.61 × 10−4 1.92 × 10−4 1.51 × 10−4 膨大端体积占含胶细胞体积比例ω/% 6.27 10.94 4.73 Table 1. Morphological data of laticifer cells
经体积估算得到单个含胶细胞体积范围为1 × 10−4 ~ 3 × 10−4 mm3。含胶细胞膨大端长轴远小于整个含胶细胞的长度,短轴长却为胞体平均宽度的2倍左右。计算结果显示,膨大端在含胶细胞总体积中占据相对较大的比例(4% ~ 11%)。
-
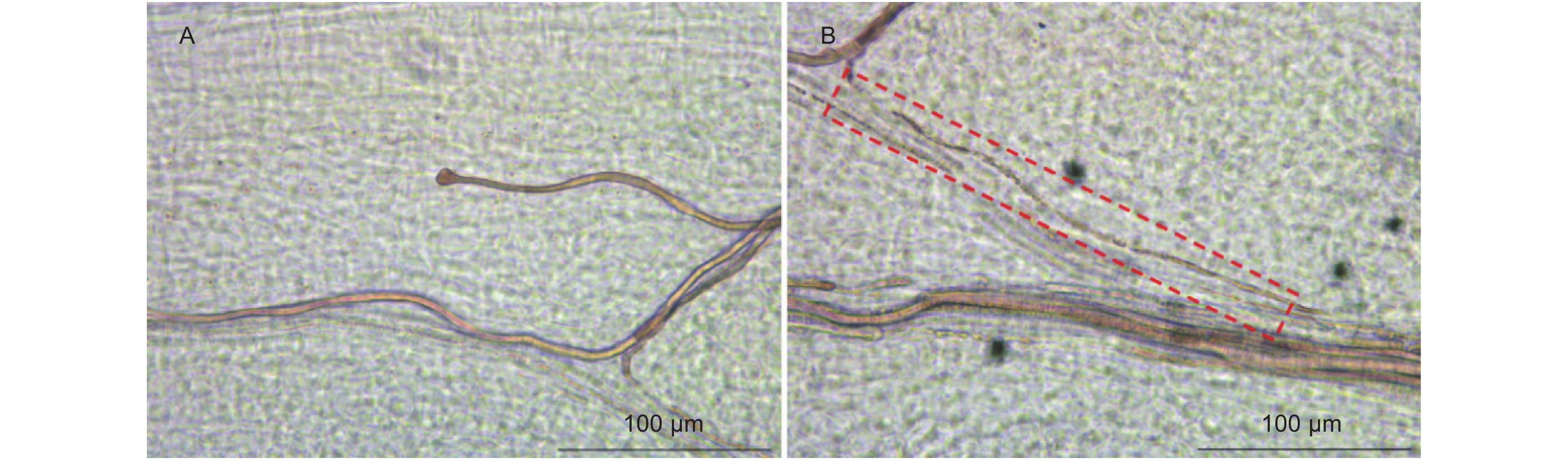
种子萌芽期子叶局部显微图像见图6。在种子萌芽期子叶靠近胚一端处(图6B红框位置)观察到子叶中原位生成的含胶细胞束向杜仲胚方向延伸的一连串细胞结构(图6A),该结构远离含胶细胞集束,在子叶中孤立存在。由于含胶细胞原位生成并以侵入性生长方式协调地生长,同时随着植物的生长而伸长,故在种子萌芽期子叶中,原位发生的含胶细胞束中的含胶细胞结构位置越远离集束、在子叶中存在越孤立、结构伸长的越短,则其发育时期越早。因此,一连串含胶细胞结构可以确定为含胶细胞的早期结构,是含胶细胞的最初状态。含胶细胞的早期结构可以分为两个部分:图6A结构右侧存在三个中间弯曲细长、两端膨大的哑铃状结构,结构间紧邻但不连续,细胞质较周边组织有明显的折射率差异。图6A中从右至左的3个哑铃状结构两端最远距离分别为63.5、38.2、48.9 μm;3个结构内部细长处宽度在5 μm左右,具有较大长宽比,基本符合田兰馨[14-15]文献中原始细胞叙述。其中,右侧第一个哑铃状结构显著不对称,其靠近胚的一端宽度达到16.9 μm,尺寸接近于含胶细胞膨大端短轴长,而另一端宽度仅为8.5 μm。图6A结构左侧存在一个连续结构,右端微有膨大但与哑铃状原始细胞间两端距离紧密却存在界限;胞身含有2个膨大节,宽度分别为12.9 μm和10.9 μm;两个膨大节间胞体长度为40.9 μm。
杜仲幼苗期子叶含胶细胞图显示:杜仲子叶中的成熟含胶细胞胞体细长,具有不规则形态的膨大端,细胞整体均一、透明、染色均匀(图7A)。有在螺纹导管存在的叶脉区域,发现众多具有与成熟含胶细胞相同染色的断续结构,其近似构成了一条曲线(图7B红色框线处)。相比种子萌芽期子叶,幼苗期子叶中含胶细胞密度更低,可以清晰地看到单独生长的含胶细胞。
以图6A结构作为含胶细胞发育过程形态研究起点,图7A含胶细胞作为发育过程形态研究终点,分析解离的染色后含胶细胞束中的含胶细胞成熟过程的中间形态。含胶细胞特殊形态如图8所示:图8A、B、C分别是3种有代表性的成熟中含胶细胞结构。图8A得到的结构类似于图6A,整体结构连续,其中,右侧第1个哑铃状结构显著不对称,右端宽度为11.9 μm,左端宽度为5.9 μm,两端最远距离为45.2 μm;通过对比图8A结构的自身差异发现,距结构右侧最远端距离86.7 μm至273.3 μm区域内的膨大节间胞体较其他位置胞体有明显的伸长迹象。图8B中结构仅有5个膨大节,膨大节分布稀疏,相邻2个膨大节之间的胞体长度存在显著差异;胞体一端未见明显膨大端。图8C是一种连续的但不含膨大节的结构,除存在内部结构外,整体形态与成熟的含胶细胞相同,椭圆形的膨大端出现。图8A、B、C含胶细胞结构均具有相连的类似含胶细胞胞体的连续结构,内部存在一定的内部结构,区别在于膨大节有无、相邻膨大节之间胞体长度差异和膨大端的有无。由此可以认为,图8A、B、C分别显示的是3个处于不同发育时期的含胶细胞,图8A和图8B的差异可能是由于随着含胶细胞逐渐成熟,不对称的哑铃状原始细胞结构消失,膨大节之间胞体伸长及连接相邻亚结构单元的胞体伸长造成的。由以上结果对其发育时序排序为:图8A→图8B→图8C。故以发育时期先后顺序对含胶细胞形态图像排序为:图6A→图8A→图8B→图8C→图7A。
图8D为图8B胞体膨大节局部放大图。图8E为膨大节分布稀疏且无膨大端的含胶细胞局部图像,含胶细胞与图8B含胶细胞处于同一发育时期,其细胞内部存在不连续的椭球状结构。图8F为无膨大节、有膨大端的含胶细胞的局部图像,含胶细胞外形已非常接近成熟的含胶细胞,但内部具有一些平行结构,该结构于含胶细胞末端膨大区汇合。平行的内部结构形成,可能代表着含胶细胞进入了新的发育时期。
-
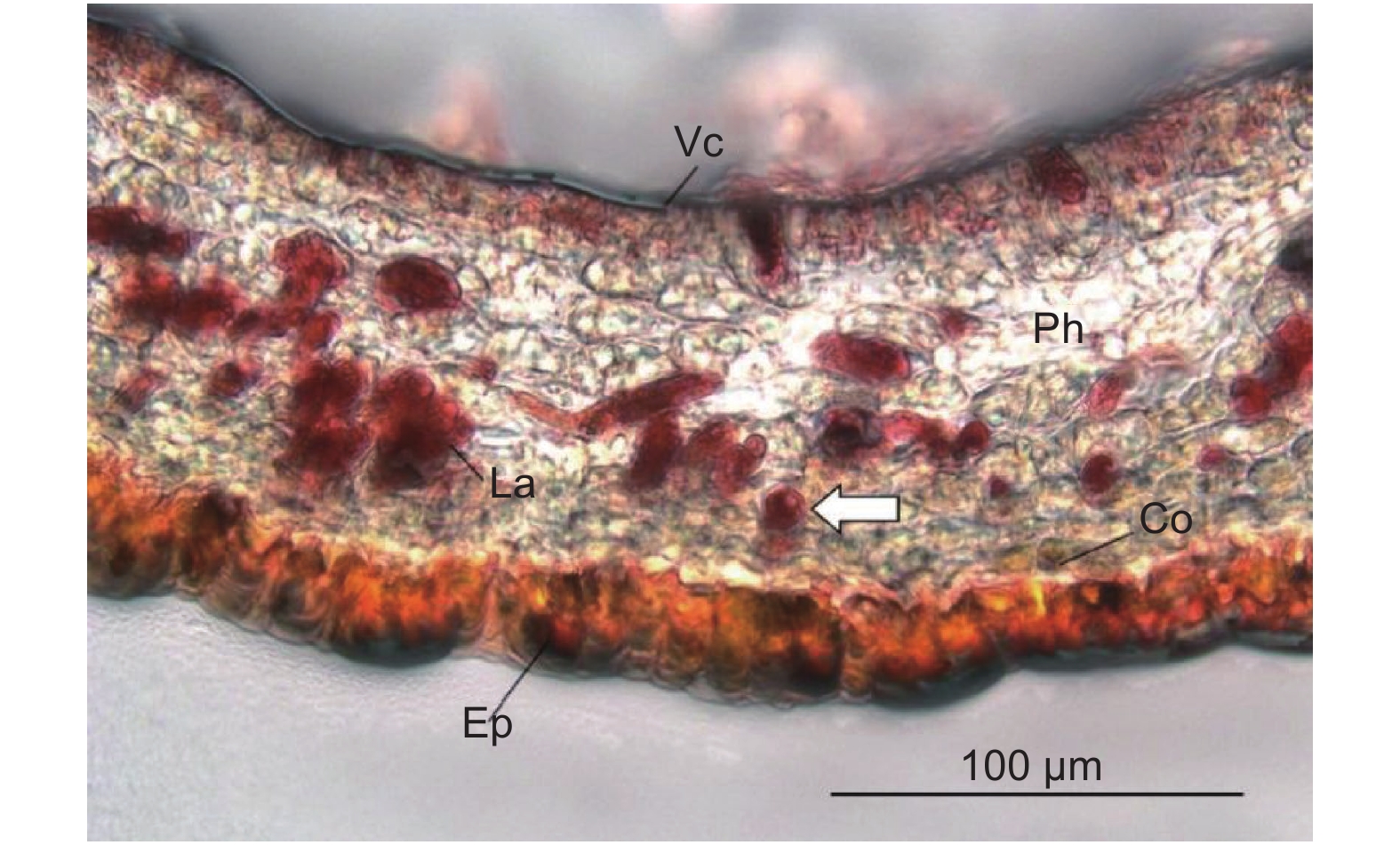
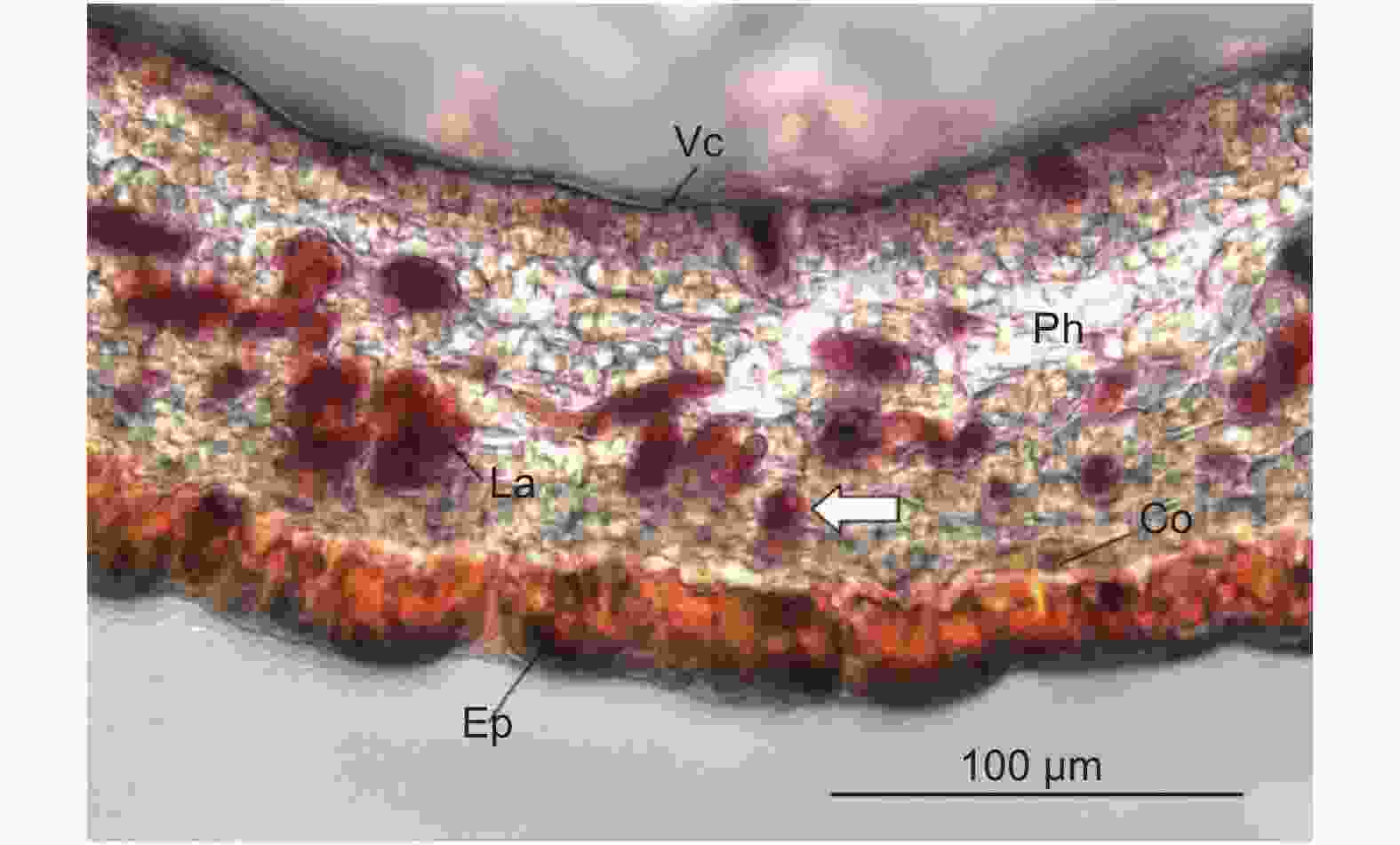
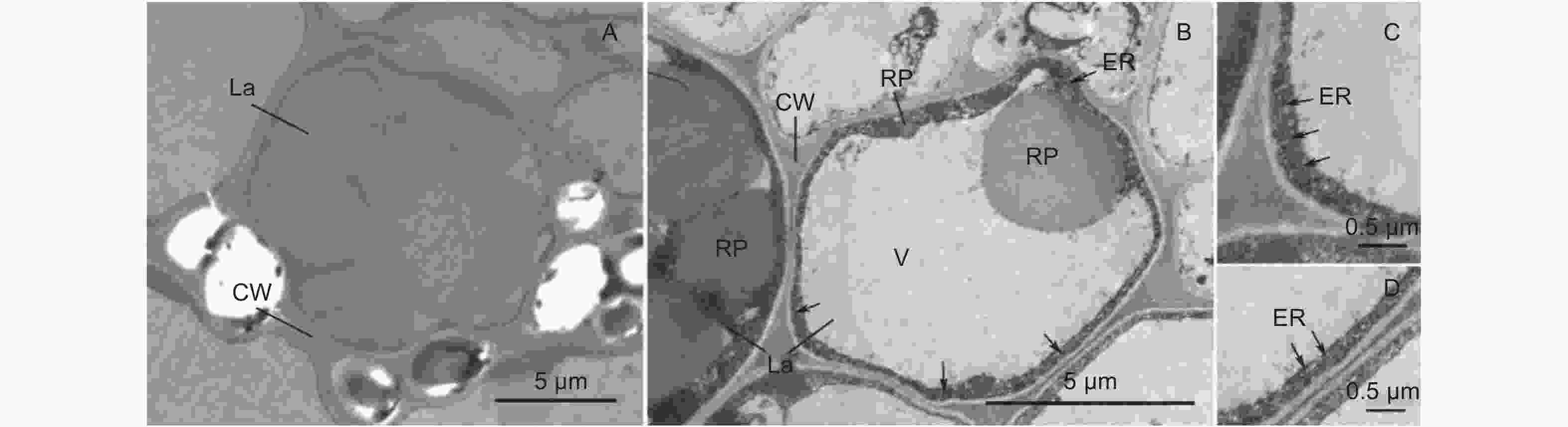
图9为杜仲叶片主脉横截面中取得含胶细胞的透射电子显微照片。反式-1,4-聚异戊二烯结构存在于含胶细胞细胞壁包裹的细胞腔之中[20]。图9A含胶细胞直径11 μm,反式-1,4-聚异戊二烯结构占据整个细胞腔截面积的94.2%。图9B中含胶细胞长9.1 μm,宽6.9 μm;含胶细胞腔截面中,液泡占据大部分面积,细胞壁内侧的细胞质基质将液泡环绕。细胞质基质中存在直径分别为3.3 μm和0.5 μm的2个明显的橡胶粒子,占细胞腔截面积的34.1%。在细胞质基质中多处存在平行于细胞壁和液泡膜的内质网(图9C、D),同时在细胞质基质中分布着许多电子致密物质。左侧紧邻的含胶细胞具有多个橡胶粒子,橡胶粒子周围存在着许多深灰色点状的电子致密物质。
-
由2.1节结果可知,杜仲茎中含胶细胞是一种两端为椭球状膨大端、中部为细长的圆柱状胞体的无分支-非铰接乳管细胞,胞体呈近似直线状或折线状,细胞整体基本与杜仲茎的轴方向平行,长度约在1 ~3 mm范围,与田兰馨等[15]对当年生杜仲嫩枝中成熟含胶细胞形态的叙述一致。研究中发现,大部分经二甲苯透明后的含胶细胞染色均一且透明,其内部无低折光率的内部结构,也无其他明显的细胞器结构(图4A、B),符合田兰馨等以薄切片法研究得到“含胶细胞成熟时,细胞器解体” [15]的结论,也符合Nakazawa等通过扫描电子显微镜发现皮层附近韧皮部的反式-1,4-聚异戊二烯呈巨大的圆柱形横截面,认为反式-1,4-聚异戊二烯结构最终会占据细胞壁包围的腔室[20]的结论,故经二甲苯透明后无内部结构的含胶细胞为成熟的含胶细胞。研究中发现,少部分经二甲苯透明后的含胶细胞膨大端中心存在折射率低于透明后含胶细胞细胞质的球状结构(图4C),另有少部分经二甲苯透明后的含胶细胞胞体内部的中线处存在折射率低于透明后含胶细胞细胞质的线状连续结构(图4D),而两类含胶细胞大部分胞质着色与成熟含胶细胞无明显差异。以往报道结果认为,成熟含胶细胞的细胞质中充斥着橡胶粒子,不含细胞器[15-20]。本研究2.1节中,含胶细胞经二甲苯透明后,二甲苯渗透后与细胞质共同组成一个有机相,该相与周围组织折射率近似;而该有机相包裹着一个折射率更低的结构相。该低折射率特殊结构相的存在,说明茎皮层内部具有成熟的外部形态的含胶细胞内部仍具有明显的特殊细胞器结构。低折射率特殊结构存在于膨大端和胞体的核心部位,故其可能与含胶细胞的细胞形态发育调控有着密切的关联。
-
由2.3节结果显示,杜仲种子萌发后,含胶细胞在子叶中产生;成熟的含胶细胞为胞体细长,两端略有形态结构略有不规则膨大端,结构连续且透明的特殊细胞。该结果与赵喜源描述杜仲叶片含胶细胞“多数含胶细胞的膨大端呈倒立水滴状,部分呈元宝状和近似圆球状”[4]一致。
根据2.3节得到的含胶细胞形态图像的发育时序对杜仲含胶细胞生成过程的细胞形态变化进行分析。图6A所示杜仲幼苗期子叶内一连串的含胶细胞早期结构,左侧为连续结构,右侧为3个互不连续的哑铃状原始细胞。图6A右侧第1个哑铃状原始细胞显著不对称,可能与原始细胞的分裂形成有关。图6A结构内部存在的这种形态差异,代表着组织结构可能是由不连续原始细胞融合后变为连续的含胶细胞。图3连贯的结构中存在10个明显的膨大节,膨大节分布密集,节间胞体长度短,与图6A和图8A结构相似,同处于含胶细胞发育早期。图3所示茎中含胶细胞早期结构中,胞体内标注的哑铃状结构右端膨大节与另一个哑铃状结构左端膨大节紧密相连,左端膨大节与另一个哑铃状结构右端膨大节同样紧密相连且在2个膨大节之间出现了较短的胞体结构,证明了哑铃状的原始细胞产生后即与相邻的原始细胞融合连接,进而在连接处产生胞体。胞体产生后不断伸长,故哑铃状结构成为细长的含胶细胞的一部分,最终无法区分。基于哑铃状原始细胞的融合现象,本研究将融合后的原始细胞哑铃状结构称之为含胶细胞的亚结构单元。哑铃状原始细胞的膨大端经过融合降级为亚结构单元的膨大节,由亚结构单元内部的胞体和亚结构单元之间的胞体相连接。图8A中杜仲幼苗期子叶含胶细胞中各亚结构单元的2个相邻膨大节的胞体长度较小,连接亚结构单元之间的胞体长度也较小。图8B中杜仲幼苗期子叶含胶细胞中仅有5个膨大节,膨大节分布稀疏,相邻2个膨大节之间的胞体长度存在显著差异;胞体一端未见明显膨大端。图8C杜仲幼苗期子叶含胶细胞除存在内部结构外,整体形态与成熟的含胶细胞相同,这时膨大节消失,膨大端形成,成熟的含胶细胞外形形成。故子叶中含胶细胞膨大端产生与成熟后期有关,这一结果与田兰馨等认为茎中含胶细胞膨大端在插入生长逐渐缓慢时形成[15]的叙述相符。基于哑铃状的原始细胞相互融合成为连续的结构后逐步发育为含胶细胞的事实,本研究认为,杜仲子叶中的含胶细胞起源于一连串哑铃状的原始细胞。
2.4节中结果显示了叶片主脉中含胶细胞的两种形态。Nakazawa等研究发现,反式-1,4-聚异戊二烯最初以棒状粒子形式在含胶细胞中合成,并随着细胞成熟而转变为纤维状结构,最终充满细胞腔[20]。基于此结果,通过对比分析含胶细胞腔截面反式-1,4-聚异戊二烯结构的面积百分比,确定细胞所处反式-1,4-聚异戊二烯积累时期并判断细胞发育的相对时序。图9A中含胶细胞腔截面的反式-1,4-聚异戊二烯结构面积为94.2%,几乎充满着截面;图9B中含胶细胞腔截面反式-1,4-聚异戊二烯结构面积为34.1%,故图9A中含胶细胞较图9B中含胶细胞成熟度更高。图9B中含胶细胞细胞质分布于细胞腔内侧并环绕着液泡;内质网在细胞质基质中平行于液泡和细胞壁分布;直径为0.5 μm的橡胶粒子被细胞质基质包裹,故橡胶粒子在细胞质基质中生成。液泡-细胞质基质-内质网-细胞质基质的细胞结构分布,可能与含胶细胞积累反式-1,4-聚异戊二烯的功能有关。
基于以上分析并结合以往文献报道,总结杜仲含胶细胞生成过程的细胞形态变化:首先在刚刚萌发的杜仲幼苗子叶中,韧皮部分生组织通过分裂方式形成一连串哑铃状的原始细胞。一连串细胞中延伸最远的哑铃状原始细胞呈非对称形态(图6A);相邻的哑铃状的原始细胞融合,融合后哑铃结构作为含胶细胞的亚结构单元存在,形成一个连续的由多个亚结构单元组成的含胶细胞早期形态,在相邻哑铃状亚结构单元融合处形成新的胞体结构(图8A、图3);在含胶细胞早期形态中,膨大节之间胞体不断不均匀径向延长,细胞开始插入生长,同时膨大节逐渐融入胞体(图8B、D、E、图2);当胞体径向延长完成,含胶细胞中的膨大节消失,膨大端出现,成熟含胶细胞的外观形成,其内部结构逐渐规则(图8C、F),橡胶粒子在细胞质基质中逐渐合成(图9B)。当含胶细胞成熟,细胞内橡胶粒子合成和积累完毕并相互融合,反式-1,4-聚异戊二烯充满整个细胞腔(图9A),细胞器解体,含胶细胞内部变得均一且透明(图7A)。田兰馨等认为,原始细胞不经融合就开始插入生长,进行胞体伸长[15];而本研究结果显示哑铃状的原始细胞首先相互融合,成为细长胞体的亚结构单元,再进行胞体伸长,最后膨大节消失,含胶细胞外形成熟。
在幼苗期子叶中发现了断续的含胶结构(图7B),同时该时期子叶中含胶细胞密度较幼苗期子叶更低。幼苗期子叶中断续的含胶结构可能是由于子叶组织内部的含胶细胞在某些酶及协同因子作用下形态发生转化,一些结构产生较大的变化或消失,最终导致含胶细胞数量下降,这种形态变化可能反映了含胶细胞的凋亡机制,与子叶作为植物幼苗发育过程能量供应来源的功能相关。
-
对杜仲茎和子叶中成熟的含胶细胞形态进行对比发现,二者均为由细长的圆柱状胞体和2个膨大端构成的无分支-非铰接乳管细胞,基本结构相同。二者存在成熟状态的细胞膨大端存在形态差异。杜仲茎中含胶细胞膨大端形态更加规则,接近椭球体;子叶含胶细胞形态更加不规则。
-
杜仲含胶细胞结构长达毫米级别且以插入方式生长,细长的细胞往往在组织空间中呈折线状分布。田兰馨等采用组织切片技术对含胶细胞发生和发育进行了研究[15],其应用组织切片技术虽然能够很好地确定细胞结构在切片平面中空间位置,进而进行分析,但本研究发现,茎中杜仲含胶细胞呈折线状分布的特性,在采用切片研究含胶细胞外部形态时,很大程度上存在无法得到完整的含胶细胞外部形态的可能。本研究以整体观察法研究易环剥、厚度适宜杜仲2年生茎皮层中的杜仲含胶细胞,取得了杜仲含胶细胞的完整外部形态图像,为后续研究提供了数据支撑。以往的含胶细胞形态研究中,在含胶组织的变性过程中均采用溴-碘-冰醋酸变性剂[11,13-19]。溴-碘-冰醋酸变性剂利用溴对橡胶双键结构进行加成反应变性橡胶,利用溴的氧化性使组织漂白和并增加组织通透性[13],但该法使用的溴单质存在剧毒、易挥发和难于称量的缺点。本研究创新以次氯酸钠溶液-盐酸变性试剂,配置简单,效果良好,安全性更佳。创新建立以次氯酸钠溶液-盐酸作为变性试剂、以苏丹III的乙醇溶液作为染色液的变性整体染色法,实现了含胶细胞的特异性染色。本研究采用二甲苯作为透明剂 [25]对茎皮样品进行整体透明,取得了茎皮层含胶细胞内部结构的整体图像。本研究创新联用变性整体染色法与冷冻切片技术,以柔软的杜仲当年生嫩茎作为材料进行切片研究,减小了制样过程影响,染色效果更好,结果图像的细节更丰富。
研究含胶细胞生成过程的细胞形态变化,需要确定含胶细胞处于何种发育时期,进而确定结构变化发生的相对时序。在成熟的杜仲组织中,由于含胶细胞发生的时刻和位置随机[15],故不能机械地按照含胶细胞所处组织空间位置来确定其发育时间的先后。要准确地确定某种植物幼苗中乳管或含胶细胞的起源方式,通常需要对种子和幼苗进行观察[26]。本研究选择杜仲的萌芽期种子子叶作为研究含胶细胞最初起源和发育过程细胞形态变化的材料,以其中含胶细胞最初形态作为起点;选择幼苗期子叶作为研究成熟含胶细胞形态的材料,以其中成熟的含胶细胞作为终点。进而在杜仲萌芽期子叶中寻找含胶细胞发育过程各时期的中间形态,从而形成完整的含胶细胞起源、发育和成熟机制的细胞形态学证据链。本研究针对种子萌芽期子叶中的脂类物质,采用次氯酸钠溶液作为漂白变性试剂并利用其碱性去除了脂类物质,有效地透明了种子萌芽期子叶,取得了清晰的含胶细胞早期结构原位观察结果。针对萌芽期子叶存在许多集束生长、缠绕度高且不利于整体观察的含胶细胞束的问题,以碱性离析法将子叶破碎,游离含胶细胞,寻找到含胶细胞发育过程各时期的中间形态。
-
杜仲茎皮层中成熟的含胶细胞是一种由细长的圆柱状胞体和近似为椭球体的2个膨大端构成的无分支-非铰接乳管细胞;透明后的含胶细胞大部分无内部结构,小部分存在低折光率的内部结构。杜仲子叶中含胶细胞起源于一连串哑铃状的原始细胞。杜仲子叶中含胶细胞生成过程的细胞形态变化过程包括:哑铃状原始细胞相互融形成含胶细胞早期形态;哑铃状亚结构单元间形成胞体,随着胞体径向延长,细胞插入生长,膨大节逐渐减少;当含胶细胞胞体径向延长完成,胞体膨大节消失,膨大端出现,成熟的含胶细胞外观形成,细胞内部结构逐渐规则;当含胶细胞成熟,细胞内橡胶粒子合成和积累完毕并相互融合,细胞器解体,反式-1,4-聚异戊二烯充满整个细胞腔,含胶细胞变得均一且透明。幼苗期子叶中断续的含胶结构可能反映了含胶细胞的凋亡机制。
致谢:北京大学分析测试中心刘佳蕙工程师;中科院中国科学院植物研究所王柏臣研究员;北京玲珑蒲公英科技发展有限公司!
Cytomorphology of Laticifer Cells in Stems and Cotyledons of Eucommia ulmoides Oliv.
- Received Date: 2022-10-05
- Accepted Date: 2022-12-30
- Available Online: 2023-06-20
Abstract:













 DownLoad:
DownLoad: