-
红桦(Betula albo-sinensis Burk.)是桦木科桦木属树种,为我国特有种,分布于陕西、甘肃、宁夏、青海、云南、四川、湖北、河北、河南、山西等地,垂直分布海拔为1000~3400 m。树高可达30 m,树皮为淡红褐色或紫红色,呈薄层状剥落,剥落树皮为纸质[1]。
红桦枝干挺拔,颜色亮丽,观赏价值高,可用于园林绿化;其独特的纸质树皮可用于工艺品制作以及包装行业,具有较高的经济价值;其木材质地坚韧,结构细密,可作优良的板材;适应能力强,亦可用做荒山造林树种,是我国北方高海拔地区重要的先锋造林树种,也是高山主要成林树种[2]。但由于20世纪70~80年代的大量砍伐,红桦原始林遭到了严重破坏,采伐后恢复起来的次生林,林分密度过大、质量不高,生产力低,各种生态和社会服务功能没有得到有效发挥,且红桦种子天然萌发对光照和昼夜温差要求较高,种子更新困难[3],因此,建立简单高效的红桦再生体系具有重要意义。
国外在桦树组织培养方面先后建立了纸桦(B.papyrifera Marshall)[4]、日本白桦(B. platyphylla var. Japonica)[5]、垂枝桦(B. pendula Roth.)[6]等桦树的组培再生体系;我国从20世纪70年代开始,亦已进行了白桦(B. platyphylla Suk.)[7]、光皮桦(B. luminifera H.Wink.)[8]、西南桦(B. alnoides Buch Ham.ex D.Don)[9]、裂叶垂枝桦[10]等桦木组织培养体系研究。
由于国内对于红桦组织培养方面的研究尚无,故本研究通过器官发生途径建立高效稳定的红桦组织培养技术体系,以期为红桦良种选育、定向培育及遗传转化等方面的研究提供理论支持,为高海拔地区荒山红桦造林提供技术支持,同时也可填补红桦无性繁殖研究方面的空白。
HTML
-
分别于2017年冬季至2018年早春在陕西省宁陕县火地塘林场,采集生长健壮、无病虫害的红桦带休眠芽枝条,选取饱满休眠芽,剥去外层芽鳞,剩余内部长约0.5 cm的芽尖,基部连带1~2 mm长的茎段,置于大烧杯中,用纱布封口后,自来水冲洗1~2 h。
-
将休眠芽在超净工作台上先用70%酒精消毒30 s,接着用无菌水冲洗4~5次,再用0.1% HgCl2 分别灭菌4、6、8、10、12 min,用无菌水冲洗5~6次,消毒过程中轻微地摇晃灭菌容器。处理完成后接种在不添加任何激素的WPM培养基上。每个处理接种20瓶,每瓶接种1个外植体,共重复3次,接种15 d后统计外植体污染率和萌发率。
-
以WPM为基本培养基,同时添加浓度为0.8、1.0、1.2、1.5、1.8、2.0 mg·L−1的6-BA和0.1、0.2 mg·L−1的NAA及0.01、0.02 mg·L−1的IBA。接种灭菌后的休眠芽,每个处理接种10瓶,每瓶接种1个外植体,共重复3次,培养3~4周后统计外植体萌发情况。
-
初代培养得到的不定芽长到3~5 cm时,剪成长约1 cm的带芽茎段进行增殖,增殖培养基为WPM基本培养基附加浓度为0.5、1.0、1.5、2.0 mg·L−1的6-BA和0.01、0.02、0.05 mg·L−1的NAA,每个处理接种15瓶,每瓶接种2个外植体,共重复3次,培养40 d后统计芽苗增殖系数、增殖苗健康指数。
-
选取生长健壮、叶色浓绿、高约5 cm无根单苗进行生根培养。分别以WPM、MS、1/2 MS为基本培养基,添加蔗糖20、25、30、35 g·L−1,附加浓度为0.4、0.5、0.8、1.0 mg·L−1的IBA。每个处理接种20瓶,每瓶接种1个外植体,共重复3次,接种后定期观察、记录生根时间,培养25 d时统计生根条数,计算生根率、生根指数、根健康指数。
-
选用生根培养25 d后生长健壮、叶色鲜绿、根系发育良好的组培苗进行炼苗移植,先将组培苗取出培养室,让其带盖适应温室环境5 d,第6天开始逐渐开盖,第8天完全开盖后再存放5 d。后用清水冲洗干净组培苗根系附着的培养基,移植于装有混合基质(国产泥炭:国产水苔:腐殖质体积比为1:4:1)的营养钵中。移植后每天喷水4~6次,保持小环境湿度在90%以上,温度控制在20~25℃,21 d后统计成活率及生长状况。
-
若无特别说明,所有培养基均添加蔗糖30 g·L−1、琼脂7 g·L−1,pH调至5.8,高温(121℃)高压灭菌20 min,培养温度为(25 ± 2)℃,光周期16 h/8 h,光照强度36 μmol·m−2·s−1。
增殖系数 = 增殖芽数/接种芽数
增殖苗健康指数 = 增殖苗生长状况值之和/增殖苗总数(增殖苗生长状况划分为“3”、“2”、“1” 3个级别,其中,“3”表示芽苗生长健壮、茎干粗壮、叶片大且鲜绿;“2”表示生长较健壮、黄叶较少、无玻璃化;“1”表示生长一般、叶片小而卷曲、存在部分黄叶茎干稍细弱)。
根健康指数 = 根系生长状况值之和/生根苗总数(根系生长状况划分为“3”、“2”、“1” 3个级别,其中,“3”表示根粗细适中不易断裂,长度适中,有大量须根;“2”表示根较粗壮易断裂,有少量须根;“1”表示根较细弱,无须根)。
生根指数 = 生根率 × 平均根长 × 平均生根数
使用SPSS软件对所统计数据进行方差分析(ANOVA)和显著性检验,显著水平为P < 0.05。
1.1. 试验材料的获得及预处理
1.2. 试验方法
1.2.1. 0.1%HgCl2灭菌时间对无菌外植体获得的影响
1.2.2. 激素组合对休眠芽萌发的影响
1.2.3. 激素组合对增殖的影响
1.2.4. 基本培养基类型、IBA及蔗糖浓度对不定根诱导的影响
1.2.5. 炼苗移植
1.2.6. 培养条件与数据统计分析
-
高污染率、褐化死亡率及低萌发率极大地限制了植物组织培养体系的建立。由表1可以看出:灭菌剂处理时间不同,外植体接种后生长状态不同;随着0.1% HgCl2处理时间的延长,外植体的污染率呈现逐渐降低的趋势,但与此同时,由HgCl2自身引起的外植体褐化程度也逐渐加剧,当处理时间为8 min时,除去褐化及污染的影响,外植体萌发率达到所有处理中最高值,为60%。因此,综合上述3个指标,筛选出最适宜红桦外植体消毒灭菌的方法为:先用70%酒精消毒30 s,无菌水冲洗3~4次,然后用0.1% HgCl2消毒8 min,无菌水冲洗5~6次。
试验号
Test number灭菌时间/min
Sterilization time外植体数/个
Number of explants污染率/%
Pollution rate褐化死亡率/%
Browning mortality rate萌发率/%
Germination rateA1 4 60 51.7 ± 0.19a 6.7 ± 0.09a 41.7 ± 0.15a A2 6 60 45.0 ± 0.22b 15.0 ± 0.31ab 40.0 ± 0.18a A3 8 60 15.0 ± 0.25c 25.0 ± 0.27b 60.0 ± 0.32b A4 12 60 13.3 ± 0.17c 58.3 ± 0.19c 28.3 ± 0.44a 注:表中数据为平均值 ± 标准差,不同小写字母表示不同处理间差异显著(p < 0.05),下同。
Notes: The data in the table are the mean ± standard deviation, and different lowercase letters indicate significant differences between different treatments (p < 0.05), the same below.Table 1. Effects of 0.1% HgCl2 sterilization time on the acquisition of sterile explants
-
初代培养结果(表2)表明:不同激素组合对休眠芽的萌发以及生长状态影响不同;当添加一定浓度的NAA时,随着6-BA浓度的增加,外植体的萌发率总体呈先上升后下降的趋势,当NAA浓度为0.1 mg·L−1、6-BA浓度为1.5 mg·L−1时,外植体萌发率达到最高,为83.33%,且此时外植体生长状态最佳,休眠芽在培养1周左右时开始萌发,叶片全部展开后茎也逐渐开始伸长生长;而当6-BA浓度一定时,NAA浓度升高,外植体萌发率逐渐下降,外植体生长状态无明显变化,当NAA浓度为0.2 mg·L−1时,所有处理下的外植体均不产生茎,平均萌发率也较添加0.1 mg·L−1 NAA时下降了10.61%。休眠芽初代培养过程中最主要的问题是只萌发展叶而不伸长生长,这样状态的外植体无法用于增殖以及生根培养。初代培养所有试验中,只有B4和B5处理下,外植体产生了茎,但B5诱导产生的茎较细弱,且叶片出现黄化现象,综合考虑,红桦休眠芽初代培养最佳激素配比组合为1.5 mg·L−1 6-BA+0.1 mg·L−1 NAA。
试验号
Test number植物生长调节剂浓度/(mg·L−1)
Concentration of plant growth regulator外植体数/个
Number of explants萌发率/%
Germination rate外植体生长状态
The growth state of the explants6-BA NAA IBA B1 0.8 0.1 0 30 53.33 ± 0.65 abc 基部无愈伤,无茎,叶皱缩 B2 1.0 0.1 0 30 56.67 ± 0.91 abc 基部无愈伤,无茎,叶破损发黄 B3 1.2 0.1 0 32 62.50 ± 0.34 abc 基部无愈伤,无茎,叶正常 B4 1.5 0.1 0 30 83.33 ± 0.55 d 基部有褐色疏松愈伤,茎健康,叶鲜绿 B5 1.8 0.1 0 28 71.43 ± 0.67 cd 基部有米黄色疏松愈伤,茎细弱,叶发黄 B6 2.0 0.1 0 28 72.41 ± 0.39 cd 基部有米黄色疏松愈伤,无茎,叶蜷曲发黄 B7 0.8 0.2 0 30 46.67 ± 0.44 abc 基部无愈伤,无茎,叶黄化 B8 1.0 0.2 0 32 56.25 ± 0.43 abc 基部无愈伤,无茎,叶破损发黄 B9 1.2 0.2 0 31 67.74 ± 0.58 bcd 基部有绿色紧实愈伤,无茎,叶黄化 B10 1.5 0.2 0 31 64.51 ± 0.71 bc 基部有绿色愈伤,无茎,叶皱缩 B11 1.8 0.2 0 29 62.07 ± 0.66 abc 基部有米黄色疏松愈伤,无茎,叶蜷曲发黄 B12 2.0 0.2 0 30 60.00 ± 0.80 abc 基部有米黄色疏松愈伤,无茎,叶黄化 B13 1.5 0.1 0.02 30 43.33 ± 0.63 a 基部产生绿色愈伤,无茎,叶正常 B14 1.5 0.1 0.05 30 50.00 ± 0.57 ab 基部产生绿色愈伤,无茎,叶正常 Table 2. Effects of plant growth regulators on primary culture
-
将红桦带芽茎段接种到含有不同激素配比的增殖培养基中,培养约7 d茎段基部开始分化出芽点,周围产生绿色愈伤组织。培养40 d后的统计结果(表3)表明:增殖系数以及增殖苗健康指数均随6-BA浓度的升高呈先上升后下降的趋势,当6-BA浓度为1.5 mg·L−1时,增殖系数较1.0、2.0 mg·L−1浓度分别高出66.54%、62.37%,健康指数分别高出64.18%、46.67%,增殖情况最佳;随着NAA浓度增加,增殖系数和健康指数的变化趋势也表现为先上升后下降,在浓度为0.02 mg·L−1时,平均增殖系数为3.73,平均健康指数为1.75,均达到3个浓度处理中最高值。因此,红桦增殖培养最佳植物生长调节剂配比为1.5 mg·L−1 6-BA+ 0.02 mg·L−1 NAA,此处理下红桦增殖系数达到4.77,健康指数达到2.45。
试验号
Test number植物生长调节剂浓度/(mg·L−1)
Concentration of plant growth regulator增殖系数
Proliferation coefficient健康指数
Health index6-BA NAA C1 1.0 0.01 2.56 ± 0.15ab 1.28 ± 0.13a C2 1.0 0.02 3.04 ± 0.12ab 1.24 ± 0.09a C3 1.0 0.05 2.57 ± 0.32ab 1.51 ± 0.22a C4 1.5 0.01 4.45 ± 0.21ab 2.16 ± 0.32a C5 1.5 0.02 4.77 ± 0.18a 2.45 ± 0.14a C6 1.5 0.05 4.37 ± 0.22ab 1.99 ± 0.25a C7 2.0 0.01 2.67 ± 0.41ab 1.64 ± 0.23a C8 2.0 0.02 3.39 ± 0.24ab 1.55 ± 0.16a C9 2.0 0.05 2.30 ± 0.21b 1.32 ± 0.26a Table 3. Effects of plant growth regulators on the proliferation culture
-
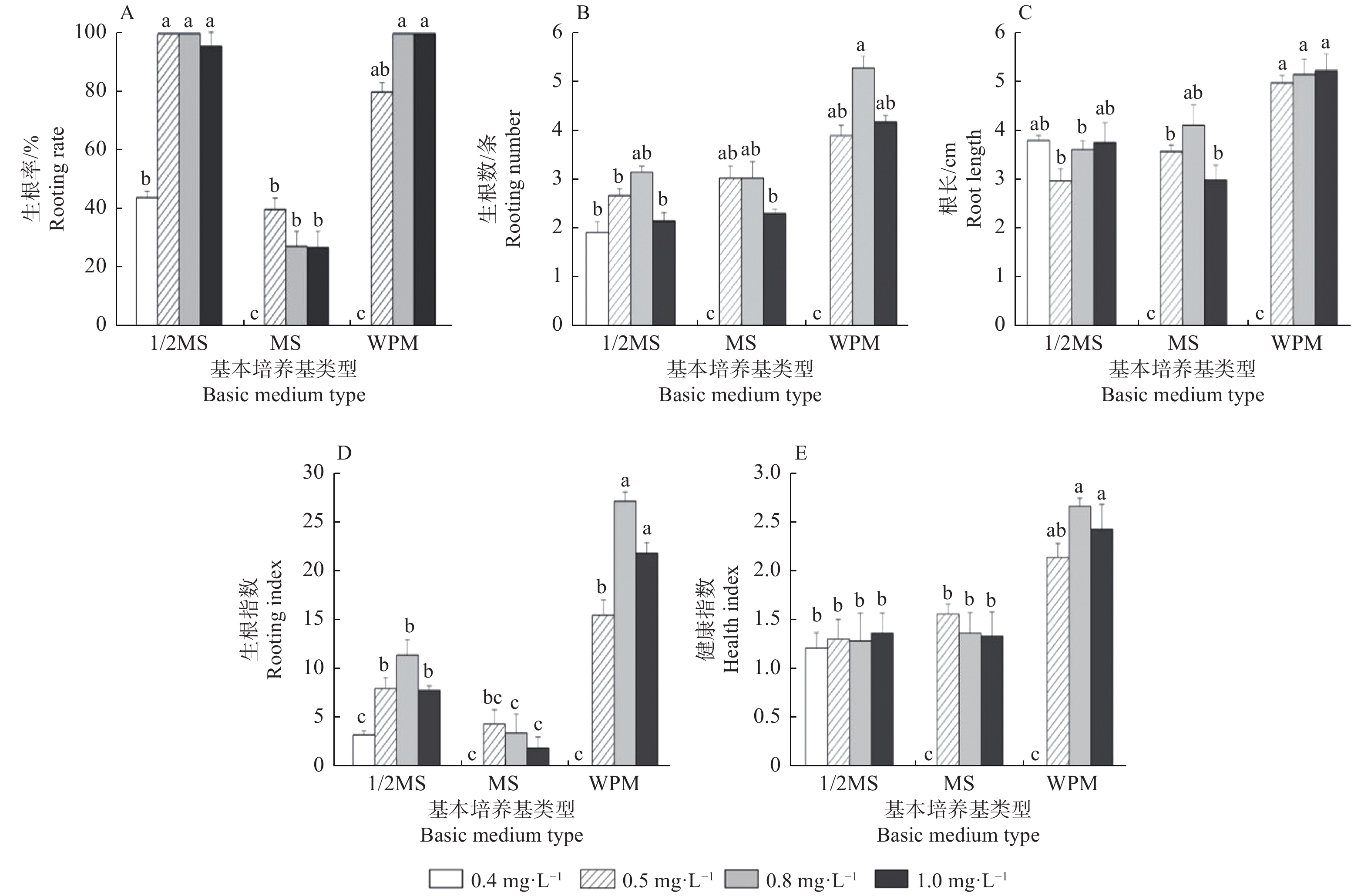
生根培养约7 d,外植体基部可见嫩根生出,生根培养过程中也伴随着壮苗效果,组培苗的长 势逐渐变好,茎变粗,叶片变大且颜色由淡绿变为翠绿。培养25 d不同基本培养基以及不同浓度IBA对生根的影响见图1,3种不同基本培养基下的平均生根率(图1A)高低次序依次为:1/2 MS >WPM > MS,1/2 MS培养下的平均生根率为84.9%, 为MS培养的2.6倍;虽然1/2 MS培养下红桦生根率最高,但其平均生根条数(图1B)、根长(图1C)、生根指数(图1D)均小于WPM培养下生根苗的相应指标,分析根健康指数(图1E),WPM培养下根健康指数平均为1.77,高于另外2种基本培养基,生根苗也更易移植成活,因此,红桦最佳生根基本培养基为WPM。

Figure 1. Effects of basic medium type and IBA concentration on the induction of adventitious roots of Betula albo-sinensis
不同浓度IBA处理的平均生根率高低次序为:0.8>1.0>0.5>0.4 mg·L−1,分别为75.8%、74.2%、73.3%、14.67%,可看出IBA浓度与生根率先呈正相关,在0.8 mg·L−1时生根率达最高值,而当浓度升至1.0 mg·L−1时,生根率则有所下降。综合考虑生根率及无根单株生根状态,即生根数、根长、健康指数及生根指数,得出以WPM为基本培养基,附加0.8 mg·L−1 IBA时生根效果最佳,此处理下生根率达到100%,健康指数也高达2.61。
蔗糖浓度对生根培养的影响见表4,生根率随蔗糖浓度的升高而逐渐增加,当浓度超过25 g·L−1时,各处理间的差异并不显著。在浓度为30、35 g·L−1时均达到了100%的生根率,但在30 g·L−1蔗糖的处理下,平均生根条数、根长、生根指数、健康指数均高于35 g·L−1的处理,表明红桦生根培养添加最适蔗糖浓度应为30 g·L−1。
试验号
Test number基本培养基
Basic medium蔗糖浓度/(g·L−1)
Concentration of Sucrose生根率/%
Rooting rate平均生根数/条
Mean rooting number根长/cm
Root length生根指数
Rooting index健康指数
Health indexE1 WPM 20 72 ± 3.09 b 3.06 ± 0.21 b 4.21 ± 0.40 a 9.28 ± 0.62 b 2.11 ± 0.15 a E2 25 96 ± 2.54 a 3.25 ± 0.19 ab 4.52 ± 0.29 a 14.10 ± 0.84 a 2.17 ± 0.09 a E3 30 100 ± 0.00 a 4.24 ± 0.35 a 5.01 ± 0.33 a 21.62 ± 0.66 a 2.44 ± 0.22 a E4 35 100 ± 0.00 a 3.84 ± 0.31 ab 4.33 ± 0.25 a 16.63 ± 0.58 a 2.20 ± 0.27 a Table 4. Effects of sucrose concentration on rooting culture
-
组培瓶苗移植第2天开始原有叶片开始逐渐萎蔫掉落,第7天开始从侧芽处萌发新叶,第14天左右结束缓苗,植株长势逐渐恢复,叶片逐渐变大且颜色变翠绿,茎也变粗壮且逐渐木质化,21 d统计移植成活率为83.9%。
2.1. 0.1% HgCl2对无菌外植体获得的影响
2.2. 激素组合对休眠芽萌发的影响
2.3. 激素组合对增殖的影响
2.4. 基本培养基类型、IBA及蔗糖浓度对不定根诱导的影响
2.5. 炼苗移植
-
无菌外植体的获得是植物组织培养无菌体系建立的第一步,选择合适的消毒灭菌方法对组织培养研究具有重要意义[11-12]。郭军战等[13]通过对四倍体刺槐的研究,发现用茎段作外植体时,用0.1% HgCl2灭菌10 min效果最好,而本研究用红桦休眠芽做外植体,得出用0.1% HgCl2处理8 min时灭菌效果最佳,当灭菌时间为10 min时,外植体污染率无显著变化而萌发率却显著降低。这可能是因为外植体类型及状态有所不同,剥去芽鳞的休眠芽比茎段更脆弱,长时间接触灭菌剂会造成外植体损伤而降低萌发率。不同外植体的适宜消毒灭菌方法不尽相同,灭菌剂的选择需要根据外植体的大小与坚硬程度等决定,其成分及处理时间会对外植体产生不同的灭菌效果,灭菌时间过短会灭菌不彻底,导致外植体出现污染,而灭菌时间过长则会损伤外植体,引起外植体的褐化死亡现象。
增殖培养的效果好坏是大规模快繁体系建立的关键[14],细胞分裂素与生长素的合理使用可促进芽苗增殖。他人研究发现,适宜白桦、垂枝桦、西南桦增殖培养的植物生长调节剂配比分别为1.0 mg·L−1 6-BA+0.05 mg·L−1 NAA、0.75 mg·L−1 6-BA+0.75 mg·L−1 KT+0.1 mg·L−1 NAA、0.5 mg·L−1 6-BA+0.01 mg·L−1 NAA[15-17]。本研究得出最适宜红桦增殖的激素配比为1.5 mg·L−1 6-BA+0.02 mg·L−1 NAA。可见,桦木科树种增殖培养所用激素多为6-BA与NAA,且前者常用浓度为0.5~1.5 mg·L−1,后者则为0.01~0.1 mg·L−1,垂枝桦的增殖培养虽然使用了6-BA和KT两种细胞分裂素,但其总量仍未超过1.5 mg·L−1。此外,本研究发现,随着6-BA和NAA浓度的增加,增殖系数、增殖苗健康指数均呈先上升后下降的趋势,两类激素浓度过高或过低虽在一定程度上可使芽苗数量增加,但增殖系数与增殖苗健康指数均不佳,增殖苗不适用于生根培养。不同桦树增殖苗质量随着激素浓度变化呈现不同的变化趋势,细胞分裂素与生长素的最佳比例需在具体研究过程中进行不断试验。
外植体是否生根决定了组培快繁体系建立的成败[18],影响生根培养的因素主要有基本培养基、激素浓度与配比、蔗糖、琼脂等附加物的浓度、培养条件等[19]。一般用于生根培养的培养基有1/8 MS、1/4 MS、1/2 MS、MS、WPM等,而生根率一般随着培养基盐浓度的降低而升高,但浓度过低则会无法满足组培苗生根的营养需求[20-21]。本研究发现,红桦生根培养效果为WPM > 1/2 MS > MS。张丽杰等[22]通过对欧洲垂枝桦生根的研究也得出了相同的结论,虽然1/2 MS培养下红桦生根率与WPM培养下无显著性差异,但所生根质量不高,根粗壮、易断裂、须根少,而WPM培养下所生根粗细适中不易断裂,长度适中,有大量须根,更适宜于炼苗移植,这可能是因为WPM培养下组培苗基部形成的愈伤组织较少,使得所生根与维管束联系更紧密,地上部分长势更好,移植成活率高。除去基本培养基,生长素IBA在多种植物不定根的诱导起到较好的作用[23]。本研究表明,当添加IBA浓度小于1.0 mg·L−1时,其浓度与生根效果呈正相关,而当浓度达到1.0 mg·L−1时,生根率、生根指数、健康指数均有所下降,最适于生根培养的浓度为0.8 mg·L−1,这与黄永伟等[24]对文冠果生根因素研究结果相同,IBA虽然对不定根的产生有促进作用,但浓度过高则会起到抑制作用。
一切植物组织都不能在没有碳水化合物的条件下生长,碳水化合物的作用是作为碳源和渗透压稳定剂,一般植物组织培养在以蔗糖为碳源的培养基中[25-26]。魏爽[27]研究结果表明,在蔗糖浓度为30 g·L−1时,辽东栎的根长势较好,而在浓度为20 g·L−1时,根系虽健壮,但苗的长势弱,叶片发黄。本研究试验了20、25、30、35 g·L−1蔗糖对红桦不定根诱导的影响,结果也表明,当添加30 g·L−1蔗糖时,对生根培养起到有效的促进作用;而詹亚光等[28]对白桦的相关研究则表明,蔗糖浓度对白桦组培苗生根率影响不显著。不同植物的生长特性导致其生长所需蔗糖量不同,通过上述研究结论对比可知,辽东栎与红桦生根过程对蔗糖的需求量相近,当蔗糖浓度过低时,植物无法获得生长所需碳源而生长不良,过高则会导致培养基渗透压过高影响外植体的正常生长;而白桦的研究结论则可能是因为其试验是在添加了0.2 mg·L−1 IBA的条件下进行的,IBA对生根的影响程度更大,蔗糖浓度在一个适宜的范围内并不会对生根率造成明显影响。
-
通过对红桦组织培养各个阶段进行试验,最终建立了完整的红桦器官发生途径再生体系,培养过程见图2,即以红桦休眠芽为外植体,先用70%酒精消毒30 s,无菌水冲洗3~4次,然后用0.1% HgCl2消毒8 min,无菌水冲洗5~6次获得无菌材料,初代培养最适宜激素配比为WPM +1.5 mg·L−16-BA+0.1 mg·L−1 NAA;增殖培养最佳配比为WPM +1.5 mg·L−16-BA+0.02 mg·L−1 NAA;生根培养最佳配比为WPM +0.8 mg·L−1 IBA,所有培养基配比均附加30 g·L−1蔗糖与7 g·L−1琼脂;生长良好组培苗移植于装有混合基质(国产泥炭∶国产水苔∶腐殖质体积比为1∶4∶1)的营养钵中,21 d统计移植成活率为83.9%。此体系可为红桦良种选育、定向培育、遗传转化等研究奠定重要基础。




 DownLoad:
DownLoad:
