-
细菌可以引起植物、动物以及人类严重的病害,在其侵染过程中,主要通过多种分泌系统以完成与宿主之间的互作[1-2]。其中,Ⅵ型分泌系统(T6SS, Type VI secretory system)可以通过释放效应蛋白至邻近靶细胞,包括对于宿主的攻击性和种间竞争的防御性等作用[3]。此外,T6SS还具有参与生物被膜形成等能力[4],在细菌的营养竞争、生存定殖、侵染宿主致病等过程中发挥着重要作用[5]。
有关T6SS的研究可以追溯至1996年,当时,学者对霍乱弧菌(Vibrio cholerae)中一个缺乏可识别信号肽的序列HCP(Hemolysin Coregulated Protein)横跨细胞内外膜分泌蛋白开展研究,明确其对病原细菌的毒力、定殖能力以及环境适应性等有重要影响[6]。2006年,Pukatzki等人发现除HCP外,V. cholerae中的VgrG蛋白同样存在胞外输出现象,然而,其均不含信号肽且与T3SS或T4SS并不相同,因此,首次提出了T6SS概念[7]。此后,2012年《Nature》论文系统阐述了T6SS分泌模型,即一个通过独特的基座结构与内膜相连,往复于延伸或收缩构象的长管外包弹簧状结构鞘(主要由HCP、TssB/C组成),保持在组装、快速收缩、释放、拆卸和重新组装之间循环[8],与T4噬菌体类似,基座结构将收缩信号传递给鞘,并且拥有保守的触发机制[9]。通常细菌基于T6SS系统以接触依赖性传输毒性蛋白,诸如肽聚糖酶[10]、磷脂酶[11]、ATP酶等效应子[12],面对营养压力时通过T6SS将其输送至竞争细胞,从而导致靶细胞死亡。
学术界关于细菌中T6SS的研究多以铜绿假单胞菌(Pseudomonas aeruginosa)为主[13],而有关植物病原细菌T6SS的研究,最早见于2010年关于梨火疫病菌(Erwinnia amylovora)[14]的报道。鉴于丁香假单胞菌(Pseudomonas syringae)[15]、青枯雷尔氏菌(Ralstonia solanacearum)[16]、根癌农杆菌(Agrobacterium tumefaciens)[17]、梨火疫病菌[18]、稻生黄单胞菌(Xanthomonas oryzae pv. oryzicola, Xoc)[19]等5种植物病原细菌对农林业生产危害的严重性,有关上述细菌T6SS的调控机制[20]、作用机制[18]以及结构功能[21]等研究报道逐年增加。然而,尚未见不同植物病原细菌中T6SS的系统性对比分析报道。因此,本研究以前人研究成果为基础,对上述植物病原细菌中T6SS蛋白的数量、种类、遗传分类以及结构功能进行综述,以期明确不同植物病原细菌中T6SS在其功能蛋白及遗传关系等方面存在的差异性,并指出了T6SS研究中存在的一些问题。
-
T6SS主要存在于革兰氏阴性细菌中[6,22],以P. aeruginosa为例,典型的T6SS装配结构与噬菌体尾部穿膜结构类似[23-24],存在于内外膜组织之间,是基于细胞接触依赖性的多组件跨膜通道。笔者利用美国国立卫生院(NCBI)数据库,对5种植物病原细菌(P. syringae、R. solanacearum、A. tumefaciens、E. amylovora、Xoc;登录号分别为:GCF_016694755.2、GCF_001587155.1、GCF_003667905.1、GCF_000091565.1、GCF_001021915.1)中共138个T6SS蛋白序列进行搜索下载、整理,利用蛋白保守结构域分析软件SMART[25]进行预测分析,发现19种T6SS蛋白存在于5种细菌中,且不同种细菌拥有蛋白的类别与数量不尽相同,具有一定多样性。同时,除VgrG的蛋白序列长度在不同细菌之间差异较大,为296~917 aa,其余同种T6SS蛋白之间长度差别相对较小,具有一定保守性(图1)。T6SS蛋白种类主要包括跨膜复合体TssM(ImcF)、TssJ(SciN)、TssL(DotU);基座亚基TssE(GPW_gp25)、TssF、TssG、TssK(VasE);弹簧状伸缩鞘大亚基TssC(VipB)、小亚基TssB(VipA)、管状蛋白HCP;尖端效应子结合蛋白VgrG(Phage_GPD);装卸辅助蛋白TssA(ImpA_N);调控蛋白TagF(DUF2094)、TagH(FHA)、TssH(Clp_N);酰胺酶效应蛋白Tae4、酰胺酶免疫蛋白Tai4。此外,E. amylovora与Xoc分别独有IcmF(Vask)、CagE_TrbE_VirB等结构域的T6SS分泌蛋白(蛋白ID分别为WP_004160264.1、WP_047340360.1)。通过对T6SS蛋白结构域进行解析,明确不同病原细菌具有相似的T6SS蛋白组成、不同的蛋白数量以及部分物种特有的结构域,与前人明确R. solanacearum中HCP、VgrG蛋白的三级结构分别与P. aeruginosa、大肠杆菌(Escherichia coli)的HCP、VgrG相似等结果类似[26]。
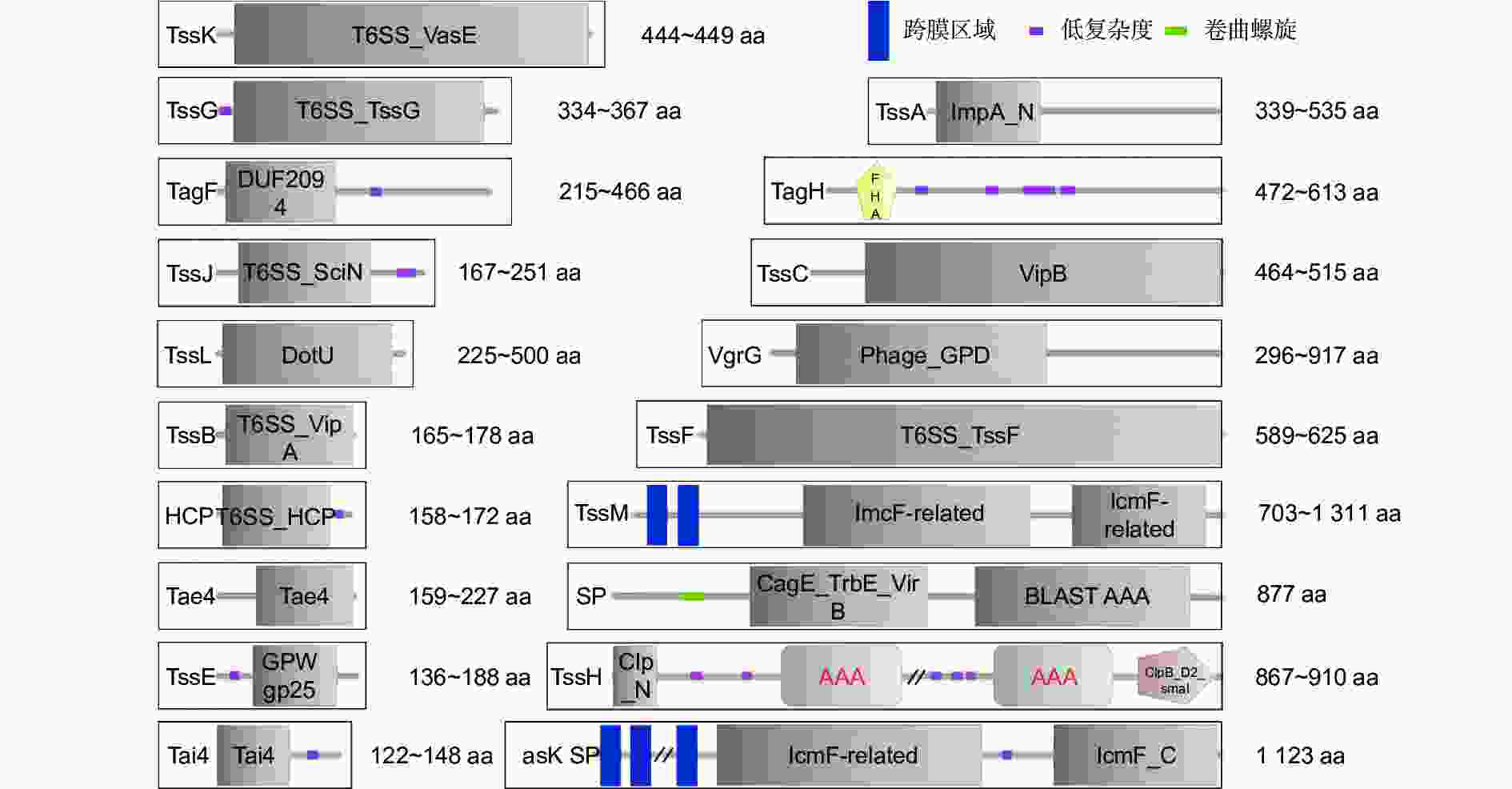
图 1 T6SS在5种不同植物病原细菌中的相关蛋白保守结构域种类情况
Figure 1. Conserved domains of T6SS related proteins in five different plant pathogenic bacteria
具体而言,VgrG是一个三聚体状的尖端效应子结合蛋白,是对靶细胞执行毒性功能的核心蛋白[27],在5种植物病原细菌中均具有较多的数量(表1);TssM/J/L是一个跨内外膜复合体结构,是效应子等蛋白的膜运输通道[28];TssE/F/G/K是一个锚定于内膜并链接TssM/J/L结构的漏斗状复合体基座,用以VgrG蛋白的识别与吸附[29];HCP是一个管状蛋白,当T6SS开始装配时,其一端依附于VgrG,行使VgrG等尖端蛋白受力功能[16];TssB/C是一个空心弹簧状蛋白复合体,包裹于HCP外侧,是VgrG与HCP等结构被执行推力的来源[28];TssA是一个T6SS装卸辅助识别蛋白,当T6SS开始装配时,其一侧可分别粘连VgrG、TssB/C和HCP,并有序进行组装[30];TssH属于AAA + ATP酶超家族和ClpV亚家族,主要在TssB/C鞘收缩释放T6SS效应子过程中起作用[31];TagF通过与TagH相互作用来调节T6SS效应子的分泌过程[32];Tae4作为效应子参与细菌竞争中对目标细菌肽聚糖和膜脂的侵蚀;Tai4作为免疫蛋白用于抵御Tae4,它们与VgrG基因编码相关联。上述蛋白具有不同的功能,使T6SS在不同环境下执行多种生存策略,分泌多种效应蛋白,从而在结构域之间以及结构域与效应子之间具有相互紧密配合的特点,进而适应多变的细胞环境。
表 1 5种不同植物病原细菌所包含T6SS相关蛋白情况对比
Table 1. Comparison of T6SS related proteins in five different plant pathogenic bacteria
蛋白 Protein P. syringae R. solanacearum A. tumefaciens E. amylovora Xoc 合计 Total VgrG 6 6 1 5 2 20 TssM 2 1 1 2 2 8 TssJ 2 1 0 3 1 7 TssL 0 0 1 2 0 3 TssE 2 1 1 2 2 8 TssF 2 1 1 2 2 8 TssG 2 1 1 2 2 8 TssK 2 1 1 2 2 8 HCP 7 1 1 2 2 13 TssB 2 1 1 2 2 8 TssC 2 1 2 2 2 9 TssA 2 1 1 3 2 9 TssH 2 1 1 2 2 8 TagF 1 1 1 2 2 7 TagH 0 0 0 2 1 3 Tae4 1 1 1 1 0 4 Tai4 2 1 0 2 0 5 VasK SP 0 0 0 1 0 1 CagE SP 0 0 0 0 1 1 合计 Total 37 20 15 39 27 138 一般而言,T6SS中的TssM/J/L、TssE/F/G/K分别被组装成跨膜通道和基座复合体[8],随后TssB/C弹簧鞘的收缩推动HCP管、VgrG突刺和效应子并通过T6SS跨膜通道离开细胞,进入细胞外环境或附近的另一个细胞[33](图2),毒性效应子发挥作用从而导致靶细胞生长抑制或死亡[10-11]。
-
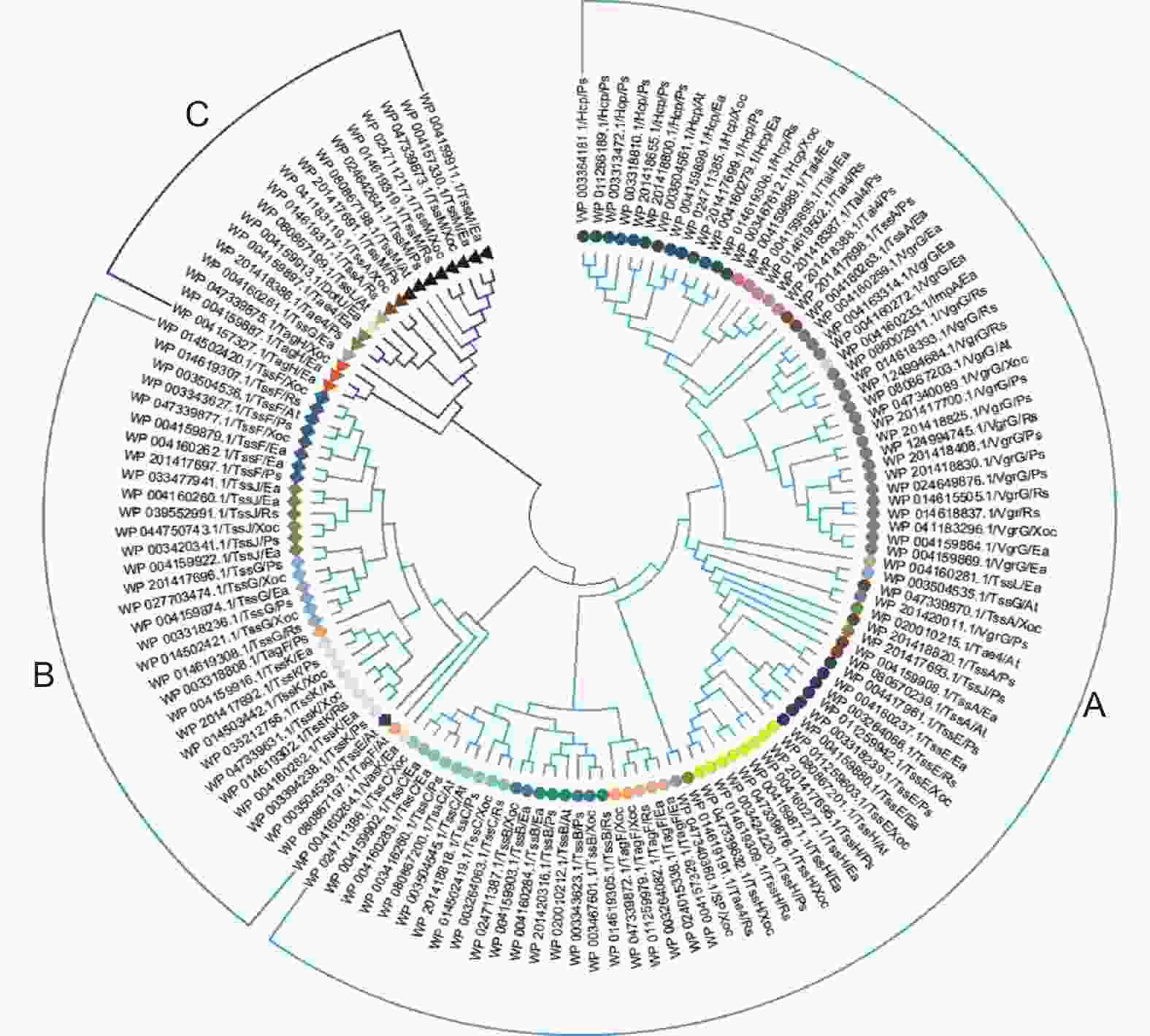
基于MEGA11软件并根据序列同源性对上述5种植物病原细菌中138个T6SS蛋白进行遗传关系分析,明确其可以分为3个亚家族,分别命名为A、B、C,其中TssB、TssC、TssH、Tai4等蛋白聚为A类,而TssF、TssK等聚为B类,TssM、TagH聚为C类(图3)。在遗传关系方面,一些蛋白同时存在于上述两种或3种亚家族中,如TssE、TssJ、TagF等蛋白存在于A、B两大类中;TssA、TssL、Tae4存在于A、C两大类;TssG在A、B、C类中则分别存在1、6、1个蛋白,其中A类中仅包含A. tumefaciens的TssG,C类中仅包含E. amylovora的TssG,这一现象与T6SS基因可以通过水平转移所获得的特性相一致[34],又或许是单菌种具有多个T6SS基因簇导致,例如,P. aeruginosa携带H1、H2和H3-T6SS 3个基因簇[22,35],而V. cholerae只携带一个[7]。对上述病原细菌T6SS蛋白结构域进一步预测分析,显示C类中A. tumefaciens的TssL包含OmpA结构域(蛋白ID为WP_080867199.1),不同于A类中E. amylovora的TssL,其余蛋白聚类差异均与其保守结构域无关。HCP与VgrG聚为一类,说明HCP与VgrG具有一定的共进化特性[36]。
-
植物病原细菌通过T6SS中VgrG绑定毒性效应子(细胞壁降解酶、核酸酶、膜穿孔蛋白、磷脂酶和NADase等)传递至邻近宿主细胞,通常在寄主组织内大量定殖,引起寄主细胞质壁分离、细胞器降解等,以达到营养汲取的目的[4]。当前,已经明确P. syringae、R. solanacearum、E. amylovora等细菌中有较多T6SS蛋白参与侵染宿主植物的过程。P. syringae可以对豆科、茄科、蔷薇科以及十字花科等300多种经济作物致病,是当前变种最多的植物病原细菌之一。前人对P. syringae中T6SS参与侵染过程的研究多集中于TssM、TssJ蛋白以及RetS、LadS和GacS/GacA调控途径。就其蛋白功能而言,当TssM、TssJ沉默时该菌致病性分别下降了78.7%和71.3%,同时伴随生物膜形成与蛋白水解能力下降,然而其胞外多糖的分泌及运动性不受影响,并且存在突变复原现象[37],推测TssM、TssJ影响了P. syringae的自身保护膜而未参与鞭毛膜的形成,并且发生了基因水平转移,从而导致突变失效;就其调控方式而言,T6SS与T3SS可以共同被(P)ppGpp、RetS和LadS调控表达并影响细胞运动[38],其中RetS负向控制粘液性,LadS负向调节成群运动[39];此外,低温和植物免疫物质也会影响T6SS基因的表达,且该过程受GacS/GacA双组分系统的调控[40]。
R. solanacearum可以侵染茄科、豆科等双子叶草本植物及桑树、木麻黄等双子叶木本植物,相关研究多集中于TssM、TssB、VgrG、HCP和TssL等蛋白。就其蛋白功能而言,TssM和TssB参与了该菌的生物膜(自身保护膜和运动鞭毛膜)的形成过程,当TssM和TssB沉默时,外膜蛋白、鞭毛相关基因flhC、flhD、flgM、fliA以及环磷酸腺苷受体蛋白等表达受阻[21,41]。保护生物膜的失活导致菌株无法有效抵御来自宿主的活性氧免疫攻击,进而导致毒力减弱,然而与Wang等人[37]研究结果不同的是,鞭毛的失活导致运动受阻,进而影响菌株在宿主植物组织的定殖能力,与此相似的是该菌中VgrG1、VgrG2也参与了菌株的运动形成过程,并且存在突变复原的现象[42]。此外,该菌的T6SS蛋白在同宿主不同组织中所表现的致病能力也不同,例如在叶柄致病过程中TssL相比其他蛋白将发挥更大作用,而在根部致病过程中VgrG3占主体影响因素[16],这表明在不同的侵染环境中,不同T6SS蛋白贡献力不同。就其调控方式而言,该菌存在多种分泌系统互作调控[43],诸如编码VgrG1、VgrG2、HCP等蛋白的基因簇在参与T6SS的同时也影响着T3SS效应子基因的表达[42]。
E. amylovora可以引起蔷薇科植物火疫病,主要侵染叶、花、嫩枝、果实等。相关研究集中于TssH、TssA、TssB、TssC、HCP、VgrG等蛋白。就其蛋白功能而言,位于T6SS1基因座的ClpV基因(TssH相关)与该菌中的致病效应子梨火疫病菌素(Amylovoran)的产量、生物膜呈正相关,同为致病效应子的果聚糖却不受该基因影响[18],这表明不同T6SS蛋白、效应子之间可能存在兼容性差别。同时,编码TssA1、TssB1、TssC1和HCP1等蛋白的基因与梨火疫病毒素产量呈负相关[18]。就其调控方式而言,T6SS的HCP、VgrG与T3SS的SpaR3基因被证明参与联合调控,此外,HCP、VgrG还与鞭毛(FlgB3)、菌毛(EAMY_0247)、磷酸盐转运过程(pstA3、pstC3、pstS3)、硫代谢过程(cysC、cysI3、cysJ、cysN、tauA、tauB、tauC、tauD3)、趋化性(cheA1、cheB1、cher1、cheY1、cheZ1)和细胞运动(motA1、motB1)等功能相关基因呈正相关[44]。
-
在细菌竞争中发挥重要作用的各种抗菌毒素可以通过T6SS传递至靶细胞,当不同植物病原细菌拥有共同的宿主侵染目标时,便会启用T6SS分泌多种降解酶,作为抗菌武器用以尝试杀死营养竞争者。诸如在P. aeruginosa中含有H1、H2和H3-T6SS3个基因簇,其中H1-T6SS专注于自身防御[3],仅用于检测到被异种细菌攻击时的反击作用[45],同时,细菌同种群之间相互接收信号并分泌对应的免疫蛋白从而避免误伤[46]。前人对于A. tumefaciens的T6SS的研究多集中于Tae、Tai、VgrG、基因转移、调控方式等,其T6SS通过分泌肽聚糖酰胺酶效应子Tae,裂解肽聚糖中的D-丙氨酸和谷氨酸键引起细胞增大从而抑制E. coli生长,并在漫长的进化中产生特异性免疫蛋白Tai,用于竞争过程中保护自身细胞不被Tae杀伤[47]。同时,该菌还具有两种依赖于保守HxxD基序的DNA酶效应子Tde,通过引起DNA降解及细胞伸长导致E. coli凋亡[17]。因此,A. tumefaciens通常将Tae和Tde联合参与营养竞争,且在不同竞争环境下均可杀死E. coli、P. aeruginosa等细菌[48]。此外,该细菌中T6SS的VgrG-a相关基因V2a编码一个AHH家族核酸酶,同样作为种间竞争的重要效应子[49]。其效应子多样性或许与其相关基因高效转移机制有关,在营养竞争过程中导致部分细胞DNA裂解,随后被同种间其他活细菌基因组整合[50],并利用整合的特异性免疫蛋白基因抵抗攻击者[51]。基于免疫基因转移机制使得细菌竞争过程中的毒性功能发挥更具挑战性,同时也提供了更多效应子的进化途径[52]。产生T6SS特异性免疫的被攻击者可以大大增强其竞争优势[53],诸如在E. coli中ClpA/ClpP基因的突变使其提高了对来自A. tumefaciens的T6SS毒性攻击,其中ClpA与ClpP相互作用是A. tumefaciens的T6SS效应子识别目标之一[54]。就其调控方式而言,T6SS的激活与ChvI组分或TssL的磷酸化作用有关[20],该蛋白调控途径与另一项关于P. aeruginosa的T6SS调控方式相似[55]。
前人对于P. syringae利用T6SS参与种间竞争的研究多集中于HCP、金属离子转运机制等。该菌中HCP2的分泌依赖于IcmF2(由HSI-II编码)[15],HCP2基因的特点在于其与E. coli、酵母菌的竞争过程中分泌活跃,而在侵染宿主植物过程中则保持沉默。然而,在HSI-I基因簇中HCP2相关的编码基因被转座酶终止,导致其相关功能丧失[56],该相似结果发现于P. aeruginosa[57],说明不同T6SS基因簇的功能存在专一性。此外,研究表明P. syringae中T6SS蛋白的运转与金属离子有关,诸如VgrG相关细胞壁靶向效应子PSPTO_5413的活性依赖于钙离子浓度,通过EF-Hand基序调节[58]。同时,P. syringae中T6SS蛋白的运转还与环境胁迫相关,诸如在渗透压升高后表现为T6SS相关基因上调[59]。
Xoc主要危害水稻分蘖期到抽穗前期的水稻叶片,且幼龄叶片最易受害,受害较严重时会导致减产50%以上甚至颗粒无收[60]。前人对于其T6SS的研究相对较少,主要涉及HCP、VgrG等蛋白。该菌编码2套T6SS基因簇,与细胞游动、趋化性、生物被膜及群体感应等表达有关,并参与调控胞外多糖和黄色素,通常利用T6SS效应子作为群体感应信号分子调控种间竞争趋势,相比于HCP,VgrG有着明显的分化现象,进化速度更快,并且其表达都与HCP呈正相关[36]。与上述P. syringae相同[15],Xoc的T6SS2在细菌竞争中发挥了重要作用,其中HCP2基因表达最为活跃[19],进一步说明了T6SS基因簇的专一性。
-
不同植物病原细菌中T6SS蛋白数量之间存在着较大的差异性。其中,E. amylovora中T6SS蛋白数量最多,为39个;P. syringae中T6SS蛋白数量次之,为37个;而A. tumefaciens仅为15个,明显少于P. syringae与E. amylovora。推测不同细菌中T6SS蛋白数量的差异性可能与侵染宿主的种类数量有关,有待于进一步深化对比研究。通过对5种细菌中的T6SS蛋白种类数量进行分析,明确VgrG的数量明显高于其他蛋白,为20个,HCP次之,为13个;除特有分泌蛋白VasK、CagE_TrbE_VirB外,TssL、TagH最少,仅有3个。上述不同蛋白之间数量的差异,推测VgrG作为效应子结合蛋白相比其他蛋白具有更深的进化水平,从而保证了其携带多种效应子以及靶向多种细胞的毒性能力。此外,部分细菌中不含特定蛋白,如P. syringae、R. solanacearum不含TssL、TagH;A. tumefaciens不含TssJ、TagH、Tai4等(表1)。这种数量上的差异是否与细菌在营养获取、种间竞争过程中的生长发育、毒性强弱有关,有待于进一步深入研究。
-
在功能近似的蛋白中,如TssM/J/L作为跨膜复合体结构,其中,TssM均来自于同一个进化分支C,而TssJ/L却分别聚为A、B与A、C类,且3个TssL蛋白所包含的结构域不尽相同,推测是水平基因转移所造成,然而各种T6SS相关基因如何进行高效的转移还有待进一步深入研究。HCP与VgrG的数量、结构域以及遗传分类均具有一定共性,其协同进化特性与毒性功能的发挥具有怎样的联系?有待于进一步探究。此外,独特的T6SS相关分泌蛋白CagE_TrbE_VirB、VasK分别聚类为A、B类群(图3),推测其作用主要由系统分泌的效应子的功能驱动。
-
前人关于植物病原细菌T6SS的相关研究主要涉及效应子释放对宿主植物的攻击性以及自身在种间竞争过程中面对胁迫反应的防御性两大方面,其功能具有保守性和独特性,其中包括结构、分类、功能机制等的研究已经取得了较多成果[5]。然而,当前在植物病原细菌的T6SS相关研究具有一定差异性,一方面,对于不同研究面其研究侧重点不同,如在侵染宿主方面的T6SS研究主要涉及VgrG、HCP、TssM/J/L、TssB/C 、TssA、TssH等众多蛋白,而在种间竞争方面主要涉及VgrG、HCP、Tai、Tae等较少的蛋白;另一方面,研究所涉及的细菌种类较少,在十大植物病原细菌中,X. oryzae pv. oryzae、X. campestris等目前鲜有相关报道[61],未来还有很大的发展空间。在上述5种植物病原细菌的T6SS研究报道中,多次出现T6SS组件参与生物膜的形成[18,21,36-37,41,44]。最近研究发现,外膜发生的必要基因bamA、tolB和lptD并不影响P. aeruginosa中T6SS的激活,其中bamA的缺失却导致了T6SS的非靶向性攻击,说明外膜的破坏导致T6SS上游激活信号更加敏感[62],然而外膜发生必要基因和参与生物膜形成的T6SS基因有何联系?有待于进一步研究。此外,在植物病原细菌的T6SS中关于金属离子的转运机制也鲜有报道,前人已通过对泰国伯克霍尔德氏菌(Burkholderia thailandensis)、假单胞菌(Pseudomonas)等细菌的T6SS研究明确了锰、铁、锌离子作为抗氧化酶的结构成分或辅因子的转运机制[63-65]。未来还需对植物病原细菌T6SS作出进一步深入研究,将有助于细菌多种分泌系统的完善。
-
植物病原细菌通过T6SS释放效应蛋白进而对宿主或其它竞争菌种实现接触性破坏,以达到营养摄取的目的。最新研究表明,T6SS也可以采用非接触依赖性毒性策略[66]。在细菌与宿主以及种间协同进化的过程中,为了克服侵染过程中的免疫障碍及竞争压力,T6SS进化出复杂多样的生存机制,如锰离子结合蛋白应对宿主免疫[67]、特异性免疫蛋白Tai[47]、相关基因的高效水平转移机制[68]等。前期,本实验组基于生物信息学与比较基因组学方法分析黄单胞菌(Xanthomonas campestris pv. raphanin)Ⅵ型分泌蛋白的信号肽、跨膜结构、保守基序、遗传关系等[69]。随着诸多植物病原菌全基因组序列的释放,为植物病原细菌特别是林木病原细菌致病基因的进一步研究夯实了理论基础[70],更多的植物病原细菌中T6SS相关蛋白被不断发现,对于进一步对比分析不同植物病原细菌的毒性特点与进化差异,以及不同T6SS相关结构和功能之间的关系,发挥着重要的作用。未来学术界对于植物病原细菌中T6SS功能的进一步解析,将有助于找寻和识别植物病原细菌的作用新靶点,有助于推动预防和治疗植物病害的新型农药的开发和利用。
植物病原细菌Ⅵ型分泌系统研究进展
A Review on the Type Ⅵ Secretion System of Plant Pathogenic Cacteria
-
摘要:
目的 Ⅵ型分泌系统(T6SS)作为植物病原细菌发挥重要功能的调控系统之一,主要表现为通过效应子的释放对宿主植物的攻击性和自身在种间竞争过程中面对胁迫反应的防御性等方面,明确重要植物病原细菌的T6SS蛋白及功能差异,有助于推动预防和治疗植物病害的新型农药的开发和利用。 方法 通过对比分析5种重要植物病原细菌(丁香假单胞菌、青枯雷尔氏菌、根癌农杆菌、梨火疫病菌、稻生黄单胞菌)中138个T6SS蛋白的保守结构域以及遗传关系,同时,基于对国内外文献数据库中有关上述5种细菌的T6SS功能研究的文献开展分析。 结果 明确5种植物病原细菌中T6SS蛋白在种类和数量上存在差异性。根据蛋白序列同源性及结构域,上述蛋白分为3大类,其中,含有VgrG、HCP等结构域的T6SS蛋白具有很好的聚类区分度,而含有TssA、TssG等结构域的T6SS蛋白则可分散在不同类别中。 结论 明确5种植物病原细菌中T6SS蛋白及功能具有一定保守性和独特性特征。该研究为进一步开展不同植物病原细菌中T6SS蛋白的预测分析,以及不同T6SS蛋白之间的关系解析提供理论基础。 Abstract:Objective Type Ⅵ secretion system (T6SS) is one of the regulatory systems that plays important functions in plant pathogenic bacteria. In terms of defense and other aspects, clarifying the T6SS protein and functional differences of important plant pathogenic bacteria will help promote the development and utilization of new pesticides for the prevention and treatment of plant diseases. Method In the study, five kinds of important plant pathogenic bacteria (Pseudomonas syringae, Ralstonia solanacearum, Agrobacterium tumefaciens, Erwinnia amylovora and Xanthomonas oryzae pv. oryzicola) bacterium in 138 conservative T6SS proteins structure domain and genetic relationships were analyzed, and the literatures about the above five kinds of bacteria in the database of the T6SS function research were also analyzed. Results T6SS proteins in the five kinds of plant pathogenic bacteria were different in species and quantity. According to proteins sequence homology and domain, the above proteins could be divided into three categories. Among them, T6SS proteins containing VgrG, HCP and other domains had good clustering discrimination, while T6SS proteins containing TssA, TssG and other domains could be divided into different categories. Conclusion The proteins and function of T6SS in the five kinds of plant pathogenic bacteria have certain conservation and unique characteristics. This study provides a theoretical basis for further prediction and analysis of T6SS proteins in different plant pathogenic bacteria and the relationship between different T6SS proteins. -
Key words:
- Plant pathogens bacteria
- / T6SS
- / Structural domain
- / Function
- / Genetic relationships
- / review
-
表 1 5种不同植物病原细菌所包含T6SS相关蛋白情况对比
Table 1. Comparison of T6SS related proteins in five different plant pathogenic bacteria
蛋白 Protein P. syringae R. solanacearum A. tumefaciens E. amylovora Xoc 合计 Total VgrG 6 6 1 5 2 20 TssM 2 1 1 2 2 8 TssJ 2 1 0 3 1 7 TssL 0 0 1 2 0 3 TssE 2 1 1 2 2 8 TssF 2 1 1 2 2 8 TssG 2 1 1 2 2 8 TssK 2 1 1 2 2 8 HCP 7 1 1 2 2 13 TssB 2 1 1 2 2 8 TssC 2 1 2 2 2 9 TssA 2 1 1 3 2 9 TssH 2 1 1 2 2 8 TagF 1 1 1 2 2 7 TagH 0 0 0 2 1 3 Tae4 1 1 1 1 0 4 Tai4 2 1 0 2 0 5 VasK SP 0 0 0 1 0 1 CagE SP 0 0 0 0 1 1 合计 Total 37 20 15 39 27 138 -
[1] WILKINSON SW, MAGERØY MH, LÓPEZ SÁNCHEZ A, et al. Surviving in a hostile world: plant strategies to resist pests and diseases[J]. Annual Review of Phytopathology, 2019, 57: 505-529. doi: 10.1146/annurev-phyto-082718-095959 [2] GREEN ER, MECSAS J. Bacterial secretion systems: an overview[J]. Microbiology Spectrum, 2016, 4(1): 13. [3] BASLER M, HO B, MEKALANOS J. Tit-for-tat: type VI secretion system counterattack during bacterial cell-cell interactions[J]. Cell, 2013, 152(4): 884-894. doi: 10.1016/j.cell.2013.01.042 [4] BERNAL P, LLAMAS MA, FILLOUX A. Type VI secretion systems in plant-associated bacteria[J]. Environmental Microbiology, 2018, 20(1): 1-15. doi: 10.1111/1462-2920.13956 [5] COULTHURST S. The Type VI secretion system: a versatile bacterial weapon[J]. Microbiology, 2019, 165(5): 503-515. doi: 10.1099/mic.0.000789 [6] WILLIAMS S, VARCOE L, ATTRIDGE S R, et al. Vibrio cholerae Hcp, a secreted protein coregulated with HlyA[J]. Infection and Immunity, 1996, 64(1): 283-289. doi: 10.1128/iai.64.1.283-289.1996 [7] PUKATZKI S, MA AT, STURTEVANT D, et al. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J]. Proceedings of The National Academy of Sciences, 2006, 103(5): 1528-1533. doi: 10.1073/pnas.0510322103 [8] BASLER Á, PILHOFER Á, HENDERSON G, et al. Type VI secretion requires a dynamic contractile phage tail-like structure[J]. Nature, 2012, 483(7388): 182-186. doi: 10.1038/nature10846 [9] TAYLOR N M, PROKHOROV N S, GUERRERO-FERREIRA R C, et al. Structure of the T4 baseplate and its function in triggering sheath contraction[J]. Nature, 2016, 533(7603): 346-352. doi: 10.1038/nature17971 [10] RUSSELL A B, HOOD R D, BUI N K, et al. Type VI secretion delivers bacteriolytic effectors to target cells[J]. Nature, 2011, 475(7356): 343-347. doi: 10.1038/nature10244 [11] RUSSELL A B, LEROUX M, HATHAZI K, et al. Diverse type VI secretion phospholipases are functionally plastic antibacterial effectors[J]. Nature, 2013, 496(7446): 508-512. doi: 10.1038/nature12074 [12] AHMAD S, WANG B, WALKER M D, et al. An interbacterial toxin inhibits target cell growth by synthesizing (p) ppApp[J]. Nature, 2019, 575(7784): 674-678. doi: 10.1038/s41586-019-1735-9 [13] BLEVES S, VIARRE V, SALACHA R, et al. Protein secretion systems in Pseudomonas aeruginosa: a wealth of pathogenic weapons[J]. International Journal of Medical Microbiology, 2010, 300(8): 534-543. doi: 10.1016/j.ijmm.2010.08.005 [14] SMITS T H, REZZONICO F, DUFFY B. Evolutionary insights from Erwinia amylovora genomics[J]. Journal of Biotechnology, 2011, 155(1): 34-39. doi: 10.1016/j.jbiotec.2010.10.075 [15] HAAPALAINEN M, MOSORIN H, DORATI F, et al. Hcp2, a secreted protein of the phytopathogen Pseudomonas syringae pv. tomato DC3000, is required for fitness for competition against bacteria and yeasts[J]. Journal of Bacteriology, 2012, 194(18): 4810-4822. doi: 10.1128/JB.00611-12 [16] ASOLKAR T, RAMESH R. The involvement of the Type Six Secretion System (T6SS) in the virulence of Ralstonia solanacearum on brinjal[J]. 3 Biotech, 2020, 10(7): 324-333. doi: 10.1007/s13205-020-02311-4 [17] MA L S, HACHANI A, LIN J S, et al. Agrobacterium tumefaciens deploys a superfamily of type VI secretion DNase effectors as weapons for interbacterial competition in planta[J]. Cell Host & Microbe, 2014, 16(1): 94-104. [18] TIAN Y, ZHAO Y, SHI L, et al. Type VI secretion systems of Erwinia amylovora contribute to bacterial competition, virulence, and exopolysaccharide production[J]. Phytopathology, 2017, 107(6): 654-661. doi: 10.1094/PHYTO-11-16-0393-R [19] ZHU P C, LI Y M, YANG X, et al. Type VI secretion system is not required for virulence on rice but for inter-bacterial competition in Xanthomonas oryzae pv. oryzicola[J]. Research in Microbiology, 2020, 171(2): 64-73. doi: 10.1016/j.resmic.2019.10.004 [20] LIN J S, WU H H, HSU P H, et al. Fha interaction with phosphothreonine of TssL activates type VI secretion in Agrobacterium tumefaciens[J]. PLoS Pathogens, 2014, 10(3): e1003991. doi: 10.1371/journal.ppat.1003991 [21] ZHANG L, XU J, XU J, et al. TssM is essential for virulence and required for type VI secretion in Ralstonia solanacearum[J]. Journal of Plant Diseases and Protection, 2012, 119(4): 125-134. doi: 10.1007/BF03356431 [22] MOUGOUS J D, CUFF M E, RAUNSER S, et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus[J]. Science, 2006, 312(5779): 1526-1530. doi: 10.1126/science.1128393 [23] HO B T, DONG T G, MEKALANOS J J. A view to a kill: the bacterial type VI secretion system[J]. Cell Host & Microbe, 2014, 15(1): 9-21. [24] BADR S, LI Y, DUAN K. Comparison of the structure, regulation and functions between type three and type six secretion system in gram-negative bacteria[J]. Journal of Medical Microbiology & Diagnosis, 2016, 5(4): 1000243. [25] LETUNIC I, BORK P. 20 years of the SMART protein domain annotation resource[J]. Nucleic Acids Research, 2018, 46(D1): D493-D496. doi: 10.1093/nar/gkx922 [26] 宋莎莎, 徐 进, 许景升,等. 植物青枯菌Po82菌株Ⅵ型分泌系统中hcp基因的克隆及其功能研究[J]. 植物保护, 2012, 38(5):16-21. doi: 10.3969/j.issn.0529-1542.2012.05.003 [27] RUHE Z C, LOW D A, HAYES C S. Polymorphic toxins and their immunity proteins: diversity, evolution, and mechanisms of delivery[J]. Annual Review of Microbiology, 2020, 74(1): 497-520. doi: 10.1146/annurev-micro-020518-115638 [28] CORBITT J, YEO J S, DAVIS C I, et al. Type VI secretion system dynamics reveals a novel secretion mechanism in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2018, 200(11): e00744-17. [29] SANTIN Y G, DOAN T, LEBRUN R, et al. In vivo TssA proximity labelling during type VI secretion biogenesis reveals TagA as a protein that stops and holds the sheath[J]. Nature Microbiology, 2018, 3(11): 1304-1313. doi: 10.1038/s41564-018-0234-3 [30] STIETZ M S, LIANG X, LI H, et al. TssA-TssM-TagA interaction modulates type VI secretion system sheath-tube assembly in Vibrio cholerae[J]. Nature Communications, 2020, 11(1): 5065-5075. doi: 10.1038/s41467-020-18807-9 [31] BARBOSA V A A, LERY L M S. Insights into Klebsiella pneumoniae type VI secretion system transcriptional regulation[J]. BMC Genomics, 2019, 20(1): 506-517. doi: 10.1186/s12864-019-5885-9 [32] LIN J S, PISSARIDOU P, WU H H, et al. TagF-mediated repression of bacterial type VI secretion systems involves a direct interaction with the cytoplasmic protein Fha[J]. Journal of Biological Chemistry, 2018, 293(23): 8829-8842. doi: 10.1074/jbc.RA117.001618 [33] DURAND E, NGUYEN V S, ZOUED A, et al. Biogenesis and structure of a type VI secretion membrane core complex[J]. Nature, 2015, 523(7562): 555-560. doi: 10.1038/nature14667 [34] BERNAL P, ALLSOPP L P, FILLOUX A, et al. The Pseudomonas putida T6SS is a plant warden against phytopathogens[J]. The ISME Journal, 2017, 11(4): 972-987. doi: 10.1038/ismej.2016.169 [35] BARRET M, EGAN F, FARGIER E, et al. Genomic analysis of the type VI secretion systems in Pseudomonas spp. : novel clusters and putative effectors uncovered[J]. Microbiology, 2011, 157(6): 1726-1739. doi: 10.1099/mic.0.048645-0 [36] 牛苗静, 谢清标, 李 婷,等. 细菌Ⅵ型分泌系统Hcp与VgrG蛋白的共进化分析[J]. 热带生物学报, 2018, 9(1):90-100. doi: 10.15886/j.cnki.rdswxb.2018.01.012 [37] WANG N, HAN N, TIAN R, et al. Role of the Type VI Secretion System in the Pathogenicity of Pseudomonas syringae pv. actinidiae, the Causative Agent of Kiwifruit Bacterial Canker[J]. Frontiers in Microbiology, 2021, 12: 297. [38] LIU J, YU M, CHATNAPARAT T, et al. Comparative transcriptomic analysis of global gene expression mediated by (p) ppGpp reveals common regulatory networks in Pseudomonas syringae[J]. BMC Genomics, 2020, 21(1): 296-313. doi: 10.1186/s12864-020-6701-2 [39] RECORDS A R, GROSS D C. Sensor kinases RetS and LadS regulate Pseudomonas syringae type VI secretion and virulence factors[J]. Journal of Bacteriology, 2010, 192(14): 3584-3596. doi: 10.1128/JB.00114-10 [40] ARVIZU-GÓMEZ J L, HERNÁNDEZ-MORALES A, JOFRE-GARFIAS A E, et al. Temperature, the GacS/GacA system, and host metabolites regulate the type VI secretion system of Pseudomonas syringae pv. phaseolicola[J]. Journal of General Plant Pathology, 2013, 79(3): 194-197. doi: 10.1007/s10327-013-0443-9 [41] ZHANG L, XU J, XU J, et al. TssB is essential for virulence and required for type VI secretion system in Ralstonia solanacearum[J]. Microbial Pathogenesis, 2014, 74: 1-7. doi: 10.1016/j.micpath.2014.06.006 [42] 罗亚婷, 许景升, 徐 进,等. 青枯菌Po82菌株Ⅵ型分泌系统基因簇功能研究[J]. 植物保护, 2016, 42(6):38-45. [43] ASOLKAR T, RAMESH R. Development of T3SS Mutants (hrpB− and hrcV−) of Ralstonia solanacearum, Evaluation of Virulence Attenuation in Brinjal and Tomato—A Pre-requisite to Validate T3Es of R. solanacearum[J]. Indian Journal of Microbiology, 2018, 58(3): 372-380. doi: 10.1007/s12088-018-0736-y [44] KAMBER T, POTHIER J F, PELLUDAT C, et al. Role of the type VI secretion systems during disease interactions of Erwinia amylovora with its plant host[J]. BMC Genomics, 2017, 18(1): 628-639. doi: 10.1186/s12864-017-4010-1 [45] HO B T, BASLER M, MEKALANOS J J. Type 6 secretion system-mediated immunity to Type 4 secretion system-mediated gene transfer[J]. Science, 2013, 342(6155): 250-253. doi: 10.1126/science.1243745 [46] BASLER Á, MEKALANOS J. Type 6 secretion dynamics within and between bacterial cells[J]. Science, 2012, 337(6096): 815-815. doi: 10.1126/science.1222901 [47] YU M, WANG Y C, HUANG C J, et al. Agrobacterium tumefaciens deploys a versatile antibacterial strategy to increase its competitiveness[J]. Journal of Bacteriology, 2021, 203(3): e00490-20. [48] SANTOS M N M, CHO S T, WU C F, et al. Redundancy and specificity of type VI secretion vgrG loci in antibacterial activity of Agrobacterium tumefaciens 1D1609 strain[J]. Frontiers in Microbiology, 2020, 10: 3004. doi: 10.3389/fmicb.2019.03004 [49] BELLIENY-RABELO D, TANUI C K, MIGUEL N, et al. Transcriptome and comparative genomics analyses reveal new functional insights on key determinants of pathogenesis and interbacterial competition in Pectobacterium and Dickeya spp[J]. Applied and Environmental Microbiology, 2019, 85(2): e02050-18. [50] WU C F, SANTOS M N M, CHO S T, et al. Plant-pathogenic Agrobacterium tumefaciens strains have diverse type VI effector-immunity pairs and vary in in-planta competitiveness[J]. Molecular Plant-Microbe Interactions, 2019, 32(8): 961-971. doi: 10.1094/MPMI-01-19-0021-R [51] BORGEAUD S, METZGER L C, SCRIGNARI T, et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer[J]. Science, 2015, 347(6217): 63-67. doi: 10.1126/science.1260064 [52] THOMAS J, WATVE S S, RATCLIFF W C, et al. Horizontal gene transfer of functional type VI killing genes by natural transformation[J]. MBio, 2017, 8(4): e00654-00617. [53] STEELE M I, KWONG W K, WHITELEY M, et al. Diversification of type VI secretion system toxins reveals ancient antagonism among bee gut microbes[J]. MBio, 2017, 8(6): e01630-17. [54] LIN H H, YU M, SRIRAMOJU M K, et al. A high-throughput interbacterial competition screen identifies ClpAP in enhancing recipient susceptibility to type VI secretion system-mediated attack by Agrobacterium tumefaciens[J]. Frontiers in Microbiology, 2020, 10: 3077. doi: 10.3389/fmicb.2019.03077 [55] CASABONA M G, SILVERMAN J M, SALL KM, et al. An ABC transporter and an outer membrane lipoprotein participate in posttranslational activation of type VI secretion in Pseudomonas aeruginosa[J]. Environmental Microbiology, 2013, 15(2): 471-486. doi: 10.1111/j.1462-2920.2012.02816.x [56] CHIEN C F, LIU C Y, LU Y Y, et al. HSI-II gene cluster of Pseudomonas syringae pv. tomato DC3000 encodes a functional type VI secretion system required for interbacterial competition[J]. Frontiers in Microbiology, 2020, 11: 1118. doi: 10.3389/fmicb.2020.01118 [57] ALLSOPP L P, COLLINS A C, HAWKINS E, et al. RpoN/Sfa2-dependent activation of the Pseudomonas aeruginosa H2-T6SS and its cognate arsenal of antibacterial toxins[J]. Nucleic Acids Research, 2022, 50(1): 227-243. doi: 10.1093/nar/gkab1254 [58] LIANG X, MOORE R, WILTON M, et al. Identification of divergent type VI secretion effectors using a conserved chaperone domain[J]. Proceedings of The National Academy of Sciences, 2015, 112(29): 9106-9111. doi: 10.1073/pnas.1505317112 [59] FREEMAN BC, CHEN C, YU X et al. Physiological and transcriptional responses to osmotic stress of two Pseudomonas syringae strains that differ in epiphytic fitness and osmotolerance[J]. Journal of Bacteriology, 2013, 195(20): 4742-4752. doi: 10.1128/JB.00787-13 [60] 杨 俊, 王 星, 王彦芳,等. 云南省水稻细菌性条斑病菌的致病型划分和水稻抗性资源的鉴定[J]. 植物病理学报, 2020, 50(2):218-227. doi: 10.13926/j.cnki.apps.000411 [61] MANSFIELD J, GENIN S, MAGORI S, et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(6): 614-629. doi: 10.1111/j.1364-3703.2012.00804.x [62] STOLLE A S, MEADER B T, TOSKA J, et al. Endogenous membrane stress induces T6SS activity in Pseudomonas aeruginosa[J]. Proceedings of The National Academy of Sciences, 2021, 118(1): e2018365118. doi: 10.1073/pnas.2018365118 [63] SI M, ZHAO C, BURKINSHAW B, et al. Manganese scavenging and oxidative stress response mediated by type VI secretion system in Burkholderia thailandensis[J]. Proceedings of The National Academy of Sciences, 2017, 114(11): E2233-E2242. [64] LIN J, ZHANG W, CHENG J, et al. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition[J]. Nature Communications, 2017, 8(1): 14888-14899. doi: 10.1038/ncomms14888 [65] SI M, WANG Y, ZHANG B, et al. The type VI secretion system engages a redox-regulated dual-functional heme transporter for zinc acquisition[J]. Cell Reports, 2017, 20(4): 949-959. doi: 10.1016/j.celrep.2017.06.081 [66] SONG L, PAN J, YANG Y, et al. Contact-independent killing mediated by a T6SS effector with intrinsic cell-entry properties[J]. Nature Communications, 2021, 12(1): 423-434. doi: 10.1038/s41467-020-20726-8 [67] ZHU L, XU L, WANG C, et al. T6SS translocates a micropeptide to suppress STING-mediated innate immunity by sequestering manganese[J]. Proceedings of The National Academy of Sciences, 2021, 118(42): e2103526118. doi: 10.1073/pnas.2103526118 [68] LI C, ZHU L, WANG D, et al. T6SS secretes an LPS-binding effector to recruit OMVs for exploitative competition and horizontal gene transfer[J]. The ISME Journal, 2022, 16(2): 500-510. doi: 10.1038/s41396-021-01093-8 [69] 韩长志, 王 娟. 黄单胞菌Xanthomonas campestris pv. raphani 756C中Ⅵ型分泌蛋白的生物信息学分析[J]. 华中农业大学学报, 2016, 35(4):42-48. [70] 韩长志, 祝友朋, 王韵晴. 核桃细菌性黑斑病的研究进展[J]. 林业科学研究, 2021, 34(4):184-190. doi: 10.13275/j.cnki.lykxyj.2021.04.022 -




 下载:
下载: