-
硼是植物必需的微量矿质元素,在植物的生长发育和生理代谢过程中发挥重要作用[1-2] 。但植物对硼元素的适应范围较窄,土壤中有效硼含量过低或过高均会影响植物正常的生长发育[3] ,可能导致叶尖或叶缘失绿、黄化、焦枯[4] ,根系生长受阻、形态改变,植株矮小、死亡等症状。研究发现,硼胁迫抑制了桑树(Morus alba L.)和柑橘(Citrus L.)的株高和根系的生长,降低了叶片的叶绿素含量[5-6] 。并且,硼胁迫会诱导植物组织产生氧化应激损伤,导致脂膜过氧化和活性氧平衡系统改变,在6 mmol·L−1硼酸条件下,苹果砧木EM9(Malus domestica Borkh)的叶和茎中脂氧合酶(lipoxygenase,LOX)活性增强,丙二醛(malondialdehyde,MDA)含量增加,脯氨酸(proline,Pro)含量减少[7] 。氧化应激产物的积累导致氧化还原稳态受损,从而激活植物体内抗氧化系统中保护酶的活性和抗氧化剂含量的变化,硼胁迫导致植物中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)的活性均增加,并诱导抗坏血酸(ascorbic acid,AsA)含量变化[8] 。当植物处于硼胁迫环境中时其体内的代谢反应也会受到影响,如可溶性蛋白的合成[9-10] 和次生代谢途径相关酶活性的变化[11] 。此外,硼胁迫也会影响植物对其他营养元素的吸收和积累,施加硼营养促进了棉花对氮、磷、钾的吸收,而降低了棉花中钙和镁元素的含量[12] ;而缺硼会降低蚕豆(Vicia faba L.)对磷酸盐的吸收[13] ;研究火炬松(Pinus taeda L.)细胞培养物的生长时,发现硼与钙、镁之间存在着显著的相互作用[14] 。
黑木相思(Acacia melanoxylon R.Br.)属于含羞草亚科(Mimosaceae)金合欢属(Acacia Mill.),是原产于澳大利亚的多年生高大乔木,其适应性广、抗逆性强、速生、材性优良,与根瘤共生固氮,可改良土壤、提升地力、保持水土,具有较好的经济和生态价值[15] 。自20世纪90年代初引入我国,已在广东、广西、海南、福建等华南地区广泛引种栽培。华南地区大部分土壤的有效硼含量较低,达到缺硼(0.25~0.5 mg∙kg−1)或严重缺硼等级(<0.25 mg∙kg−1)[16] ,在林木培育过程中多需施以硼肥,因此,如何避免林木缺硼或硼过量胁迫,是南方人工林培育过程中亟待解决的问题。目前,在杨树(Populus)、桉树(Eucalyptus urophylla S.T. Blake)及针叶树中进行了一些硼营养的研究[17-20],但林木的生长发育对硼胁迫的响应研究仍不够完善。本研究以黑木相思无性系SR17幼苗为材料,分析了不同供硼量条件下幼苗的生长特性、生理生化特征的变化,旨在明确黑木相思对不同供硼量的响应模式,为阐明植物对硼胁迫的抵御机理奠定理论基础,为林木高产、优质栽培提供科学依据。
-
以黑木相思无性系SR17为研究材料,选取高度一致且长势相近的1月龄水培幼苗,用超纯水冲洗干净根部后,定植于海绵固定的育苗盘中,盘长30 cm、宽24 cm、高10 cm,盘内添加1 L不含硼的1/2 MS营养液作为基础营养液,pH为5.8,培养于中国林业科学研究院热带林业研究所育苗室 (23°20' N,113°19' E),室内日平均温度约25 ℃,平均湿度约70%,自然光照强度约6 000~7 000 Lux。以硼酸为硼源,设置0、0.1、1、2 mmol·L−1 四个硼水平处理,分别添加至基础营养液中,处理2个月,每2天补充新鲜营养液,每周更换新鲜营养液,各处理分别记为B0、B0.1、B1、B2,每处理设4个育苗盘为4个重复,每重复设15株。
-
测定培养0 d和2个月后各处理植株的株高、叶片数、根长等生长指标,每处理设4个重复,每个重复15株幼苗。
-
分别称取各处理植株地上部分样品0.5 g,以80%丙酮溶液为提取液,利用分光光度计法测定645 nm、663 nm波长下的吸光值,参照公式:叶绿素a=12.7 × A663−2.69 × A645;叶绿素b=22.9 × A645−4.68 × A663,总叶绿素含量=叶绿素a + 叶绿素b,计算样品的叶绿素含量[21] ,每处理从4个育苗盘中分别随机选择1株,4株设为一重复,共6个重复。
-
分别取各处理植株的地上部分为样品,利用改良型Bradford法测定可溶性蛋白的含量[22] ;利用硫代巴比妥酸法测定MDA含量[23] ;采用茚三酮法进行Pro的提取与测定[24] ;利用抗坏血酸氧化酶催化AsA氧化生成脱氧抗坏血酸(DHA)的原理测定AsA的氧化速率从而测定AsA含量[25] ;利用氮蓝四唑光还原法测定SOD活性[26] ;采用紫外吸收法测定CAT活性[27] ;利用愈创木酚法测定POD活性[28] ;参照Wang等[29] 的方法测定LOX活性;采用L-苯丙氨酸法测定PAL活性[30] ,每处理从4个育苗盘中分别随机选择1株,4株设为一重复,共6个重复。
-
分别取各处理植株地上部分为样品,至于烘箱中105 ℃杀青60 min,65 ℃烘干至质量恒定,进行氮、磷、钾、钙、镁、硼等营养元素含量的测定。参照NY/T2017-2011,利用全自动定氮仪测定氮的含量,利用分光光度法测定磷的含量,利用火焰原子吸收分光光度法测定钾的含量;参照DB12/T 846-2018,利用等离子发射光谱仪测定钙、镁的含量;参照LY/T1273-1999,利用干灰化-甲亚胺比色法测定硼的含量。每处理从4个育苗盘中分别随机选择1株,4株设为一重复,共6个重复。
-
利用Excel 2016和 SPSS 22对测定结果进行数据处理和ANOVA单因素方差分析,利用Turkey HSD进行事后多重比较。选择具有显著性差异的指标进行主成分分析,在分析前先对数据进行标准化处理,以消除量纲差异,处理方法采用
$ {\stackrel{-}{x}}_{ij}={(x}_{ij}-{\stackrel{-}{x}}_{j})/{s}_{j} $ ,其中$ {x}_{ij} $ 为各指标原始数据,$ {\stackrel{-}{x}}_{j} $ 为各处理原始数据平均值,$ {s}_{j} $ 为标准差。主成分分析以选择特征值大于1,累积贡献率达到90%以上为标准保留主成分。计算各主成分权重 (W)及综合得分(F), 权重计算公式:Wj =Pj /∑Pj,式中,Wj 表示第j个主成分的权重,Pj 表示j 主成分的贡献率, 获得综合指标值F=∑(Fj × Wj )[31] ,Fj表示各主成分的得分。利用公式计算各指标数据标准化后的隶属函数值:Uj=(Xj-Xj min)/(Xj max- Xj min),其中 Xj为第 j 个综合指标; Xj min 为第 j 个综合指标的最小值;Xj max 为第 j 个综合指标的最大值。最后将隶属函数和权重结合,获得综合评价值(D),计算公式为D=∑(Uj × Wj )。 -
不同供硼量条件下,植株的生长表型有所不同(图1)。B0的植株叶片(图1A)比B0.1(图1B)稍黄;而B1和B2呈现出叶缘失绿的表型,且部分叶片黄化脱落(图1C、D)。根系方面,B0形成了白色较粗的主根,侧根也较短而粗(图1E);而B1和B2侧根较细,且随着硼浓度增高而越发褐色(图1G、H)。由此说明,无硼的培养条件使黑木相思幼苗发生缺硼症状,叶片发黄,主根和侧根均加粗,且侧根变短;随着硼浓度的增加,幼苗受到了硼过量的毒害作用,叶缘失绿,老叶黄化脱落,侧根变细,根系褐化。

图 1 不同供硼量对黑木相思幼苗叶和根的影响
Figure 1. Effects of different boric acid content on the leave and roots of A.melanoxylon seedlings
由生长指标测定结果(图2)得出,B0.1植株株高增长量较B0植株株高增长量大;但随着供硼量的继续增加,株高增加量反而减小,B2株高增长量为7.05 cm,仅为B0.1株高增长量的54.9%。根长生长与株高生长情况类似,B0.1根长增长量较B0根长增长量大;而B1和B2的根长增长量仅为B0.1的59.6%和41.7%。随着供硼量的增加,植株叶片数增加量逐渐减少。由此说明,B0.1黑木相思幼苗生长较好;B0形成缺硼表型,叶片发黄,侧根变短,主根和侧根加粗;B1和B2造成硼过量的毒害作用,叶缘失绿,根系褐化,株高、叶片数、根长生长均受到抑制。因此,供硼量是影响黑木相思生长发育的重要因素之一。
-
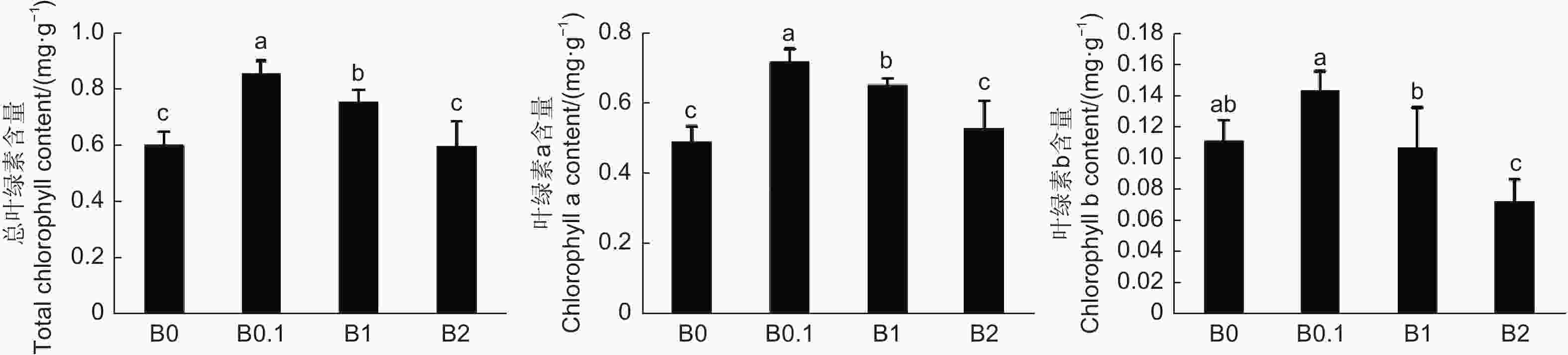
图3表明,B0植株体内叶绿素a和叶绿素b含量均低于B0.1植株;B0.1植株的叶绿素a和叶绿素b含量最高;而B1和B2植株的叶绿素a和叶绿素b的含量逐渐降低。由此推断,0、1和2 mmol·L−1的供硼量均引起黑木相思地上部分叶绿素含量降低,抑制叶片光合作用,从而影响植株的正常生长发育。
-
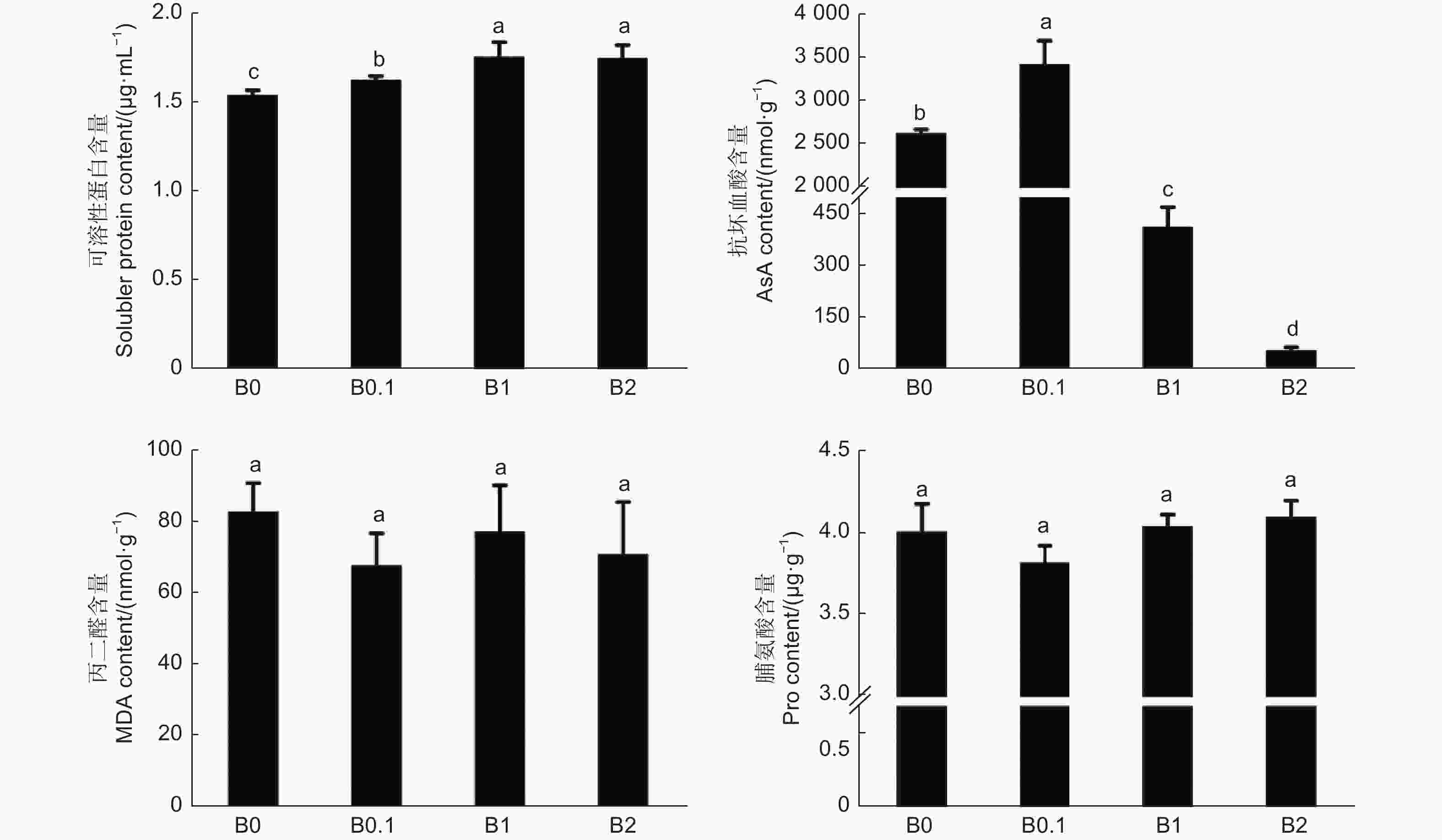
植物体内的可溶性蛋白的含量是反映植物总代谢的重要指标,如图4所示,随着供硼量的增加,黑木相思幼苗体内可溶性蛋白含量越高,植株体内的代谢反应越活跃。AsA是植物细胞中保护叶绿体的重要的抗氧化剂,AsA的含量在B0.1植株体内最高,随着供硼量的增加,AsA的含量急剧降低,说明硼过量条件促进了黑木相思体内的氧化反应造成叶绿体损伤。MDA是过氧脂质分解出的产物之一,其含量可以反应植物体内脂质氧化的水平,在B0、B1和B2 植株体内MDA含量较B0.1植株的高,说明硼胁迫引起黑木相思体内脂质氧化水平升高。Pro是植物抵御逆境时的渗透调节物质之一,用于保持细胞质基质与环境的渗透平衡,防止水分散失,Pro含量在B0、B1和B2 植株体内较高,说明缺硼和硼过量条件造成了黑木相思的渗透胁迫。
-
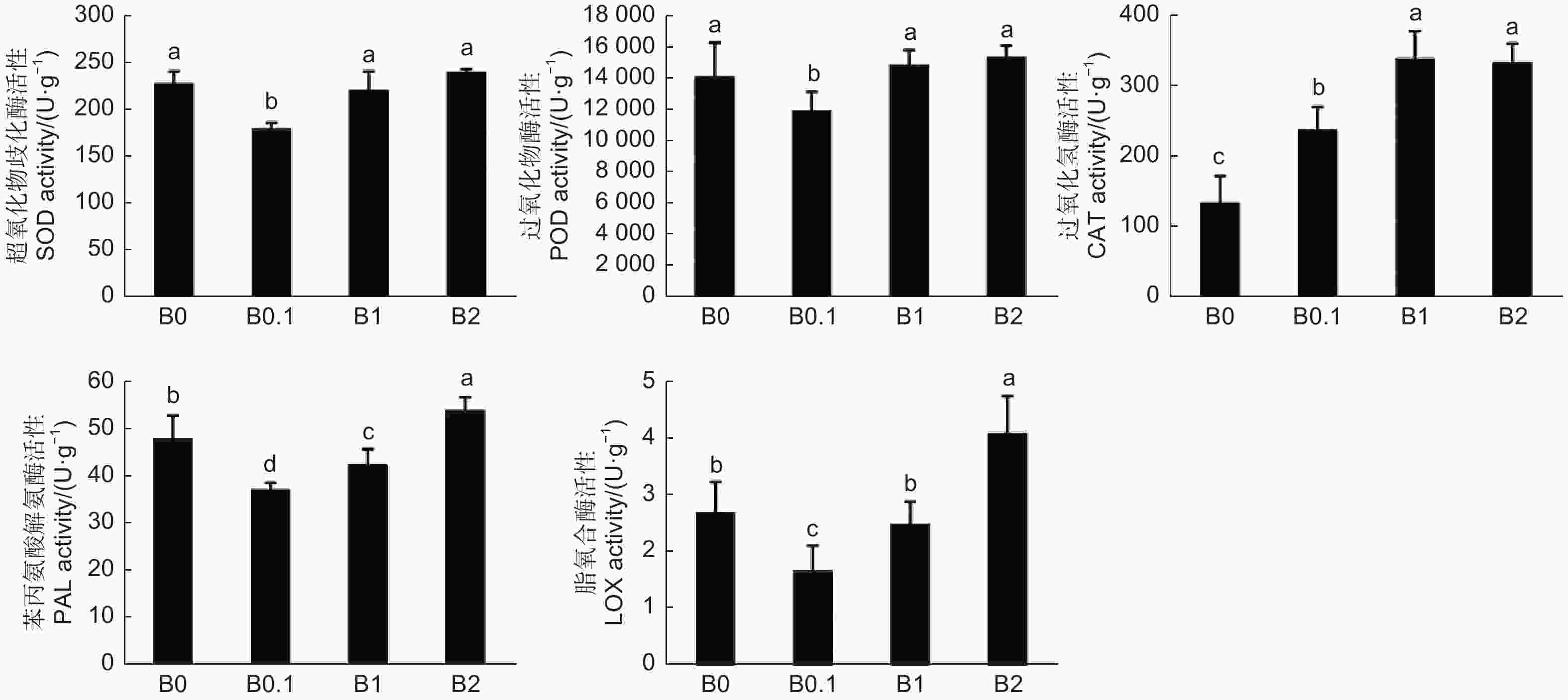
SOD和POD是植物体内氧自由基和H2O2的重要清除剂,保护植物免受氧化反应毒害。如图5所示,在B0、B1和B2幼苗体内SOD和POD的活性较高,推断缺硼和硼过量条件使黑木相思幼苗发生了氧自由基和H2O2的积累。CAT是植物体内清除H2O2的主要酶之一,随着供硼量增加,幼苗体内产生的H2O2越多,CAT的活性越高。PAL是植物体内次生物质苯丙烷类代谢的关键酶,PAL活性在B0、B1和B2幼苗中升高,说明缺硼和硼过量条件促进了黑木相思体内次生代谢物的合成。LOX是一种催化膜脂过氧化的酶,其活性越高使得植物体内的过氧化程度越大,对植株产生毒害作用增加。LOX活性在B0、B1和B2 幼苗体内增加,说明缺硼和硼过量条件使黑木相思幼苗产生了较剧烈的过氧化反应。以上结果表明,缺硼或硼过量条件影响了黑木相思幼苗生化水平的稳定,促进了LOX酶活性的增加,使细胞膜脂产生过氧化反应;促进了SOD、POD、CAT等抗氧化酶和次生代谢物合成酶PAL的活性增加,以抵御过氧化反应的毒害作用,协调控制黑木相思的生长发育。
-
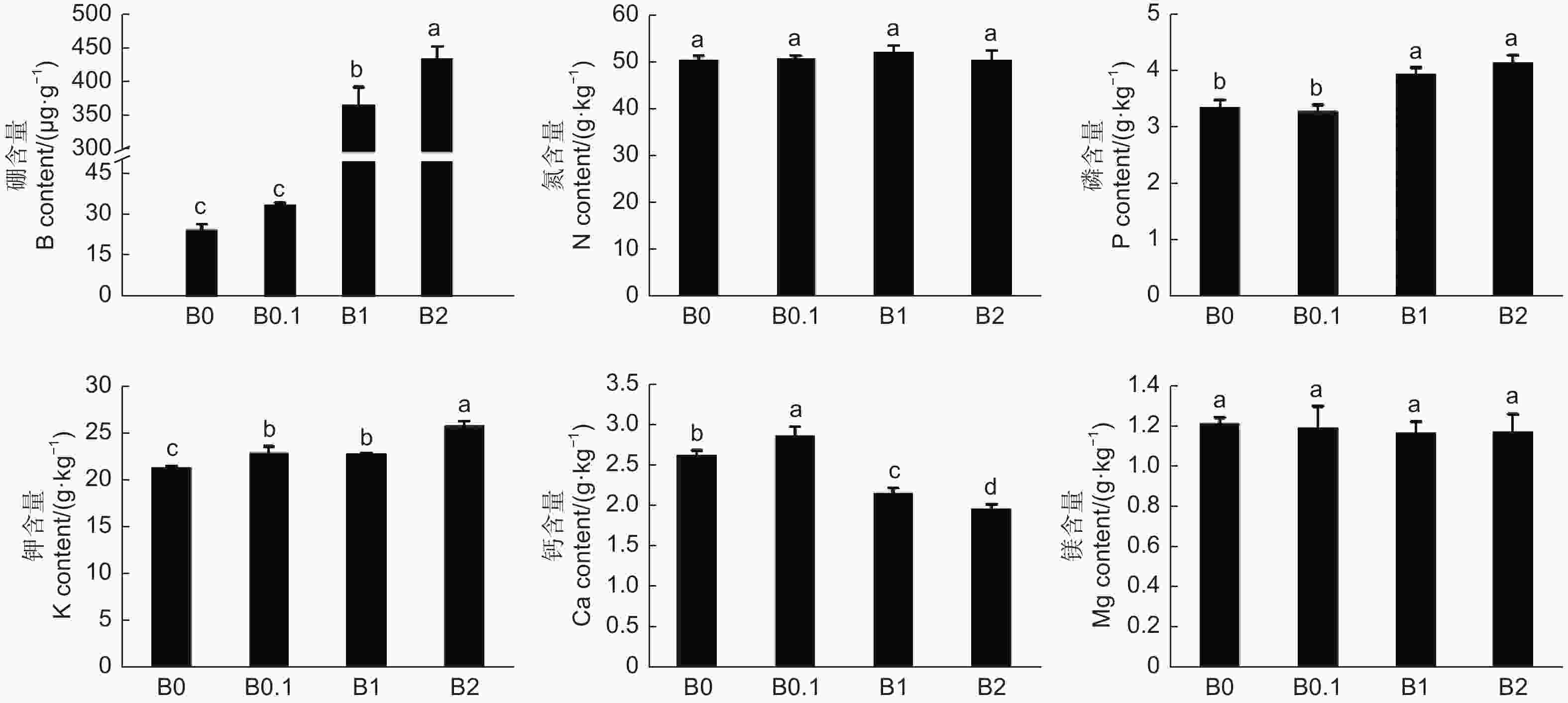
在植物体内,不同营养元素之间会产生促进或拮抗的作用,这些相互作用完成植物生理生化过程,调节着植物的营养状况,影响着植物的生长发育。结果表明(图6),植株体内硼元素的含量随着培养液中供硼量的增加而增加,尤其在过量硼供应条件下(B1和B2)发生硼元素的大量积累,分别为B0.1硼含量的10.94倍和12.95倍;随着供硼量的增加,磷和钾元素的含量逐渐增加;而氮和镁元素的含量无明显变化;钙元素在生长状态较好的植株(B0.1 )中的含量较高,随着硼的过量供应,钙含量逐渐降低,B1和B2的钙含量分别较B0.1的降低15.38%和23.08%。由此说明,黑木相思体内硼元素与不同元素之间的相互作用有所不同,硼元素的积累可以促进磷和钾元素的积累,即硼元素与磷和钾元素具有协同作用;硼元素与氮和镁元素无明显相互作用;在硼元素促进植株生长的条件下,可以促进钙元素的积累,但硼过量抑制植株生长时,也抑制了钙元素的积累。
-
为了更明确地分析和评价各指标对不同供硼量的响应程度,将具有显著性差异的17个指标进行主成分分析。结果得出(表1),前两个综合指标的贡献率分别为75.14%、19.66%,累计贡献率达94.80%,表明提取前两个主成分可以代表大部分指标的信息。以特征向量系数作为评价标准(表2),第一主成分特征值为12.77,其中钾元素含量、叶片数增长量、株高增长量、LOX活性、AsA含量、钙元素含量、硼元素含量、POD活性、Pro含量、SOD活性、根长增长量、蛋白浓度、PAL活性的荷载量较高;第二主成分特征值为3.34,其中叶绿素b含量的荷载量较高。因此,可取以上14个指标作为评价黑木相思对不同供硼量条件适应性的主要指标。
表 1 综合评价主成分指标系数及贡献率
Table 1. Principal components eigenvectors and cumulative contribution rates
项目
Item主成分1
Prin.1主成分2
Prin.2钾含量 K content −0.98 −0.12 叶片数增长量 Leave number growth −0.98 −0.19 株高增长量 Plant height growth −0.97 0.24 脂氧合酶活性 LOX activity 0.96 0.26 抗坏血酸含量 AsA content −0.95 −0.19 钙含量 Ca content 0.92 0.37 硼含量B content 0.92 −0.31 过氧化物酶活性 POD activity 0.92 −0.23 脯氨酸含量 Pro content 0.91 −0.32 超氧化物歧化酶活性 SOD activity −0.88 −0.36 根长增长量 Root growth −0.88 0.39 蛋白浓度 Protein concentration 0.84 −0.51 苯丙氨酸解氨酶活性 PAL activity 0.81 −0.55 磷含量 P content 0.75 0.37 叶绿素a含量 Chlorophyll a content 0.74 0.67 叶绿素b含量 Chlorophyll b content −0.49 0.87 过氧化氢酶活性 CAT activity 0.67 0.75 特征值 Eigenvalues 12.77 3.34 方差贡献率/%
Variance contribution rate75.14 19.66 累计贡献率/%
Cumulative contribution rate75.14 94.80 表 2 不同供硼量条件下各指标的主成分和隶属函数分析及综合评价
Table 2. Comparison and comprehensive evaluation of the subordinate function values under different boric acid supply
指标
ItemF1 F2 F U(F1) U(F2) D 排名
RankedB0 −1.53 −2.48 −1.73 0.29 0 0.23 3 B0.1 −3.96 1.25 −2.87 0 0.99 0.21 4 B1 1.13 1.29 1.16 0.61 1 0.69 2 B2 4.36 −0.07 3.43 1 0.64 0.92 1 权重Index weight 0.79 0.21 注: F1, F2 分别代表相互独立的综合指标得分,F代表主成分综合得分; U(F1)、U(F2)分别代表各综合指标的隶属函数值,D代表主成分和隶属函数分析的综合评价值
Notes: F1, F2 represent independent comprehensive index, respectively; U(F1)、U(F2) represent the subordinate function values of comprehensive index, respectively; D represents the comprehensive evaluation value of principal component and subordinate function analysis根据主成分特征向量系数及贡献率(表2),获得前两个主成分的因子方程:
F1=−0.27Q1−0.27Q2−0.27Q3+0.27Q4−0.27Q5+0.26Q6+0.26Q7+0.26Q8+0.25Q9−0.25Q10−0.25Q11+0.24Q12+0.23Q13+0.21Q14+0.21Q15−0.14Q16+0.19Q17;
F2=−0.06Q1−0.10Q2+0.13Q3+0.14Q4−0.10Q5+0.20Q6−0.16Q7−0.12Q8−0.17Q9−0.19Q10+0.21Q11−0.27Q12−0.29Q13+0.19Q14+0.35Q15+0.46Q16+0.39Q17(式中Qi为各指标标准化后的值)。
主成分综合得分公式为F=0.79F1 + 0.21F2,分别计算不同供硼量条件下,前两个主成分的综合得分(F),得出黑木相思的生长发育受胁迫程度排序为B2>B1 >B0 >B0.1。另外,利用权重(W)及隶属函数值求得不同供硼量条件下黑木相思幼苗生长发育的综合评价值(D),结果表明(表2),对黑木相思幼苗生长发育的胁迫程度同为B2>B1 >B0>B0.1。因此,黑木相思幼苗相对适宜的供硼量为0.1 mmol·L−1,而 0、1 和2 mmol·L−1的供硼量均影响黑木相思幼苗的生长发育。
-
充足的硼营养对植物生长发育至关重要,研究黑木相思受硼胁迫时生长特性及生理生化特征的变化,对解析林木对硼胁迫的抵御机理,定向培育优良品种,促进林木生产力具有重要意义。本研究发现,缺硼和硼过量条件均抑制了黑木相思幼苗的生长,导致植株矮小,根系变短加粗。以往的研究也证实了硼胁迫会导致植物生长减缓,如缺硼胁迫导致枳橙(Poncirus trifoliate (L.) Raf.)节间缩短,根系明显变粗和褐化,且根尖膨大[32] ;硼过量时葡萄(Vitis vinifera L.)的叶片和根系生长均受到显著抑制[33] ;麻风树(Jatropha curcas L.)植株整体生长降低,且根系的生长减少程度高于叶片和茎部[34] 。供硼量对黑木相思的叶片数增长量有显著影响,这可能是因为硼元素在维持细胞壁结构完整性中起着至关重要的作用[35] 。缺硼条件下,植株顶端分生组织细胞壁完整性受损[36-37] ,硼过量的环境又造成细胞壁过度增厚[5] ,细胞无法完成正常的分化进程,引起器官的结构发育不良,进而导致植株顶端分生组织生长异常,叶片数增长受到影响。另外,硼胁迫还导致黑木相思幼苗叶片失绿黄化,叶绿素含量显著降低。这是因为硼胁迫下细胞膜透性增加,叶绿素初始前体氨基乙酰丙酸积累受到影响[38] ,造成叶绿素含量降低,叶片黄化。Hegazi等[39] 对橄榄(Olea europaea L.)喷施叶面硼酸也证明了叶绿素a、叶绿素b、总叶绿素含量与硼浓度显著相关。因此,硼胁迫会破坏植株的细胞结构,抑制植株株高和根系生长,且降低叶绿素含量,抑制光合作用,从而影响植株的正常生长。
植物遭遇硼胁迫通常会导致体内活性氧积累,从而诱导细胞膜的氧化损伤。本研究发现,0、1和2 mmol·L−1供硼量下,黑木相思地上部LOX活性和MDA含量均高于0.1 mmol·L−1供硼量下的,这表明缺硼和硼过量环境均对植株造成了胁迫,导致植株的细胞膜透性增加,脂质过氧化反应增强。同时,本研究中AsA的含量在0、1和2 mmol·L−1供硼量下均低于0.1 mmol·L−1供硼量下的,表明缺硼和硼过量环境中过量的活性氧消耗了植物体内的AsA,导致AsA含量降低。SOD、CAT和POD均为重要的抗氧化酶,本研究中SOD和POD活性在硼胁迫条件下显著升高;CAT活性在缺硼条件下降低,硼过量条件下升高。这表明硼胁迫条件诱发了植物细胞的氧化应激保护机制,而不同的抗氧化酶在面对胁迫反应时的敏感程度不尽相同,活性氧的清除系统由多种抗氧化酶共同对抗氧自由基组成,以抵御对植株产生伤害。
植物体内的硼元素含量可以通过复杂的作用网络影响植物对其他营养元素的吸收和运输。本研究发现,随着营养液中硼酸浓度的增加,黑木相思地上部硼含量也随之增加,表明植株对硼含量的积累与环境中硼酸浓度有关,过多的硼酸供应将导致植株体内的硼元素含量累积超过植株自身需要,从而造成硼胁迫。磷是核酸、磷脂、核苷酸的关键成分,在代谢中发挥重要作用[40] ;钾是40多种酶的辅助因子,是形成细胞膨胀和维持细胞内电中性的主要阳离子[41] 。本研究发现,随着黑木相思地上部分硼含量的积累,磷和钾元素的吸收也相应增加。前人关于硼和磷[42-43] 、硼和钾[44] 的联合施用对作物生长发育影响已进行大量研究。早在1974年,Robertson和Loughman[13] 就已经证明,缺硼会阻碍磷的吸收,而充足的硼供应会增加植物对磷的吸收。这可能是因为硼含量对植物体内质膜的特性及质膜结合质子泵核苷酸(ATP)酶的活性产生影响,直接或间接地调节质子运输,缺硼降低了植物对磷和钾的吸收和运输,而硼供应增强了膜结合ATP酶的活性,可以促进磷和钾元素的积累[45] 。过去普遍认为硼钙间存在拮抗作用[46] ,但随着研究的深入,研究者发现硼钙之间存在着错综复杂的关系[47] ,钙和硼功能类似,可以结合在果胶的不同位点上,二者共同作用维持细胞壁结构的稳定性。本研究中,在0、1和2 mmol·L−1供硼量下,黑木相思地上部分钙元素含量均显著低于0.1 mmol·L−1供硼量下的。缺硼环境下植株地上部分钙含量较低,可能是因为钙是不易移动的元素,植株吸收的钙被根系固定,较少被地上部生长利用;而在硼浓度较高环境下钙含量较低,可能是因为过量的硼供应导致钙在细胞壁中的结合位点减少,因此钙吸收量减少。不同硼胁迫环境下,不同物种体内各元素的积累模式会有所不同,如在硼过量情况下,麻风树叶片中钾、镁的浓度增加,而磷浓度略有下降[34] ,与我们的研究结果有所不同。因此,不同供硼量条件下,植物对氮、磷、钾、钙、镁等营养元素的吸收及平衡机制,有待深入探讨。
主成分分析作为基础的数学分析方法,应用十分广泛。在具有多个变量时,变量之间的相关性会对分析造成一定的复杂性。本研究将17个具显著性差异的指标结果经过主成分分析,转化成两个不相关变量(累计贡献率为94.80%),以减弱指标之间的相关性带来的影响。根据特征向量系数得出,钾元素含量、叶片数增长量、株高增长量、LOX活性、AsA含量、钙元素含量、硼元素含量、POD活性、Pro含量、SOD活性、根长增长量、蛋白浓度、PAL活性及叶绿素b含量的荷载量较高。因此,可将这14个指标作为硼胁迫影响黑木相思生长发育的主要指标,为进一步研究黑木相思抵御硼胁迫的机理提供理论参考。另外,通过主成分综合得分和隶属函数值均得出,黑木相思的生长发育受胁迫程度排序为供硼量B2>B1>B0>B0.1,最终判定0.1 mmol·L−1供硼量时黑木相思幼苗生长发育表现最好。
-
总之,本研究表明硼胁迫抑制了黑木相思茎的伸长和根系的发育,使得叶片失绿、黄化甚至脱落;降低了黑木相思地上部分叶绿素的含量,从而抑制了光合作用;降低了黑木相思体内AsA的含量,引起了氧化反应,增加了MDA和Pro含量,引起体内脂质氧化水平升高和渗透胁迫;受硼胁迫后,黑木相思体内SOD、POD、CAT、LOX和PAL的活性较高,引发了氧自由基和H2O2的积累与清除以及次生代谢物的合成。另外,黑木相思体内硼元素的积累可以促进磷和钾元素的积累;在硼元素促进植株生长的条件下,也可以促进钙元素的积累。综合分析表明,钾元素含量、叶片数增长量、株高增长量、LOX活性、AsA含量、钙元素含量、硼元素含量、POD活性、Pro含量、SOD活性、根长增长量、蛋白浓度、PAL活性及叶绿素b含量这14个指标可作为硼胁迫影响黑木相思生长发育的主要指标。本研究揭示了黑木相思对硼胁迫环境的响应模式,为黑木相思硼营养诊断和栽培管理提供了科学依据,同时也为阐明林木对硼胁迫的抵御机理奠定了理论基础。
硼对黑木相思幼苗生长发育的影响
Effects of Boron on the Growth and Development of Acacia melanoxylon R.Br. seedlings
-
摘要:
目的 研究不同供硼量培养条件下,黑木相思生长指标、生理生化特性和营养元素含量的变化,揭示黑木相思对硼胁迫环境的响应模式。 方法 以1月龄黑木相思无性系SR17幼苗为材料,利用含0、0.1、1、2 mmol·L−1硼酸的营养液培养2个月后,测定黑木相思的生长指标、叶绿素含量、生理活性物质含量、氧化还原酶活性和营养元素含量等生理生化指标的变化,基于主成分与隶属函数分析,综合评价各指标对黑木相思响应不同供硼量的贡献率,比较黑木相思幼苗对不同供硼量的适应性。 结果 试验结果表明,0、1和2 mmol·L−1供硼量抑制了黑木相思幼苗株高和根长的增加,降低了地上部分叶绿素的含量,引起叶片失绿、黄化甚至脱落的表型。0 mmol·L−1供硼量使黑木相思的主根和侧根呈白色且增粗,1 、2 mmol·L−1供硼量使根系褐化。0、1、2 mmol·L−1供硼量降低了黑木相思体内抗坏血酸(AsA)的含量,引起了氧化反应;增加了丙二醛(MDA)和脯氨酸(Pro)含量,引起体内脂质氧化水平升高和渗透胁迫;增加了体内超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、脂氧合酶(LOX)和苯丙氨酸解氨酶(PAL)的活性,引发了氧自由基和过氧化氢(H2O2)的积累与清除以及次生代谢物的合成。黑木相思体内硼元素含量增加,磷和钾元素的含量也随之增加,而钙元素含量在 0.1 mmol·L−1供硼量下最高。通过主成分和隶属函数分析,钾元素含量、叶片数增长量、株高增长量、LOX活性、AsA含量、钙元素含量、硼元素含量、POD活性、Pro含量、SOD活性、根长增长量、蛋白浓度、PAL活性及叶绿素b含量14个指标可作为黑木相思生长发育响应硼胁迫的主要指标。 结论 黑木相思幼苗在0.1mmol·L−1供硼量下生长势较好,其生长指标、生理生化特性和营养元素含量在不同供硼量条件下差异显著,黑木相思通过调控植株表型、生理活性物质含量、氧化还原酶活性和营养元素含量响应硼胁迫。 Abstract:Objective To study the changes of growth indicators, physiological and biochemical characteristics, and nutrient element content of Acacia melanoxylon R.Br. under different boron content, and reveal the response mode of A.melanoxylon to boron stress environment. Method The A.melanoxylon clone SR17 1-month-old seedlings were cultured with nutrient solution containing 0 , 0.1, 1, and 2 mmol·L−1 boric acid for 2 months. The changes in the physiological and biochemical indexes, such as growth index, chlorophyll content, physiologically active substances content, oxidoreductase activity, and nutrient element content, were determined under each culture condition. Based on principal component and subordinate function analysis, the contribution rate of each index for A.melanoxylon response to different contribution boron content was comprehensively evaluated, and the stress degree of A.melanoxylon seedlings with different boron supply levels was compared. Result The results showed that 0, 1, and 2 mmol·L−1 boron supply inhibited the increase of plant height and root length, reduced the aboveground chlorophyll content, and caused leaf degreenization, yellowing, and even abruption phenotypes. 0 mM boron made the primary and lateral roots white and thickened, 1 and 2 mmol·L−1 boron made the roots brown. The dosages of 0 , 1, and 2 mmol·L−1 boron reduced the content of ascorbic acid (AsA) and caused an oxidation reaction. The contents of malondialdehyde (MDA) and proline (Pro) were increased, leading to increased lipid oxidation levels and osmotic stress. It increased the activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), lipoxygenase (LOX), and phenylalanine ammonlyase (PAL) in vivo, leading to the accumulation and removal of oxygen-free radicals and hydrogen peroxide (H2O2) as well as the synthesis of secondary metabolites. The increases of boron content of A.melanoxylon promoted the increase of phosphorus and potassium content, and the calcium content was the highest under 0.1 mmol·L−1 boron supply. Through principal component and subordinate function analysis, fourteen indexes, including potassium content, leaf number increase, plant height increase, LOX activity, AsA content, calcium content, boron content, POD activity, Pro content, SOD activity, root length increase, protein concentration, PAL activity, and chlorophyll b content, could be used as the main indexes of A.melanoxylon growth and development response to boron stress. Conclusion A.melanoxylon seedlings grow better under 0.1mmol·L−1 boron supply, and their growth indicators, physiological and biochemical characteristics, and nutrient element content are significantly different under different boron supply conditions. A.melanoxylon responds to boron stress by regulating plant phenotype, the content of physiologically active substances, oxidoreductase activity, and nutrient element content. -
表 1 综合评价主成分指标系数及贡献率
Table 1. Principal components eigenvectors and cumulative contribution rates
项目
Item主成分1
Prin.1主成分2
Prin.2钾含量 K content −0.98 −0.12 叶片数增长量 Leave number growth −0.98 −0.19 株高增长量 Plant height growth −0.97 0.24 脂氧合酶活性 LOX activity 0.96 0.26 抗坏血酸含量 AsA content −0.95 −0.19 钙含量 Ca content 0.92 0.37 硼含量B content 0.92 −0.31 过氧化物酶活性 POD activity 0.92 −0.23 脯氨酸含量 Pro content 0.91 −0.32 超氧化物歧化酶活性 SOD activity −0.88 −0.36 根长增长量 Root growth −0.88 0.39 蛋白浓度 Protein concentration 0.84 −0.51 苯丙氨酸解氨酶活性 PAL activity 0.81 −0.55 磷含量 P content 0.75 0.37 叶绿素a含量 Chlorophyll a content 0.74 0.67 叶绿素b含量 Chlorophyll b content −0.49 0.87 过氧化氢酶活性 CAT activity 0.67 0.75 特征值 Eigenvalues 12.77 3.34 方差贡献率/%
Variance contribution rate75.14 19.66 累计贡献率/%
Cumulative contribution rate75.14 94.80 表 2 不同供硼量条件下各指标的主成分和隶属函数分析及综合评价
Table 2. Comparison and comprehensive evaluation of the subordinate function values under different boric acid supply
指标
ItemF1 F2 F U(F1) U(F2) D 排名
RankedB0 −1.53 −2.48 −1.73 0.29 0 0.23 3 B0.1 −3.96 1.25 −2.87 0 0.99 0.21 4 B1 1.13 1.29 1.16 0.61 1 0.69 2 B2 4.36 −0.07 3.43 1 0.64 0.92 1 权重Index weight 0.79 0.21 注: F1, F2 分别代表相互独立的综合指标得分,F代表主成分综合得分; U(F1)、U(F2)分别代表各综合指标的隶属函数值,D代表主成分和隶属函数分析的综合评价值
Notes: F1, F2 represent independent comprehensive index, respectively; U(F1)、U(F2) represent the subordinate function values of comprehensive index, respectively; D represents the comprehensive evaluation value of principal component and subordinate function analysis -
[1] GARCÍA-SÁNCHEZ F, SIMÓN-GRAO S, MARTÍNEZ-NICOLÁS J J, et al. Multiple stresses occurring with boron toxicity and deficiency in plants[J]. Journal of Hazardous Materials, 2020, 397: 122713. doi: 10.1016/j.jhazmat.2020.122713 [2] 徐芳森, 王运华. 我国作物硼营养与硼肥施用的研究进展[J]. 植物营养与肥料学报, 2017, 23(6):1556-1564. [3] BRDAR-JOKANOVIĆ M. Boron toxicity and deficiency in agricultural plants[J]. International Journal of Mmolecular Sciences, 2020, 21(4): 1424. doi: 10.3390/ijms21041424 [4] MCCAULEY A, JONES C, JACOBSEN J. Plant nutrient functions and deficiency and toxicity symptoms[J]. Nutrient Management Module, 2009, 9: 1-16. [5] SHAH A, WU X, ULLAH A, et al. Deficiency and toxicity of boron: Alterations in growth, oxidative damage and uptake by citrange orange plants[J]. Ecotoxicology and Environmental Safety, 2017, 145: 575-582. doi: 10.1016/j.ecoenv.2017.08.003 [6] TEWARI R K, KUMAR P, SHARMA P N. Morphology and oxidative physiology of boron-deficient mulberry plants[J]. Tree Physiology, 2010, 30(1): 68-77. doi: 10.1093/treephys/tpp093 [7] MMOLASSIOTIS A, SOTIROPOULOS T, TANOU G, et al. Boron-induced oxidative damage and antioxidant and nucleolytic responses in shoot tips culture of the apple rootstock EM 9 (Malus domestica Borkh)[J]. Environmental and Experimental Botany, 2006, 56(1): 54-62. doi: 10.1016/j.envexpbot.2005.01.002 [8] WANG J Z, TAO S T, QI K J, et al. Changes in photosynthetic properties and antioxidative system of pear leaves to boron toxicity[J]. African Journal of Biotechnology, 2011, 10(85): 19693-19700. [9] KELES Y, ÖNCEL I, YENICE N. Relationship between boron content and antioxidant compounds in Citrus leaves taken from fields with different water source[J]. Plant and Soil, 2004, 265(1/2): 345-353. [10] KRUEGER R W, LOVATT C J, ALBERT L S. Metabolic requirement of Cucurbita pepo for boron[J]. Plant physiology, 1987, 83(2): 254-258. doi: 10.1104/pp.83.2.254 [11] RUIZ J M, BRETONES G, BAGHOUR M, et al. Relationship between boron and phenolic metabolism in tobacco leaves[J]. Phytochemistry, 1998, 48(2): 269-272. doi: 10.1016/S0031-9422(97)01132-1 [12] AHMED N, ABID M, AHMAD F, et al. Impact of boron fertilization on dry matter production and mineral constitution of irrigated cotton[J]. Pakistan Journal of Botany, 2011, 43(6): 2903-2910. [13] ROBERTSON G A, LOUGHMAN B C. Reversible effects of boron on the absorption and incorporation of phosphate in Vicia faba L[J]. New Phytologist, 1974, 73(2): 291-298. doi: 10.1111/j.1469-8137.1974.tb04762.x [14] TEASDALE R D, RICHARDS D K. Boron deficiency in cultured pine cells: Quantitative studies of the interaction with Ca and Mg[J]. Plant Physiology, 1990, 93(3): 1071-1077. doi: 10.1104/pp.93.3.1071 [15] MACHADO J S, LOUZADA J L, SANTOS A J A, et al. Variation of wood density and mechanical properties of blackwood (Acacia melanoxylon R. Br. ) [M]. Materials & Design (1980-2015), 2014, 56: 975-980. [16] WANG Y, SHI L, CAO X, et al. Plant boron nutrition and boron fertilization in China[M]. Advances in Plant and Animal Boron Nutrition, 2007: 93-101. [17] Chernobrovkina N P, Robonen E V, Akhmetova G V, et al. Nitrogen and boron dosage effects on arginine accumulation in Scots pine needles[J]. Forests, 2022, 13(3): 417. doi: 10.3390/f13030417 [18] HODECKER B E R, DE BARROS N F, DA SILVA I R, et al. Boron delays dehydration and stimulates root growth in Eucalyptus urophylla (Blake, ST) under osmotic stress[J]. Plant and Soil, 2014, 384(1-2): 185-199. doi: 10.1007/s11104-014-2196-4 [19] KILPELÄINEN J, RÄISÄNEN M, MEHTÄTALO L, et al. The longevity of Norway spruce responses to boron fertilization[J]. Forest Ecology and Management, 2013, 307: 90-100. doi: 10.1016/j.foreco.2013.06.054 [20] YıLDıRıM K, KASıM G Ç. Phytoremediation potential of poplar and willow species in small scale constructed wetland for boron removal[J]. Chemosphere, 2018, 194: 722-736. doi: 10.1016/j.chemosphere.2017.12.036 [21] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000. [22] KRUGER N J. The Bradford method for protein quantitation[J]. Methods Mol Biol, 1994, 32: 9-15. [23] HEATH R L, PACKER L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics, 1968, 125(1): 189-198. doi: 10.1016/0003-9861(68)90654-1 [24] BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water-stress studies[J]. Plant and Soil, 1973, 39(1): 205-207. doi: 10.1007/BF00018060 [25] TAKAHAMA U, ONIKI T. Regulation of peroxidase-dependent oxidation of phenolics in the apoplast of spinach leaves by ascorbate[J]. Plant and Cell Physiology, 1992, 33(4): 379-387. [26] BEYER JR W F, FRIDOVICH I. Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions[J]. Analytical Biochemistry, 1987, 161(2): 559-566. doi: 10.1016/0003-2697(87)90489-1 [27] RAO M V, PALIYATH G, ORMROD D P. Ultraviolet B and ozone induced biochemical changes in antioxidant enzymes of Arabidopsis thaliana[J]. Plant Physiology, 1996, 110(1): 125-136. doi: 10.1104/pp.110.1.125 [28] MACADAM J W, NELSON C J, SHARP R E. Peroxidase activity in the leaf elongation zone of tall fescue: I. Spatial distribution of ionically bound peroxidase activity in genotypes differing in length of the elongation zone[J]. Plant Physiology, 1992, 99(3): 872-878. doi: 10.1104/pp.99.3.872 [29] WANG Y S, TIAN S P, XU Y. Effects of high oxygen concentration on pro-and anti-oxidant enzymes in peach fruits during postharvest periods[J]. Food Chemistry, 2005, 91(1): 99-104. doi: 10.1016/j.foodchem.2004.05.053 [30] ROSLER J, KREKEL F, AMRHEIN N, et al. Maize phenylalanine ammonia-lyase has tyrosine ammonia-lyase activity[J]. Plant Physiology, 1997, 113(1): 175-179. doi: 10.1104/pp.113.1.175 [31] 何晓群. 多元统计分析(第四) [M]. 北京: 中国人民大学出版社, 2015. [32] WU X, LIU G, RIAZ M, et al. Metabolic changes in roots of trifoliate orange [Poncirus trifoliate (L. ) Raf. ] as induced by different treatments of boron deficiency and resupply[J]. Plant and Soil, 2019, 434(1-2): 217-229. doi: 10.1007/s11104-018-3684-8 [33] GUNES A, SOYLEMEZOGLU G, INAL A, et al. Antioxidant and stomatal responses of grapevine (Vitis vinifera L. ) to boron toxicity[J]. Scientia Horticulturae, 2006, 110(3): 279-284. doi: 10.1016/j.scienta.2006.07.014 [34] SIMÓN I, DÍAZ‐LÓPEZ L, GIMENO V, et al. Effects of boron excess in nutrient solution on growth, mineral nutrition, and physiological parameters of Jatropha curcas seedlings[J]. Journal of Plant Nutrition and Soil Science, 2013, 176(2): 165-174. doi: 10.1002/jpln.201100394 [35] LEHTO T, RUUHOLA T, DELL B. Boron in forest trees and forest ecosystems[J]. Forest Ecology and Management, 2010, 260(12): 2053-2069. doi: 10.1016/j.foreco.2010.09.028 [36] WU X, RIAZ M, YAN L, et al. Boron deficiency in trifoliate orange induces changes in pectin composition and architecture of components in root cell walls[J]. Frontiers in Plant Science, 2017, 8: 1882. doi: 10.3389/fpls.2017.01882 [37] LI M, ZHAO Z, ZHANG Z, et al. Effect of boron deficiency on anatomical structure and chemical composition of petioles and photosynthesis of leaves in cotton (Gossypium hirsutum L.)[J]. Scientific Reports, 2017, 7(1): 4420. doi: 10.1038/s41598-017-04655-z [38] SUPANJANI L K D, LEE K D. Hot pepper response to interactive effects of salinity and boron[J]. Plant Soil and Environment, 2006, 52(5): 227-233. doi: 10.17221/3433-PSE [39] HEGAZI E S, EL-MOTAIUM R A, YEHIA T A, et al. Effect of foliar boron application on boron, chlorophyll, phenol, sugars and hormones concentration of olive (Olea europaea L. ) buds, leaves, and fruits[J]. Journal of Plant Nutrition, 2018, 41(6): 749-765. doi: 10.1080/01904167.2018.1425438 [40] LAMBERS H, PLAXTON W C. Phosphorus: back to the roots[J]. Annual Plant Reviews, 2015, 48: 3-22. [41] WANG M, ZHENG Q, SHEN Q, et al. The critical role of potassium in plant stress response[J]. International Journal of Mmolecular Sciences, 2013, 14(4): 7370-7390. doi: 10.3390/ijms14047370 [42] IRFAN M, ABBAS M, SHAH J A, et al. Interactive effect of phosphorus and boron on plant growth, nutrient accumulation and grain yield of wheat grown on calcareous soil[J]. Eurasian Journal of Soil Science, 2019, 8(1): 17-26. [43] KAYA C, TUNA A L, DIKILITAS M, et al. Supplementary phosphorus can alleviate boron toxicity in tomato[J]. Scientia Horticulturae, 2009, 121(3): 284-288. doi: 10.1016/j.scienta.2009.02.011 [44] ZARE M, ZADEHBAGHERI M, AZARPANAH A. Influence of potassium and boron on some traits in wheat (Triticum aestivum cv. Darab2)[J]. The International Journal of Biotechnology, 2013, 2(8): 141-153. [45] CAKMAK I, RÖMHELD V. Boron deficiency-induced impairments of cellular functions in plants[J]. Plant and Soil, 1997, 193(1/2): 71-83. [46] REEVE E, SHIVE J W. Potassium-boron and calcium-boron relationships in plant nutrition[J]. Soil Science, 1994, 57(1): 1-14. [47] LIU Y, RIAZ M, YAN L, et al. Boron and calcium deficiency disturbing the growth of trifoliate rootstock seedlings (Poncirus trifoliate L. ) by changing root architecture and cell wall[J]. Plant Physiology and Biochemistry, 2019, 144: 345-354. doi: 10.1016/j.plaphy.2019.10.007 -




 下载:
下载: