-
孑遗植物水松(Glyptostrobus pensilis (Staunton ex D. Don) K. Koch)又名水帝松、水杉松、水枞等,是杉科水松属中的唯一物种[1];水松因其古老而珍贵的基因被誉为植物界的活化石,具有极高的科研价值。水松曾是北半球的重要物种,广泛分布于北半球[2],但第四纪冰期以来,其种群迅速衰弱,正面临灭绝风险[3],目前已被列为国家一级濒危保护植物,被国际自然资源保护联盟(IUCN)列为极危种。水松相关研究在质量和数量上远落后于其他杉科乔木,为数不多的研究集中在种群生态学和遗传生态学等领域,至今仍未见根际微生物群落的报道。
根际土壤是指植物根系周围数毫米范围内受根系活动强烈影响的土壤,是根系-土壤-微生物互作的主要区域[4-5]。虽然前人对植物根际开展过大量研究,但它仍是一个蕴藏着庞大未知信息的“黑匣子”[6]。根际微生物是根际土壤中最活跃的部分,是土壤中有机质转化和养分元素循环的引擎[7-9],是物质循环和能量流动的主要驱动因素。近年来,因根际微生物的重要性逐渐受到学界广泛重视,有学者将根际微生物称为“植物的第二基因组”,认为应该将植物和根际微生物视作一个宏生物体来研究[5]。与肠道菌群类似,植物根际微生物群落也由数量庞大,种类繁多,功能各异的微生物组成,它们参与并影响着植物的养分吸收和抗逆性调节过程,在植物生命的全过程都扮演重要角色,发挥关键作用。植物能通过定向招募具有特定功能的微生物组以增强其特定功能,例如招募特基拉芽孢杆菌、丛植菌根真菌能够促进植物生长、提高植物的抗旱性[10]及养分吸收能力[11-13] 。根际微生物群落灾变则会引起一系列病害,导致植物生产力下降甚至死亡。因此根际微生物群落健康和多样性对土壤生态系统服务的功能和稳定性至关重要[7],是土壤肥力和健康评价的重要指标。
土壤微生物群落的研究方法众多,传统平板培养法只能对0.1%~10%的土壤微生物进行研究[14],具有较大局限性。随着分子生态学技术的发展,PCR-DGGE和Biolog-ECO微平板等能够忽略微生物培养限制的研究技术逐渐取代了传统方法,并被广泛应用于生态学研究[15-17]。变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)以甲酰胺和尿素为变性剂,将不同长度和碱基序列的DNA片段分离,染色处理后能够获取微生物群落结构信息,具有操作简便、检测阈值低、重复性高和结果准确可靠等优点。Srivastava等[18]利用DGGE技术揭示了印度稻田土壤微生物群落的优势菌群及其与土壤理化性质间的相关性规律。Biolog Eco微平板法通过量化微生物群落对31种碳源代谢能力获取其特定的“代谢指纹”,能够表征微生物群落的碳代谢特征,具有操作简便,灵敏度高等优点。Feigl等[19]利用Biolog-ECO微平板监测赤泥添加对土壤微生物群落碳代谢特征的影响,确定了合适赤泥添加比例。
基于此,本研究以不同季节水松为研究对象,从根际-土壤-微生物角度切入,采用PCR-DGGE和Biolog-ECO微平板等技术对水松根际微生物群落特征及其季节动态变化规律开展研究,揭示不同季节水松根际微生物群落结构和碳代谢功能特征,寻找根际微生态中驱动根际微生物群落变化的关键环境因子,为水松进一步的研究提供有益理论参考。
-
本试验采样地点位于福建省宁德市屏南县上楼村(26°58′ N,118°57′ E),闽东北鹫峰山脉中段,东峰尖北麓的一片沼泽地中,该林是世界上林地面积最大、种群数量最多的天然水松林。林中生长着72株水松,胸径多在40~70 cm之间,树高多为15~20 m,平均树龄约为418岁。该区域属亚热带季风气候,年平均气温为15 ℃,年积温5 214.2 ℃,年平均降水量约为1 800 mm,气候温暖湿润,雨水充沛,四季分明,冬无严寒,夏无酷暑。水松林位于山谷地带,林下土壤细腻肥沃,植被物种丰富,伴生植物有柳杉(Cryptomeria fortunei Hooibrenk ex Otto et Dietr.)、马尾松(Pinus massoniana Lamb.)等。
-
参考吴则焰[20]的调查结果,选择5株具有代表性的(长势良好,胸径20~60 cm之间)水松为研究对象,表征林中72棵水松。分别于2021年12月25日(冬季)、2022年3月16日(春季)、2022年6月12日(夏季)和2022年9月30日(秋季)采集土壤样品。用铲子去除土壤表面的腐质层,挖取0~20 cm深度的水松根系,轻轻抖落表面土壤,收集附着在根系上的土壤为根际土壤,于室内风干至可过筛状态,除去残留的根系和小石子,置于4 ℃冰箱保存,用于后续试验测定。
-
含水量采用烘箱烘干法测定;pH采用电位法(水土比为2.5: 1)测定;速效氮(AN)采用碱扩散法测定;速效磷(AP)采用NaHCO3法测定;速效钾(AK)采用醋酸铵-火焰光度法测定;土壤以HClO4-H2SO4法处理后,全氮(TN)和全磷(TP)采用全自动间断化学分析仪测定,全钾(TK)采用火焰光度法测定。具体步骤参照鲍士旦[21]的方法。
-
纤维素酶和蔗糖酶采用3, 5-二硝基水杨酸比色法测定;脲酶采用苯显色法测定;酸性磷酸酶采用对硝基苯磷酸二钠比色法测定;过氧化氢酶采用高锰酸钾滴定法测定。具体步骤参照关松荫[22]的方法。
-
微生物量碳、氮含量的测定采用氯仿熏蒸法。具体步骤参照吴金水[23]的方法。
-
使用土壤DNA提取试剂盒(OMEGA,美国)提取土壤DNA。PCR反应体系均为50 μL: 1.25 μL 100 mol·L−1上下游引物,25 μL 2 × Hieff® Robust PCR Master Mix,10 ng DNA模板,ddH2O补齐至50 μL。细菌第一轮PCR引物为27F和1 492R[24],PCR扩增程序:95 ℃预变性5 min; 95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃终延伸5 min。第二轮PCR引物为GC-357F(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGG GCACGGGGGGCCTACGGGAGGCAGCAG-3′)和518R(5′-ATTACCGCGGCTGCTGG-3′),PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,48 ℃退火30 s,72 ℃延伸30 s,循环35次;72 ℃终延伸5 min。真菌PCR引物为GC-Fung(5′-CGCCCGCCGCGCCCCGCGCCGGCCCGCCGCCCCCGCCCCATTCCCCGTTACCCGTTG-3′)和NS1(5′-GTAGTCA TATGCTTGTCTC-3′),PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,循环35次;72 ℃终延伸10 min。使用胶回收试剂盒(OMEGA,美国)回收目的基因。细菌凝胶的变性梯度为45%~60%,丙烯酰胺凝胶强度为8%,在80 V,60 ℃条件下电泳12 h。染色采用银染法:①加入固定液(10%乙醇,0.5% 冰醋酸),100 r·min−1振荡15 min,用双蒸水清洗;②加入染色液(AgNO3 0.2%,甲醛 0.1%),避光条件下100 r·min−1振荡15 min,用双蒸水清洗;③加入显色液(NaOH 1.5%,甲醛0.1%),100 r·min−1振荡15 min,用双蒸水清洗。使用凝胶成像仪(BIO-RAD,美国)扫描凝胶图片。使用软件Quantity One将图片信息转化为数字信息。条带DNA转入Trans-T1 Phage Resistant化学感受态细胞后送公司(生工,上海,中国)测序,使用NCBI数据库比对测序结果。
-
称取10 g(精确至0.001 g)土壤加入至50 mL 0.85% NaCl溶液中,摇床中30 ℃,200 r·min−1振荡30 min。冰浴静置5 min。吸取5 mL上层浸提液,加入至45 mL 0.85% NaCl溶液中,重复稀释制得1:1000提取液。向Biolog-ECO微平板的各孔中加入150 μL 1:1000土壤浸提液。30 ℃避光培养168 h,每隔24 h使用酶标仪读取各孔在590 nm处的吸光值用于数据分析。
-
在软件SPSS 19中采用Duncan (D) 法进行单因素方差分析以检验样本显著性差异。使用ORIGIN 2021 pro绘制柱状图;使用软件STAMP v2.1.3分别以微生物类群相对丰度和31种碳源在168 h处的吸光值为数据进行主成分分析;使用软件TBtools以微生物类群相对丰度为数据进行热图分析;使用软件Canoco 5以微生物类群相对丰度和土壤理化性质为数据进行冗余分析。
-
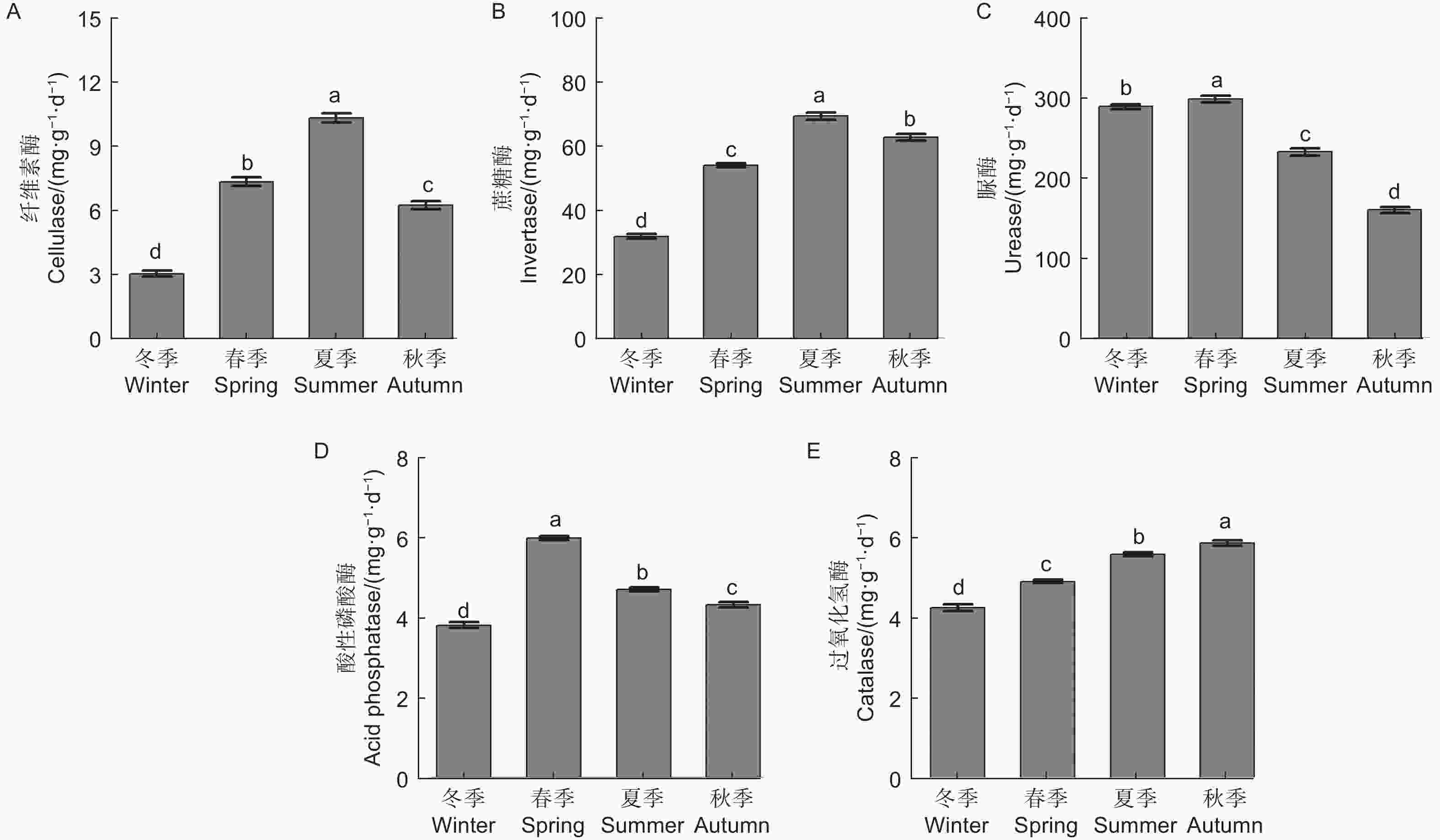
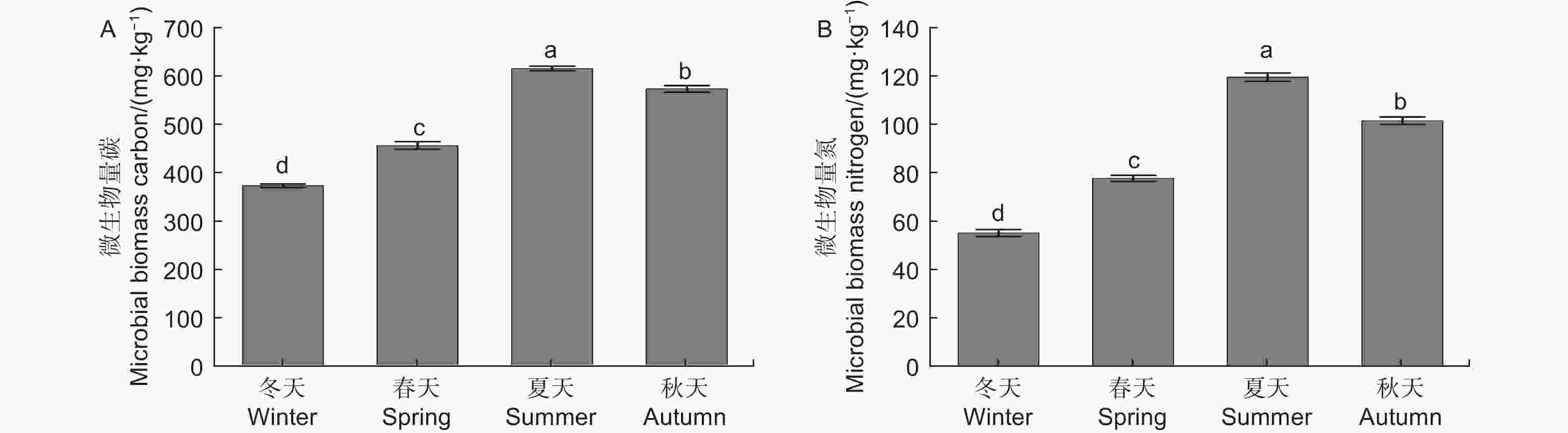
微生物量碳、氮测定结果(图1)显示,不同季节水松根际土壤微生物量碳和微生物量氮含量表现为夏季>秋季>春季>冬季,不同季节间差异显著,说明水松根际的微生物数量在夏季最高,在冬季最低。水松根际土壤纤维素酶和蔗糖酶在夏季最高,在冬季最低,说明夏季根际微生物的有机质代谢能力最强土壤有机质的降解速率在夏季最高。脲酶和酸性磷酸酶活性在春季最高,说明土壤中含氮、磷化合物的矿化速率在春季最高。过氧化氢酶活性在秋季最高,说明根际土壤的抗氧化能力和抗逆性在秋季最强(图2)。
-
PCR产物的检测结果(图3A~D)显示,条带明亮清晰且长度与预期相符,说明扩增成功。从水松根际微生物的PCR-DGGE图谱(图3E、F)中各选取45和9个条带,由上至下进行编号,依次分别为X-1至X-45和Z-1至Z-9。主成分分析结果(图4A、B)显示,不同季节水松根际的细菌和真菌群群落差异均显著。从水松根际土壤中共鉴定到35种细菌和5种真菌,在纲水平上可将细归为11个微生物类群,分别为酸杆菌(Acidobacteria),α-变形菌(Alphaproteobacteria)、β-变形菌(Betaproteobacteria)、δ-变形菌(Deltaproteobacteria)、厚壁菌(Firmicutes)、γ-变形菌(Gammaproteobacteria)、纤线杆菌(Ktedonobacteria)、硝化螺旋菌(Nitrospirae)、Oligoflexi、Saccharibacteria和其他类群。细菌群落中的优势类群为α-变形菌(Alphaproteobacteria)、酸杆菌(Acidobacteria)和δ-变形菌(Deltaproteobacteria)(表1);将真菌归为4个微生物类群,分别为座囊菌(Dothideomycetes)、锤舌菌(Leotiomycetes)、粪壳菌(Sordariomycetes)和银耳菌(Tremellomycetes),其中真菌群落中的优势类群为粪壳菌(Sordariomycetes)(表1)。聚类分析结果(图4C、D)显示,夏季与秋季的根际细菌群落较为接近,春季与冬季的根际细菌群落较为接近。春季与冬季的真菌群落较为接近,秋季与其他季节的真菌群落差异最大。
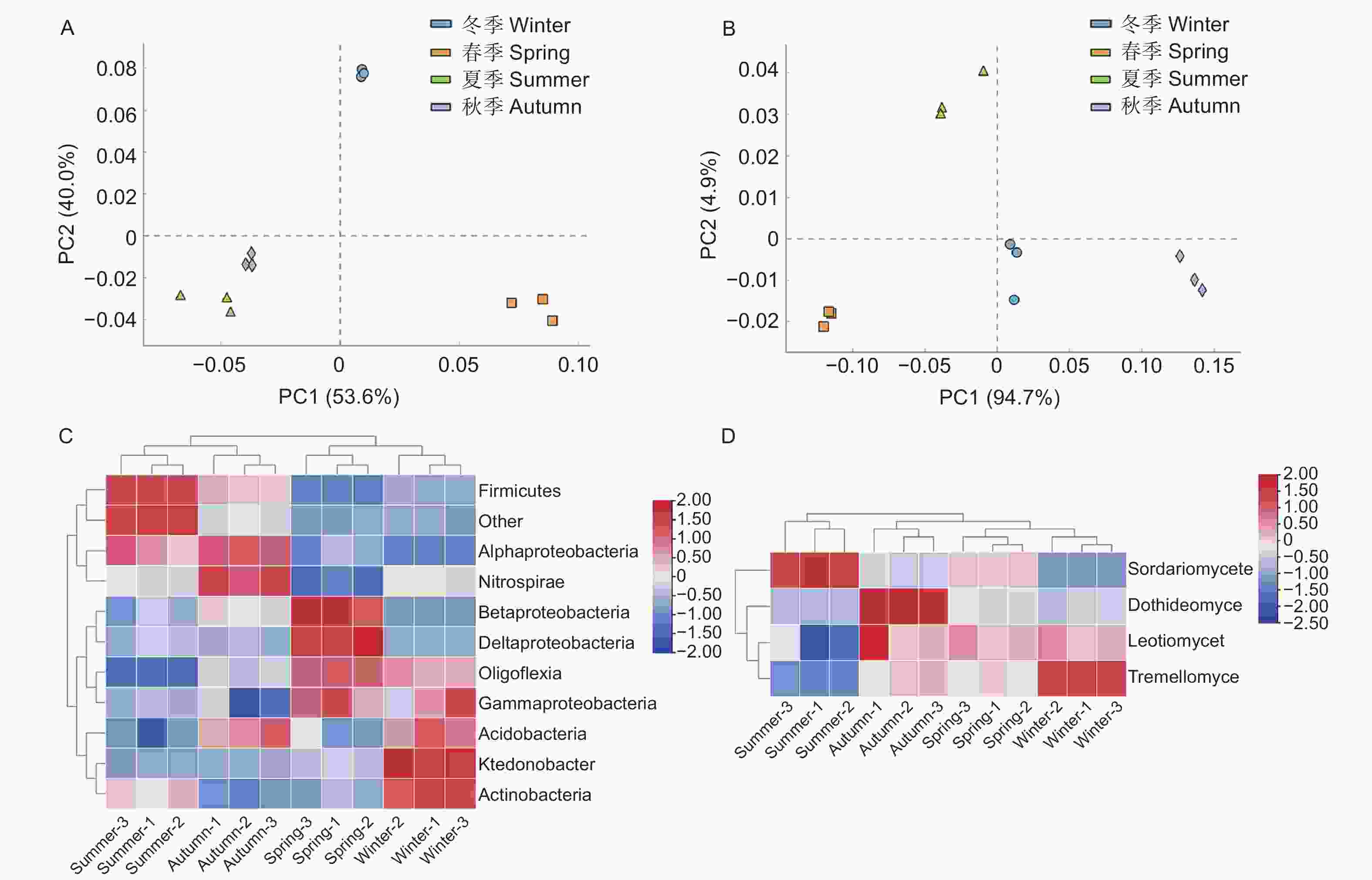
图 4 对不同微生物类群丰度作主成分分析和热图分析
Figure 4. Principal component analysis and redundancy analysis of the abundance of different microbial taxa
表 1 根际微生物类群相对丰度
Table 1. Relative abundance of rhizosphere microbial groups
% 界
Kingdom纲
Class冬季
Winter春季
Spring夏季
Summer秋季
Autumn细菌 Bacteria Alphaproteobacteria 37.69 b 38.58 b 41.83 a 42.96 a Acidobacteria 22.64 a 20.36 b 19.54 b 22.48 a Deltaproteobacteria 13.66 b 24.29 a 14.69 b 14.17 b Firmicutes 6.44 c 4.83 d 13.11 a 9.77 b Betaproteobacteria 3.35 d 4.53 a 3.48 c 3.80 b Ktedonobacteria 9.36 a 2.03 b 0.48 d 1.01 c Actinobacteria 2.32 a 1.12 c 1.64 b 0.89 d Other 1.04 c 0.93 c 3.60 a 1.64 b Oligoflexia 1.92 b 2.39 a 0.27 d 1.26 c Nitrospirae 0.97 b 0.27 c 0.90 b 1.63 a Gammaproteobacteria 0.61 ab 0.67 a 0.47 bc 0.40 c 真菌 Fungi Dothideomycetes 2.19 b 1.76 c 5.44 a 1.47 d Leotiomycetes 28.83 a 28.86 a 29.09 a 27.65 b Sordariomycetes 40.69 b 31.97 d 36.53 c 50.53 a Tremellomycetes 28.29 b 37.41 a 28.94 b 20.35 c 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3) -
Biolog-ECO微平板实验结果(图5)显示,AWCD值(Average well color development)均在夏季最高,在冬季最低,说明夏季水松根际微生物群落的碳代谢能力最强,冬季最弱。依据化合物的基团特性将Biolog-ECO板中的31种碳源分为6大类,分别为多聚合物类、羧酸类、糖类、酚酸类、氨基酸类和胺类,结果(图5B)显示微生物群落代谢氨基酸类碳源的能力最强,其余依次为胺类、羧酸类、糖类、多聚合物类和酚酸类碳源。水松根际微生物群落代谢羧酸类、氨基酸类、酚酸类、多聚合物类和糖类的能力在夏季最强,在冬季最弱,代谢胺类碳源的能力在秋季最强,冬季最弱。微生物多样性指数分析结果(表2)显示,Shannon指数、Brillouin指数和均匀度指数均在夏季出现最高值,说明夏季水松根际微生物的群落多样性最高。主成分分析结果(图5C)中,不同季节的样本点间距显著大于相同季节,说明不同季节水松根际微生物群落碳代谢特征差异显著。微生物群落碳代谢特征和土壤理化性质(表3)的冗余分析结果(图5D)显示,速效氮含量与根际微生物群落的碳代谢特征的相关性最强,其余依次为速效钾、速效磷、全氮、全钾、全磷、pH和含水量。
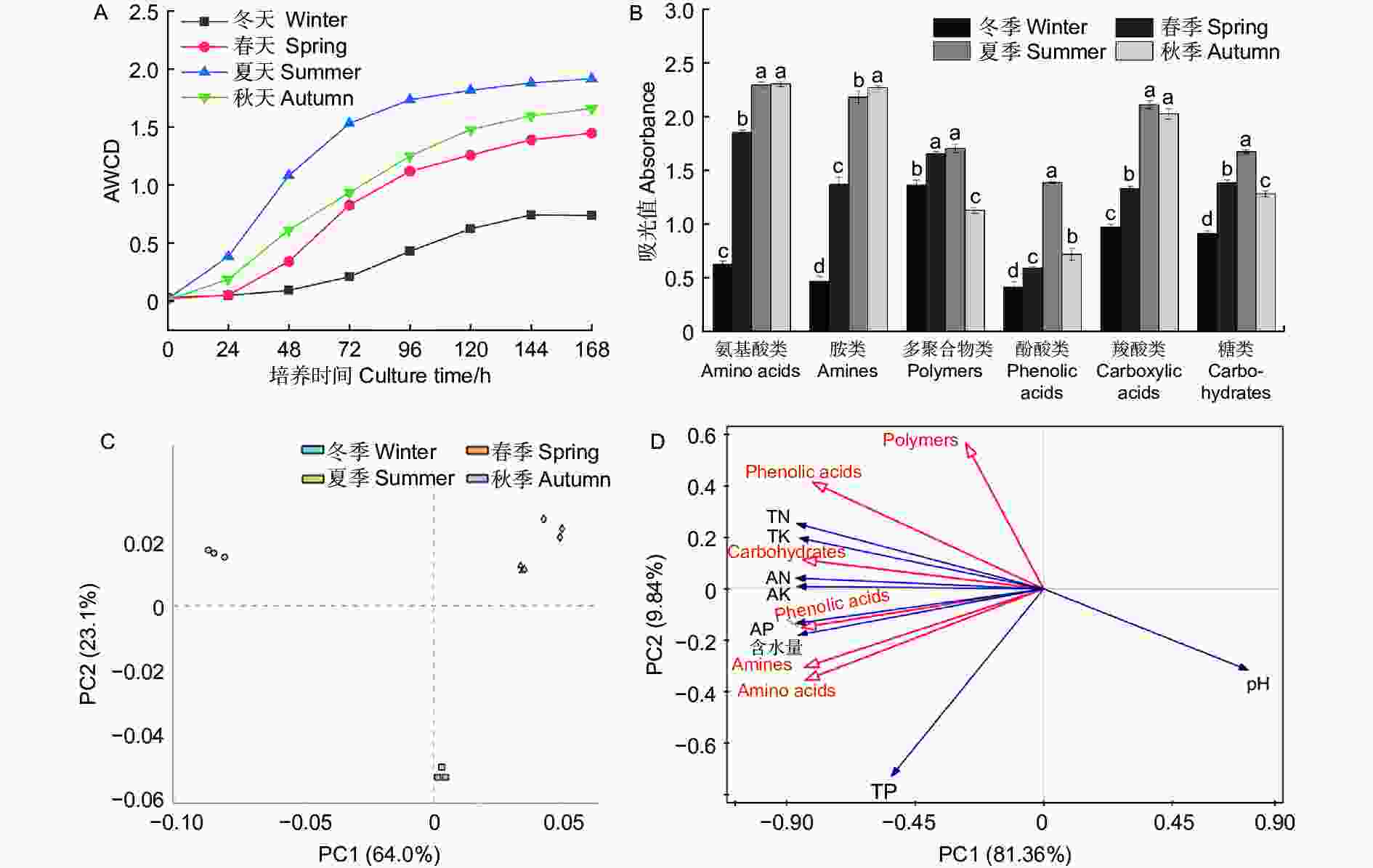
图 5 碳代谢特征及其主成分分析和冗余分析
Figure 5. Carbon metabolism characteristics and its principal component analysis and redundancy analysis
表 2 根际微生物群落多样性
Table 2. Diversity of rhizosphere microbial community
冬季
Winter春季
Spring夏季
Summer秋季
AutumnShannon 4.6537 ± 0.0137 c 4.7041 ± 0.0031 b 4.8282 ± 0.0048 a 4.7061 ± 0.0124 b Simpson 0.9913 ± 0.0006 a 0.9803 ± 0.0002 b 0.9801 ± 0.0001 b 0.9788 ± 0.0004 c 均匀度 Evenness 0.9394 ± 0.0028 c 0.9495 ± 0.0006 b 0.9746 ± 0.0010 a 0.9499 ± 0.0025 b Brillouin 3.4726 ± 0.0203 d 3.7285 ± 0.0380 c 4.0118 ± 0.0260 a 3.8496 ± 0.0366 b 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3)表 3 根际土壤理化性质
Table 3. Physical and chemical properties of rhizosphere soil
指标
Index冬季
Winter春季
Spring夏季
Summer秋季
Autumn温度 Temperature/℃ 2.85 ± 0.30 d 9.61 ± 0.32 c 14.36 ± 0.24 a 12.19 ± 0.16 b 土壤含水量 Soil water content/% 77.72 ± 1.12 b 79.68 ± 1.49 ab 81.15 ± 1.77 a 80.15 ± 0.62 ab pH 5.01 ± 0.03 a 4.75 ± 0.02 c 4.61 ± 0.02 d 4.94 ± 0.07 b 速效氮 Available nitrogen/(mg·kg−1) 200.31 ± 7.85 d 228.68 ± 15.07 c 274.87 ± 2.82 a 249.20 ± 6.51 b 速效磷 Available phosphorus/(mg·kg−1) 11.20 ± 0.14 d 14.65 ± 0.28 c 20.53 ± 0.35 a 19.41 ± 0.36 b 速效钾 Available potassium/(mg·kg−1) 221.56 ± 4.61 d 244.38 ± 2.73 c 304.31 ± 5.43 a 283.64 ± 5.90 b 全氮 Total nitrogen/(g·kg−1) 4.45 ± 0.10 d 5.66 ± 0.07 c 7.92 ± 0.27 a 6.50 ± 0.19 b 全磷 Total phosphorus/(g·kg−1) 0.66 ± 0.02 a 0.47 ± 0.03 b 0.44 ± 0.02 b 0.30 ± 0.03 c 全钾 Total potassium/(g·kg−1) 2.74 ± 0.17 c 3.39 ± 0.12 b 3.92 ± 0.07 a 3.25 ± 0.06 b 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3) -
微生物量碳、氮指构成微生物的碳、氮元素,能够反映土壤中的微生物量,也是土壤各生态转化过程中的关键驱动因子[25]。微生物量碳、氮对土壤环境变化的响应十分灵敏,被认为是评价土壤质量的良好指标[26-27]。植物与微生物经过漫长的历史演化,逐渐进化出了一套互利共生的合作模式[28],植物通过分泌物为微生物提供有机养分,而微生物通过降解有机化合物为植物提供无机养分[29],这种机制提高了植物与微生物的环境适应性[30],因此生物量的高低能够表征植物和土壤健康状况[31]。本研究中,水松根际微生物量在冬季最低,在夏季达到了最高值,说明水松根际活动在夏季最为活跃,根际土壤质量在夏季最优。其原因可能是夏季水松生长旺盛,对无机养分的需求相比冬季大大提高,因此增加了根系分泌物的分泌量,同时林地中茂盛生长植被也向土壤中输入了大量有机物,这些碳源的输入极大地丰富了土壤微生物量。这与Lepcha等[32]的研究结果相符。酶是土壤养分循环的重要驱动力,是土壤健康评价体系的重要指标之一,微生物是其重要来源之一。水松根际土壤纤维素酶和蔗糖酶活性在夏季最高,即有机养分的分解速率在夏季达到最高。本研究中的微生物量、酶活性和养分含量的季节变化规律相吻合,推测在夏季,水松通过影响土壤碳源的输入来调控根际微生物量和相关酶活性,进而改变有机质矿化速率和养分积累,提高土壤质量,使根际微生态系统生态功能与水松生长周期相协调。
-
群落结构是微生物群落主要生物学特征之一[33]。PCR-DGGE技术能够突破绝大多数微生物不可培养的限制[34],直接对土壤中的基因组进行分析,解析土壤微生物群落结构,获得微生物优势类群等重要的信息[18]。大量研究表明,土壤的生态学功能与微生物群落结构息息相关[35]。微生物群落结构变化通过影响土壤养分矿化速率[36]、土壤抑病性[37]和植物促生能力[38]等途径调控土壤微生态的生态学功能。因此微生物群落结构的解析对于加深植物理解至关重要。本研究结果显示,不同季节下水松根际微生物群落结构差异较大,但其中的优势类群较为稳定,细菌优势类群均为α-变形菌(Alphaproteobacteria)、酸杆菌(Acidobacteria)和δ-变形菌(Deltaproteobacteria),真菌优势类群均为粪壳菌(Sordariomycetes)。不同季节间水松根际微生物群落结构差异显著,说明季节因素对水松微生物群落造成了显著影响,季节因素可能通过改变根际微生物群落从而影响水松的生长发育。Marschner等[39]在其他植物研究中得到了类似结果。
-
微生物群落的碳代谢特征能够表征土壤有机质的降解能力和微生物多样性[40-41],是微生物群落关键特征之一[42]。本研究结果显示,水松根际微生物群落的碳代谢能力在夏季最强,在冬季最弱,这闫法军等[43]的研究结果类似。值得注意的是,水松根际微生物群落对氨基酸类碳源的代谢能力最强,说明水松根际微生物对氨基酸类碳源具有很强的偏好性,而氨基酸类物质是植物向土壤中分泌的大量低分子化合物之一[44-45],因此这种偏好性可能是水松对根际微生物群落定向调控结果,这体现出了水松植株与根际微生物之间的高度协调。宋贤冲等[46]也得到了类似研究结果。微生物多样性与群落的代谢能力息息相关,微生物多样性指数显示,春季和夏季的水松根际微生物群落多样性优于秋季和春季。水松根际微生物群里碳代谢特征的主成分分析结果表明,季节因素对水松根际微生物群落碳代谢特征存在显著影响。冗余分析结果显示,速效氮含量对水松根际微生物碳代谢特征影响最大,即速效氮含量是微生物碳代谢特征变化的主要驱动因子。
-
水松根际微生物群落多样性和碳代谢能力在夏季最优,在冬季最差,季节因素显著影响着根际微生物群落结构和功能。因此在开展水松根际微生态相关研究时应充分考虑到季节因素造成的波动,以增强研究结果的代表性。本研究首次揭示了不同季节水松根际微生物群落结构和碳代谢特征,填补了水松在根际微生态领域研究的空白,为水松在根际微生态领域的进一步研究提供了有益理论依据。
孑遗植物水松不同季节根际微生物群落结构和功能特征
Functional Characteristics of Rhizosphere Soil Microbial Communities of Relict Plant Glyptostrobus pensilis in Different Seasons
-
摘要:
目的 探索水松根际微生物群落结构和功能及随季节变化的规律。 方法 采用PCR-DGGE和Biolog-ECO微平板法测定不同季节水松根际土壤理化性质、微生物群落结构和功能,通过主成分分析和冗余分析等方法解析根际微生态各环境因子的内在规律。 结果 水松根际微生物群落中优势细菌为α-变形菌(Alphaproteobacteria)、酸杆菌(Acidobacteria)和δ-变形菌(Deltaproteobacteria),优势真菌为粪壳菌(Sordariomycetes)。夏季水松根际微生物量和微生物多样性最高。根际微生物的碳代谢能力在夏季最强,冬季最弱,大致表现为夏季>秋季>春季>冬季,速效氮可能是微生物群落碳代谢功能的主要驱动因子。 结论 水松根际微生物群落多样性和碳代谢能力在夏季最优,在冬季最差。季节因素显著影响着根际微生物群落结构和功能,开展相关研究时应充分考虑季节因素造成的波动。 -
关键词:
- 水松
- / 根际微生物
- / 季节动态
- / PCR-DGGE
- / Biolog-ECO
Abstract:Objective To explore the structure and function of rhizosphere microbial community of Glyptostrobus pensilis and its seasonal variation. Methods PCR-DGGE and Biolog-ECO microplate methods were used to determine the soil physicochemical properties, structure and function of rhizosphere microbial community of G. pensilis in different seasons, and the intrinsic patterns of rhizosphere microecological factors were analyzed by principal component analysis and redundancy analysis. Result The dominant bacterial in the rhizosphere microbial community of G. pensilis were Alphaproteobacteria, Acidobacteria and Deltaproteobacteria, and the dominant fungi was Sordariomycetes. Rhizosphere microbial biomass content and microbial diversity in the soil of G. pensilis are the highest in summer. Carbon metabolism of rhizosphere microorganisms in the summer was the largest, followed by autumn, spring, and winter. Available nitrogen may be the main factor driving changes in the functional diversity of carbon metabolism in rhizosphere microbial communities. Conclusion The diversity and carbon metabolism ability of rhizosphere microbial community of G. pensilis are the best in summer and the worst in winter. Seasonal factors significantly affect the structure and function of rhizosphere microbial community, and the fluctuation caused by seasonal factors should be fully considered in the future related research. -
Key words:
- Glyptostrobus pensilis
- / rhizosphere microorganism
- / seasonal dynamic
- / PCR-DGGE
- / Biolog-ECO
-
表 1 根际微生物类群相对丰度
Table 1. Relative abundance of rhizosphere microbial groups
% 界
Kingdom纲
Class冬季
Winter春季
Spring夏季
Summer秋季
Autumn细菌 Bacteria Alphaproteobacteria 37.69 b 38.58 b 41.83 a 42.96 a Acidobacteria 22.64 a 20.36 b 19.54 b 22.48 a Deltaproteobacteria 13.66 b 24.29 a 14.69 b 14.17 b Firmicutes 6.44 c 4.83 d 13.11 a 9.77 b Betaproteobacteria 3.35 d 4.53 a 3.48 c 3.80 b Ktedonobacteria 9.36 a 2.03 b 0.48 d 1.01 c Actinobacteria 2.32 a 1.12 c 1.64 b 0.89 d Other 1.04 c 0.93 c 3.60 a 1.64 b Oligoflexia 1.92 b 2.39 a 0.27 d 1.26 c Nitrospirae 0.97 b 0.27 c 0.90 b 1.63 a Gammaproteobacteria 0.61 ab 0.67 a 0.47 bc 0.40 c 真菌 Fungi Dothideomycetes 2.19 b 1.76 c 5.44 a 1.47 d Leotiomycetes 28.83 a 28.86 a 29.09 a 27.65 b Sordariomycetes 40.69 b 31.97 d 36.53 c 50.53 a Tremellomycetes 28.29 b 37.41 a 28.94 b 20.35 c 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3)表 2 根际微生物群落多样性
Table 2. Diversity of rhizosphere microbial community
冬季
Winter春季
Spring夏季
Summer秋季
AutumnShannon 4.6537 ± 0.0137 c 4.7041 ± 0.0031 b 4.8282 ± 0.0048 a 4.7061 ± 0.0124 b Simpson 0.9913 ± 0.0006 a 0.9803 ± 0.0002 b 0.9801 ± 0.0001 b 0.9788 ± 0.0004 c 均匀度 Evenness 0.9394 ± 0.0028 c 0.9495 ± 0.0006 b 0.9746 ± 0.0010 a 0.9499 ± 0.0025 b Brillouin 3.4726 ± 0.0203 d 3.7285 ± 0.0380 c 4.0118 ± 0.0260 a 3.8496 ± 0.0366 b 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3)表 3 根际土壤理化性质
Table 3. Physical and chemical properties of rhizosphere soil
指标
Index冬季
Winter春季
Spring夏季
Summer秋季
Autumn温度 Temperature/℃ 2.85 ± 0.30 d 9.61 ± 0.32 c 14.36 ± 0.24 a 12.19 ± 0.16 b 土壤含水量 Soil water content/% 77.72 ± 1.12 b 79.68 ± 1.49 ab 81.15 ± 1.77 a 80.15 ± 0.62 ab pH 5.01 ± 0.03 a 4.75 ± 0.02 c 4.61 ± 0.02 d 4.94 ± 0.07 b 速效氮 Available nitrogen/(mg·kg−1) 200.31 ± 7.85 d 228.68 ± 15.07 c 274.87 ± 2.82 a 249.20 ± 6.51 b 速效磷 Available phosphorus/(mg·kg−1) 11.20 ± 0.14 d 14.65 ± 0.28 c 20.53 ± 0.35 a 19.41 ± 0.36 b 速效钾 Available potassium/(mg·kg−1) 221.56 ± 4.61 d 244.38 ± 2.73 c 304.31 ± 5.43 a 283.64 ± 5.90 b 全氮 Total nitrogen/(g·kg−1) 4.45 ± 0.10 d 5.66 ± 0.07 c 7.92 ± 0.27 a 6.50 ± 0.19 b 全磷 Total phosphorus/(g·kg−1) 0.66 ± 0.02 a 0.47 ± 0.03 b 0.44 ± 0.02 b 0.30 ± 0.03 c 全钾 Total potassium/(g·kg−1) 2.74 ± 0.17 c 3.39 ± 0.12 b 3.92 ± 0.07 a 3.25 ± 0.06 b 注:不同小写字母表示同一行数据间差异显著(p<0.05, n=3)
Note: Different lowercase letters indicate significant differences of data in the same line (p<0.05, n=3) -
[1] 中国科学院中国植物志编辑委员会. 中国植物志 第七卷[M]. 北京: 科学出版社, 1978. [2] 于永福. 杉科植物的起源、演化及其分布[J]. 植物分类学报, 1995, 33(4):362-389. [3] WANG G T, WANG Z F, WANG R J, et al. Development of microsatellite markers for a monotypic and globally endangered species, Glyptostrobus pensilis (Cupressaceae)[J]. Applications in Plant Sciences, 2019, 7(2): e1217. doi: 10.1002/aps3.1217 [4] HARTMANN A, ROTHBALLER M, SCHMID M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research[J]. Plant and Soil, 2008, 312(1-2): 7-14. doi: 10.1007/s11104-007-9514-z [5] BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486. doi: 10.1016/j.tplants.2012.04.001 [6] JOERGENSEN R G, WU J S, BROOKES P C. Measuring soil microbial biomass using an automated procedure[J]. Soil Biology and Biochemistry, 2011, 43(5): 873-876. doi: 10.1016/j.soilbio.2010.09.024 [7] LIN Q M, ZHAO X R, ZHAO Z J, et al. Rock phosphate solubilization mechanisms of one fungus and one bacterium[J]. Agricultural Science in China, 2002, 1(9): 1023-1028. [8] FIERER N. Embracing the unknown: disentangling the complexities of the soil microbiome[J]. Nature Reviews Microbiology, 2017, 15(10): 579-590. doi: 10.1038/nrmicro.2017.87 [9] FLEMMING H C, WUERTZ S. Bacteria and archaea on earth and their abundance in biofilms[J]. Nature Reviews Microbiology, 2019, 17(4): 247-260. doi: 10.1038/s41579-019-0158-9 [10] DIMKPA C, WEINAND T, ASCH F. Plant-rhizobacteria interactions alleviate abiotic stress conditions[J]. Plant Cell and Environment, 2009, 32(12): 1682-1694. doi: 10.1111/j.1365-3040.2009.02028.x [11] MANTELIN S, TOURAINE B. Plant growth-promoting bacteria and nitrate availability: impacts on root development and nitrate uptake[J]. Journal of Experimental Botany, 2004, 55(394): 27-34. doi: 10.1093/jxb/erh010 [12] WANG F, JIANG R F, KERTESZ M A, et al. Arbuscular mycorrhizal fungal hyphae mediating acidification can promote phytate mineralization in the hyphosphere of maize (Zea mays L. )[J]. Soil Biology & Biochemistry, 2013, 65: 69-74. doi: 10.1016/j.soilbio.2013.05.010 [13] HODGE A, STORER K. Arbuscular mycorrhiza and nitrogen: implications for individual plants through to ecosystems[J]. Plant and Soil, 2015, 386(1-2): 1-19. doi: 10.1007/s11104-014-2162-1 [14] AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169. doi: 10.1128/MMBR.59.1.143-169.1995 [15] XU Q F, JIANG P K, WU J S, et al. Bamboo invasion of native broadleaf forest modified soil microbial communities and diversity[J]. Biological Invasions, 2015, 17(1): 433-444. doi: 10.1007/s10530-014-0741-y [16] XIAO C P, YANG L M, ZHANG L X, et al. Effects of cultivation ages and modes on microbial diversity in the rhizosphere soil of Panax ginseng[J]. Journal of Ginseng Research, 2016, 40(1): 28-37. doi: 10.1016/j.jgr.2015.04.004 [17] FU L, RUAN Y Z, TAO C Y, et al. Continous application of bioorganic fertilizer induced resilient culturable bacteria community associated with banana Fusarium wilt suppression[J]. Scientific Reports, 2016, 6(1): 27731. doi: 10.1038/srep27731 [18] SRIVASTAVA M, KAUSHIK M S, MISHRA A K. Linking the physicochemical properties with the abundance and diversity of rhizospheric bacterial population inhabiting paddy soil based on a concerted multivariate analysis of PCR-DGGE and RISA[J]. Geomicrobiology Journal, 2016, 33(10): 894-905. doi: 10.1080/01490451.2015.1127298 [19] FEIGL V, UJACZKI É, VASZITA E, et al. Influence of red mud on soil microbial communities: Application and comprehensive evaluation of the Biolog-Eco plate approach as a tool in soil microbiological studies[J]. Science of The Total Environment, 2017, 595: 903-911. doi: 10.1016/j.scitotenv.2017.03.266 [20] 刘金福, 洪 伟, 吴则焰, 等. 孑遗植物水松(Glyptostrobus pensilis)种群生命表和谱分析[J]. 植物科学学报, 2008, 26(3):259-263. doi: 10.3969/j.issn.2095-0837.2008.03.009 [21] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. [22] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. [23] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2011. [24] YU J, ZHOU X F, YANG S J, et al. Design and application of specific 16S rDNA-targeted primers for assessing endophytic diversity in Dendrobium officinale using nested PCR-DGGE[J]. Applied Microbiology and Biotechnology, 2013, 97(22): 9825-9836. doi: 10.1007/s00253-013-5294-y [25] XU X F, THORNTON P E, POST W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems[J]. Global Ecology and Biogeography, 2013, 22(6): 737-749. doi: 10.1111/geb.12029 [26] 李延茂, 胡江春, 汪思龙, 等. 森林生态系统中土壤微生物的作用与应用[J]. 应用生态学报, 2004, 15(10):1943-1946. doi: 10.1300/J064v24n01_09 [27] BOWLES M T, ACOSTA-MARTÍNEZ, V, CALDERÓN F, et al. Soil enzyme activities, microbial communities, and carbon and nitrogen availability in organic agroecosystems across an intensively-managed agricultural landscape[J]. Soil Biology & Biochemistry, 2014, 68: 252-262. doi: 10.1016/j.soilbio.2013.10.004 [28] EICHMANN R, RICHARDS L, SCHÄFER P. Hormones as go-betweens in plant microbiome assembly[J]. The Plant Journal, 2021, 105(2): 518-541. doi: 10.1111/tpj.15135 [29] GROVER M, BODHANKAR S, SHARMA A, et al. PGPR mediated alterations in root traits: way toward sustainable crop production[J]. Frontiers in Sustainable Food Systems, 2021, 4: 618230. doi: 10.3389/fsufs.2020.618230 [30] CHAI Y N, SCHACHTMAN D P. Root exudates impact plant performance under abiotic stress[J]. Trends in Plant Science, 2022, 27(1): 80-91. doi: 10.1016/j.tplants.2021.08.003 [31] 诚 胡, 曹志平, 罗艳蕊, 等. 长期施用生物有机肥对土壤肥力及微生物生物量碳的影响[J]. 中国生态农业学报, 2007, 15(3):48-51. [32] LEPCHA N T, DEVI N B. Effect of land use, season, and soil depth on soil microbial biomass carbon of Eastern Himalayas[J]. Ecological Processes, 2020, 9(1): 65. doi: 10.1186/s13717-020-00269-y [33] FUHRMAN J A. Microbial community structure and its functional implications[J]. Nature, 2009, 459(7244): 193-199. doi: 10.1038/nature08058 [34] 彭伶俐, 王 琴, 辛明秀. 自然界中不可培养微生物的研究进展[J]. 微生物学杂志, 2011, 31(2):75-79. doi: 10.3969/j.issn.1005-7021.2011.02.017 [35] SANCHEZ A, BAJIC D, DIAZ-COLUNGA J, et al. The community-function landscape of microbial consortia[J]. Cell Systems, 2023, 14(2): 122-134. doi: 10.1016/j.cels.2022.12.011 [36] ANGELONI N L, JANKOWSKI K J, TUCHMAN N C, et al. Effects of an invasive cattail species (Typha × glauca) on sediment nitrogen and microbial community composition in a freshwater wetland[J]. FEMS Microbiology Letters, 2023, 263(1): 86-92. doi: 10.1111/j.1574-6968.2006.00409.x [37] RUMBERGER A, MERWIN I A, THIES J E. Microbial community development in the rhizosphere of apple trees at a replant disease site[J]. Soil Biology and Biochemistry, 2007, 39(7): 1645-1654. doi: 10.1016/j.soilbio.2007.01.023 [38] WANG H, LIU R J, YOU M P, et al. Pathogen biocontrol using plant growth-promoting bacteria (PGPR): role of bacterial diversity[J]. Microorganisms, 2021, 9(9): 1988. doi: 10.3390/microorganisms9091988 [39] MARSCHNER P, MARINO W, LIEBEREI R. Seasonal effects on microorganisms in the rhizosphere of two tropical plants in a polyculture agroforestry system in Central Amazonia, Brazil[J]. Biology and Fertility of Soils, 2002, 35(1): 68-71. doi: 10.1007/s00374-001-0435-3 [40] 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术, 2011, 34(3):50-57. doi: 10.3969/j.issn.1003-6504.2011.03.012 [41] 何中声, 陈佳嘉, 朱 静, 等. 戴云山南坡不同海拔森林土壤微生物功能多样性特征及影响因素[J]. 生态学报, 2022, 42(9):3504-3515. doi: 10.5846/stxb202101210217 [42] 邹春娇, 齐明芳, 马 建, 等. Biolog-ECO解析黄瓜连作营养基质中微生物群落结构多样性特征[J]. 中国农业科学, 2016, 49(5):942-951. doi: 10.3864/j.issn.0578-1752.2016.05.014 [43] 闫法军, 田相利, 董双林, 等. 刺参池塘底质微生物群落功能多样性的季节变化[J]. 生态学报, 2014, 34(11):2996-3006. doi: 10.5846/stxb201211231655 [44] CARVALHAIS L C, DENNIS P G, FEDOSEYENKO D, et al. Root exudation of sugars, amino acids, and organic acids by maize as affected by nitrogen, phosphorus, potassium, and iron deficiency[J]. Journal of Plant Nutrition and Soil Science, 2011, 174(1): 3-11. doi: 10.1002/jpln.201000085 [45] MOE L A. Amino acids in the rhizosphere: From plants to microbes[J]. American Journal of Botany, 2013, 100(9): 1692-1705. doi: 10.3732/ajb.1300033 [46] 宋贤冲, 郭丽梅, 曹继钊, 等. 猫儿山常绿阔叶林土壤微生物群落功能多样性的季节动态[J]. 基因组学与应用生物学, 2020, 39(9):4017-4024. doi: 10.13417/j.gab.039.004017 -




 下载:
下载: