-
油茶(Camellia oleifera Abel.)为山茶科(Theaceae)山茶属(Camellia)常绿灌木或小乔木,主要栽培在我国南方各省,是我国特有的木本油料树种。茶油的不饱和脂肪酸含量高达93%,具有预防心血管疾病、提高免疫力、加快吸收和护肤等功能,被誉为“绿色油库”[1]。截至2021年,我国油茶林面积达到487 hm2,年产茶籽394万吨,年产茶油超100万吨,油茶产业产值超1 000亿元,但低产问题严重制约了油茶产业的发展[2-3]。国家林业和草原局、国家发展和改革委员会、财政部联合印发的《加快油茶产业发展三年行动方案(2023—2025年)》提出到2025年改造低产林85万hm2,全国油茶种植面积达到600万hm2以上、茶油产能达到200万吨。高州油茶(Camellia gauchowensis Chang)又名华南油茶、大果油茶、陆川油茶,是华南区域主栽油茶品种之一,它具有树体高大、寿命长、果实大、单株产量高、抗病性强、耐高温、耐高湿的特性[4]。目前对高州油茶的研究主要集中在经济性状、引种评价、育苗技术、光合生理、生殖生物学及遗传资源分析上[4-12],对高州油茶糖积累以及代谢相关酶特性及调控机制鲜有报道。
糖类是油茶果实最主要的富集物,以果糖和葡萄糖含量最多[13]。糖代谢相关酶对各器官糖含量,特别是果实糖分的积累具有重要作用。同树种不同器官、同器官不同时期含糖种类存在差异[14-16],不同种类的酶对各器官糖积累的影响也不同[17-18]。汤佳在对两种普通油茶(C. oleifera)无性系品种闽43和闽60的研究中发现,果实可溶性糖及蔗糖含量积累趋势类似,果实发育消耗还原糖的差异导致最终果实含油率的差异[13]。杨柳燕等人通过对甜瓜(Cucumis melo L.)叶片进行遮光处理发现,遮光后甜瓜SS酶活性显著降低,蔗糖含量也会随之降低[19];蔗糖磷酸合成酶(SPS)作为蔗糖代谢的关键酶之一,不可逆地催化蔗糖的生物合成,其活性直接反映蔗糖的合成能力[20]。边彩燕等人在对葡萄欧亚种(Vitis vinifera L.)糖代谢的研究中发现,蔗糖含量与SPS活性呈极显著正相关(r=0.825)[21];可溶性酸性转化酶(S-AI)、细胞壁不溶性酸性转(B-AI)化酶和中性转化酶(NI)统称为转化酶(Inv),其能够催化蔗糖转化为果糖和葡萄糖,属不可逆酶类[22-23]。王秀贞等人证明了Inv参与了蔗糖的分解过程,其活性与蔗糖含量呈负相关关系[24];AI和NI虽都参与了蔗糖的分解过程,但是它们在糖代谢过程中发挥的作用存在差异[25]。糖代谢的过程复杂多变的,并非是由单一某个酶参与就能完成,而是由各种酶协同配合的结果。目前关于高州油茶糖分积累及糖代谢酶的作用机制尚不清楚,本文以高州油茶为材料,研究油茶生长发育过程中不同源库器官各种糖含量及糖代谢相关酶活性的动态变化,以进一步揭示油茶糖积累变化规律,为进一步完善油茶果实糖分积累理论提供依据。
-
试验材料为高州油茶,采自华南农业大学增城宁西油茶良种繁育示范基地,试验地属亚热带-热带温润季风气候,年平均温度21.9 ℃,年平均降雨量为2 004.5 mm,土壤为红壤,pH值为4.6,有机质含量为8.57 g·kg−1,田间持水量为20.41%,土壤密度为1.55 g·cm−3[26]。
试验林为2010 年采用1 年生高州油茶实生苗造林,株行距为3 m × 3 m,总面积为1 hm2。目前成龄树正常生长结果,无病虫害。2020年11月在对林分进行抚育管理后选取3株长势基本一致、挂果量接近且无病虫害的植株进行样品的处理和采集,另选远距离油茶树3株作为空白对照。样本树平均地径10.2 cm;平均树高3.2 m;平均冠幅2.7 m(东西向)、2.7 m(南北向),实验期对样树进行常规管理。分别在2021年7月、8月、9月、10月进行采样,每次从样树树体的不同方向和随机枝条采集叶片5片,使用铝箔包好;采集大小均一无损伤、发育良好果实5个,剥离果皮和种仁放入50 mL离心管中分装后一起放进液氮速冻,再用干冰保存带回实验室,部分立刻放置于-80 ℃冰箱用于糖代谢相关酶活性测定,另一部分随即进行糖含量的测定。于13C标记后72 h采集样树、对照树的叶、枝、果皮、种仁,测定样品中δ13C与碳含量,用于观测光合产物积累特征。
-
13C脉冲标记:于2021年7月、8月、9月、10月中旬晴天上午进行,选择样树树冠中层的枝条进行标记(叶果比为4:1),在标记前在距离果实5 cm的枝条进行环割。标记时,将喷有防雾试剂且已经干燥的聚乙烯袋子套在待标记枝条,而后使用橡胶管连通内外,分别使用双面胶和宽胶带对袋子内外进行封口,在封口前袋内放置CaCl2和变色硅胶吸收植株蒸腾产生水蒸气;使用抽气泵吸出袋内气体后,充入无CO2和H2O的空气直至袋子完全鼓起再密封,最后使用注射器充入13 mL13C丰度为99%的CO2气体,每间隔1 h充入同等剂量的13CO2气体,共充入3次。
样品δ13C与碳含量测定:将采集后的样品放置在105 ℃烘箱中杀青30 min,再调为75 ℃烘干至质量恒定,取出后测定其干质量,再粉碎过100目筛,密封保存后送至深圳华科精信稳定同位素实验室进行测定(采用DELTA V Advantage同位素比率质谱仪测定,δ13C含量误差小于0.1%)。
-
样品糖含量以及酶活性的测定均采用购自苏州科铭生物技术有限公司的试剂盒(微量法),每个指标均设4次重复,测定过程中使用的主要仪器有冷冻研磨仪、台式离心机(Eppendorf)和Microplate Reader(Multiskan FC, Thermo fisher scientific, Waltham, MA, USA)。
样品处理:称取0.1 g粉碎的样品于1.5 mL EP管中,加入1 mL去离子水,95 ℃水浴10 min,冷却后,8 000 rpm离心10 min,将上清液转移到10 mL试管中,用蒸馏水定容至10 mL,震荡摇匀待测。
可溶性糖含量测定:采用微量法(96样)测定。
-
样品处理:称取0.1 g粉碎样品于2 mL EP管,加入1 mL试剂一混匀,80 ℃水浴30 min,3 000 rpm离心5 min,弃上清液,沉淀中加入0.5 mL蒸馏水,95 ℃水浴糊化15 min,冷却后加入0.35 mL试剂二,常温下提取15 min后加入0.85 mL蒸馏水,3 000 rpm离心10 min,取上清液待测。
淀粉含量测定:方法同可溶性糖含量测定。
-
样品处理:称取1 g样品于15 mL的EP管中,加入5 mL双蒸水,混匀后80 ℃水浴20 min,期间每隔5 min轻轻混匀。冷却后5 000 rpm离心15 min,取上清液至新的EP管中,再往残渣中加入4 mL双蒸水后重复上述步骤再提取一次,合并上清液并定容至10 mL。吸取定容后的溶液于2 mL EP管中,12 000 rpm离心20 min[27],后用1 mL注射器吸取200 μL左右的溶液经0.22 μL的水膜过滤纯化,移入进样瓶中待测。
糖组分测定:配制5个浓度梯度的蔗糖、葡萄糖和果糖的标准样品溶液,分别是0.625、1.25、2.5、5、10、20 mg·mL−1。采用高效液相色谱(HPLC)法测定。色谱条件为:以超纯水作为流动相,流速为0.3 mL·min−1,等度洗脱,柱温80 ℃,进样量10 μL,测试时间为20 min。通过标准样品定性并绘制标准曲线,计算每个测试样品的峰面积,最后定量转换成以每克鲜质量样品所含可溶性糖含量的毫克数(mg·g−1鲜质量)
-
样品处理:取出-80 ℃保存的各器官样品,液氮分开研磨后各称0.1 g研磨样品在组织质量与提取液体积比在1:5~1:10的情况下进行酶活性测定
酶活性测定:采用微量法(96样)测定SS-Ⅱ、SPS、NI、B-AI和S-AI酶活性。
-
自然丰度δ13C/‰:
δ13C=(Rs−Rc)Rc × 1 000
公式中“Rs”表示13C/12C绝对值之比;“Rc”为碳同位素标准比值0.011 237 2;
13C原子百分比Atom%13C:
Atom%13C=(δ13C + 1 000) × Rc[(δ13C + 1 000) × Rc + 1 000] × 100%
各器官固定的碳总量Ci:
Ci=C% × Wi
公式中“C%”表示各器官含碳百分比;“Wi”为各器官的干质量;“i”为不同器官;
各器官固定13Ci/mg:
13Ci=Ci × Atom%13C-Fn100 × 1 000
公式中“Fn”表示未标记样品的13C原子百分比;
各月份各器官的13C分配比例Pi/%:
$ \begin{array}{c}{P}_{i}=\dfrac{{ }^{13}{C}_{i}}{{ }^{13}{C}_{f}}\end{array} $
公式中“13Cf”表示各部位积累13C的总和。
(2)试验数据统计分析采用IBM SPSS20进行差异显著性分析(单因素(ANOVA)方差分析,最小显著性差异(LSD)法)。图表采用Origin 2023绘制。
-
由图1可知,随着高州油茶的生长发育各器官δ13C变化趋势相似,但是变化范围差异极显著。果实发育前期逐渐增加,8月份达到最大值后迅速降低。源器官叶的δ13C变化范围最大,最大值为70.98‰(8月),最小值为−27.29‰(10月);枝、果皮和种仁的δ13C变化范围较小,最大值分别为−15.04‰(8月)、−24.76‰(8月)和−20.10‰(7月),最小值分别为−27.28‰(10月)、−27.48‰(10月)和−26.59‰(10月)。
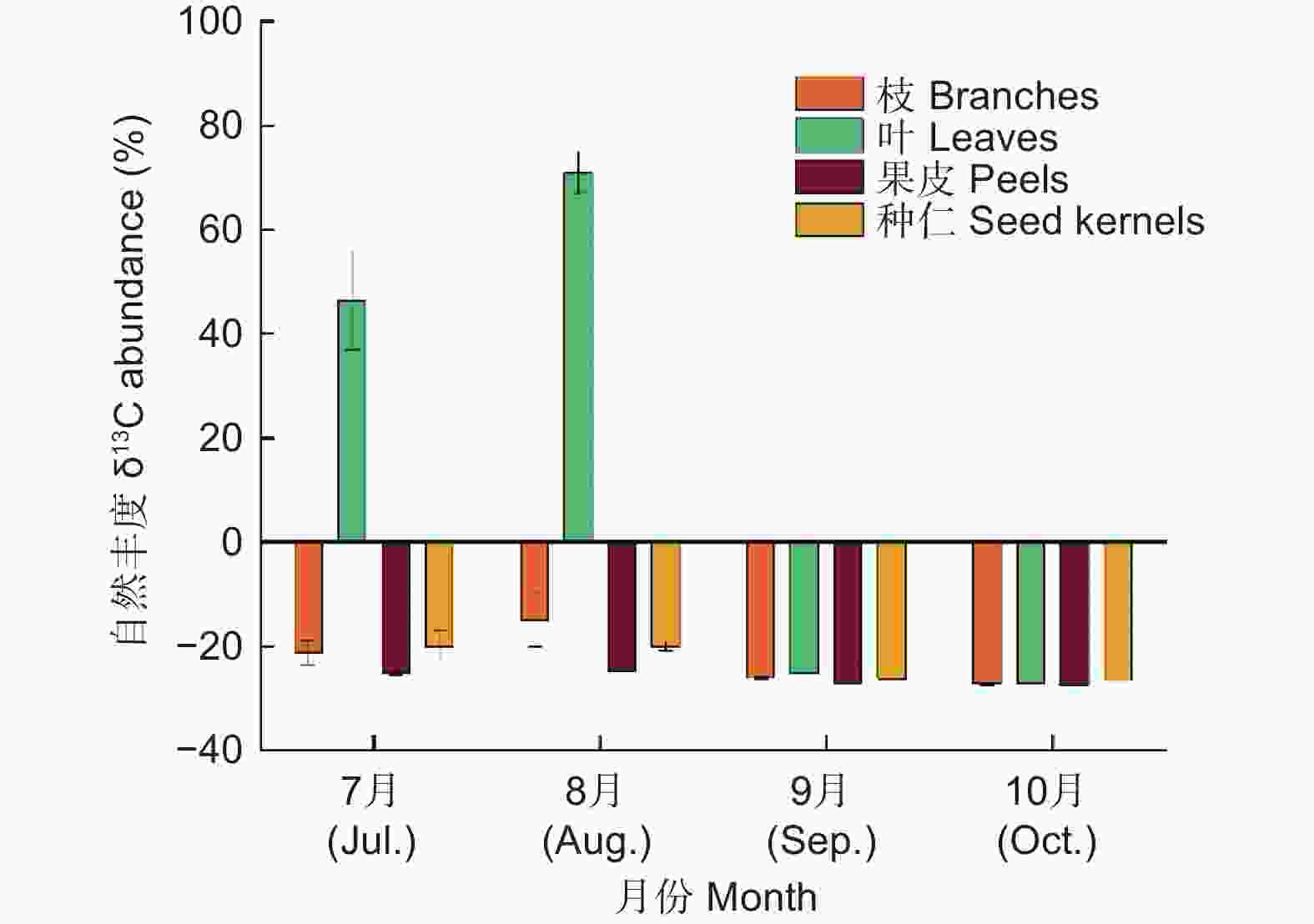
图 1 高州油茶生长发育过程中各器官光合产物积累情况
Figure 1. Accumulation of photosynthetic products in various organs during the growth and development of C. gauchowensis
光合产物由“源”端制造,经由韧皮部的运输,最终到达“库”端,并在各库器官贮藏最终形成目的产量。不同生长发育期13C在高州油茶各器官的分配比例差异显著。
发育前期,光合产物在叶片的分配比例远高于其他器官,而后骤减,发育后期(10月)只占比3.8%;果皮作为光合产物重要的贮藏库,其光合产物分配比在9月达到最大值(42.6%);光合产物在枝条的贮藏量始终较低;种仁随着果实的生长发育,在后期成为了光合产物的分配中心,10月份有64.5%的光合产物贮藏在种仁中(表1)。
表 1 不同生长发育期高州油茶各器官13C的积累量及13C在各器官的分配比例
Table 1. The accumulation of 13C mass in various organs of C. gauchowensis at different growth stages and the percentage of 13C in each organ
月份 植株中13C的积累量
Total accumulation of
13C mass in plants/
(mg·plant−1)各器官13C分配比例
The percentage of 13C in each organ/%枝
Branches叶
Leaves果皮
Peels种仁
Seed kernels7 3.42 ± 0.30 7.77 ± 2.74 Cc 69.84 ± 2.00 Aa 15.94 ± 0.39 Bb 6.45 ± 2.50 Cd 8 5.84 ± 0.22 7.70 ± 2.58 Dc 54.55 ± 1.80 Abc 16.54 ± 0.64 Cb 21.21 ± 1.42 Ba 9 0.38 ± 0.26 13.17 ± 2.21 Cbc 21.48 ± 1.25 Ab 42.55 ± 7.85 Cb 22.81 ± 7.87 Bab 10 0.17 ± 0.13 4.90 ± 1.33 Bab 3.78 ± 2.47 Abc 26.86 ± 3.83 Bb 64.47 ± 6.63 Bab 注:同行数据后不同大写字母表示相同采样时期不同器官间显著差异(p <0.05);同列数据后不同小写字母表示相同器官不同采样时期间差异显著(p <0.05)
Notes: Different capital letters following the data in the same row indicate significant differences between organs of the same sampling period(p <0.05); Different lowercase letters following the data in the same column indicate significant differences between the same organs of different sampling period(p <0.05)产生上述现象的原因为源库器官存在活力差异,通常树体生长中心活力最强,源器官同化的光合产物,会优先分配到生长中心。分配中心随着植株生长发育而变化。发育前期叶片作为库的活力更强,同化物更多的保留在叶片内从而满足其生长发育需求,但随着果实的发育和成熟,生长中心转向种仁,同化物则更多的向种仁转运和积累。
-
绿色植物光合作用的主要产物是碳水化合物,其主要成分为淀粉和可溶性糖,一般情况下绿色植物体内的可溶性糖主要包括葡萄糖、蔗糖和果糖。
由图2可知,NSC(可溶性糖和淀粉)在高州油茶各器官的含量差异显著(p<0.05)。各器官中NSC主要的存在形式为可溶性糖,各时期可溶性糖占NSC的比例均高于50%。,7月份各器官NSC含量差距最小。总体来看,果皮中的可溶性糖含量最为丰富,各时期叶片淀粉含量都高于其他两个部位。
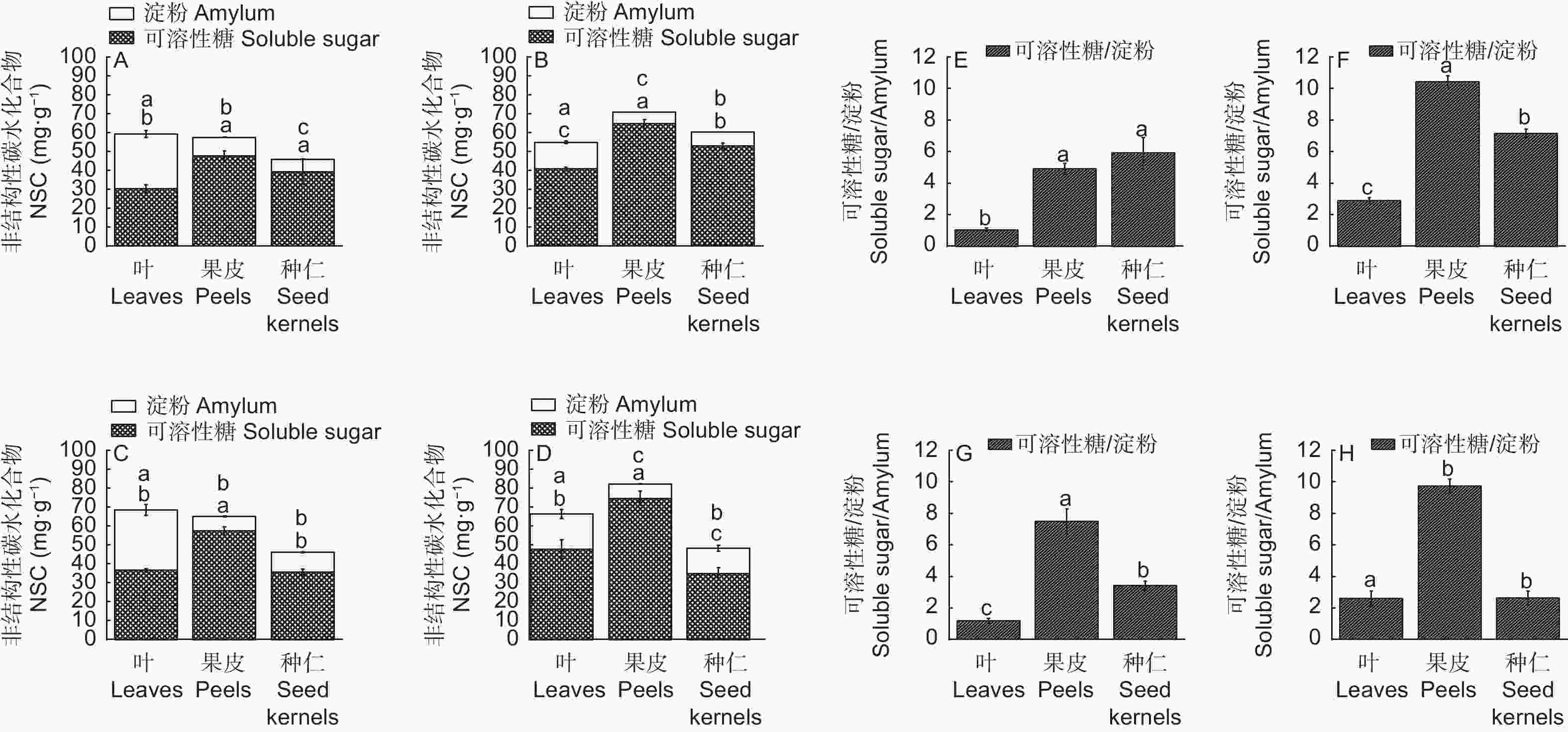
图 2 不同生长发育期高州油茶各器官非结构性碳水化合物分配情况
Figure 2. Distribution of non-structural carbohydrates in various organs of C. gauchowensis at different growth stages
淀粉作为糖的主要储存形式,对植物的生长发育和代谢活动都具有重要意义,9、10月份种仁淀粉含量显著高于其他时期。不同时期各器官可溶性糖与淀粉的比值存在差异,种仁中比值逐渐降低,在生长后期种仁可溶性糖为最低值,而淀粉含量达到最大值(13.52 mg·g−1)。
-
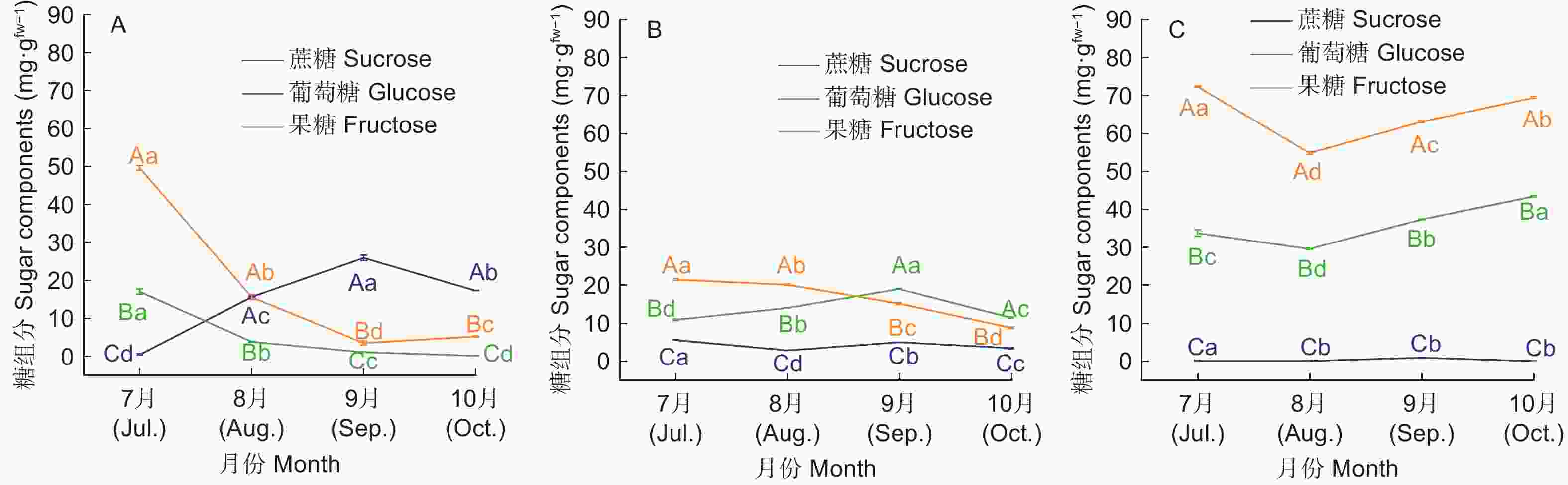
高州油茶不同生长发育期叶片、果皮和种仁中糖的主要贮藏形式有所差异(图3)。7、8月份果糖在叶片、果皮和种仁中的含量最高,说明在这一时期各器官中的光合产物主要以果糖的形式贮藏。种仁中蔗糖的含量随着果实发育逐渐升高,在9月份达到最大值(25.93 mg·g−1),显著高于其余两种糖的含量,说明在种仁贮藏的可溶性糖逐渐从果糖葡萄糖转变为蔗糖。
-
如图4所示,SS-Ⅱ在各器官均呈先上升后下降的变化趋势,且均在9月份达到峰值,叶片、果皮和种仁的峰值分别为1 677.62 U·g−1、2 535.58 U·g−1 和2 071.62 U·g−1。8月份是各器官SS-Ⅱ活性的分界点,前期叶片SS-Ⅱ活性高于果皮和种仁,之后反之;7—9月份果皮的SS-Ⅱ活性一直高于种仁,至10月份种仁的SS-Ⅱ活性大于果皮。经相关性分析可知SS-Ⅱ与叶片葡萄糖含量、果皮及种仁的蔗糖含量存在极显著正相关性(表2)。说明SS-Ⅱ对高州油茶果实蔗糖合成积累起着关键作用。
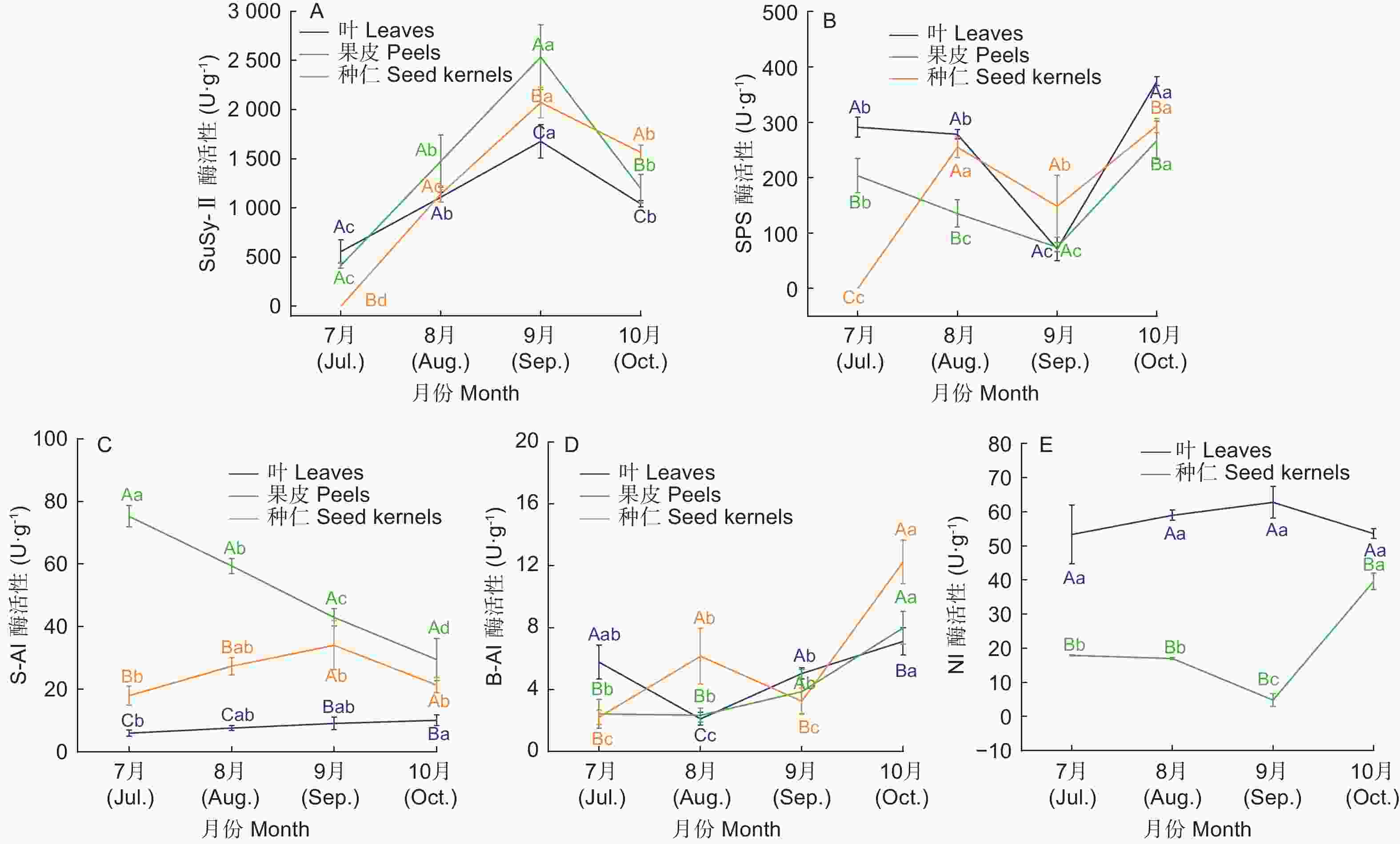
图 4 不同生长发育期高州油茶糖代谢相关酶活性变化
Figure 4. Changes in the enzyme activities related to sugar metabolism in C. gauchowensis at different growth stages
表 2 高州油茶各器官糖积累与相关代谢酶活性的相关性
Table 2. Relation between sugar accumulation and activities of sucrose metabolizing enzymes in various organs of C. gauchowensis
部位
Organs糖组分
Sugar componentsSS-Ⅱ SPS S-AI B-AI NI 叶片 Leaves 可溶性糖 soluble sugar 0.482 0.052 0.514 −0.146 0.226 果糖 fructose −0.364 −0.182 −0.700* −0.550 0.038 葡萄糖 glucose 0.895** −0.926** 0.245 −0.284 0.590* 蔗糖 sucrose −0.133 −0.435 −0.306 0.447 −0.009 果皮 Peels 可溶性糖 soluble sugar 0.171 0.140 −0.608* 0.437 果糖 fructose −0.554 0.585* 0.071 0.341 葡萄糖 glucose 0.005 0.477 −0.757 0.857** 蔗糖 sucrose 0.812** −0.749** −0.248 −0.109 种仁 Seed kernels 可溶性糖 soluble sugar 0.066 0.077 0.012 −0.209 −0.400 果糖 fructose −0.835** −0.786** −0.506 −0.577 −0.142 葡萄糖 glucose −0.787** −0.835** −0.457 −0.615* −0.209 蔗糖 sucrose 0.957** 0.601 0.677* 0.288 −0.149 注:*和**分别表示p<0.05和p<0.01显著性水平
Notes: * and ** indicate statistical significance at p < 0.05 and p < 0.01 levels, respectively -
SPS在叶片和果皮中均呈现先下降后升高的变化趋势,且均在9月份出现在谷值,分别为71.44 U·g−1 和74.43 U·g−1,在10月份达到最大值;种仁中SPS活性呈波动上升趋势,两个峰值分别出现在8月和10月,且第二个峰值略高于第一个峰值,为263.96 U·g−1。SPS与叶片、果皮和种仁的可溶性糖含量都呈正相关关系(表2),但是其活性低于SS-Ⅱ,说明SPS和SS-Ⅱ都影响着油茶糖分积累,但SS-Ⅱ是更为关键的酶。
-
叶片中S-AI活性呈逐渐上升趋势,但变化幅度较小,且活性较低;在果皮中S-AI的活性呈逐渐下降趋势,至10月份时为29.48 U·g−1,较7月份下降了60.81%;种仁中S-AI的活性呈先上升后下降的变化趋势,在9月份出现峰值34.06 U·g−1。
-
B-AI总体活性较低,在叶片中呈先下降后升高的趋势,8月份出现谷值2.11 U·g−1;在果皮中呈逐渐上升趋势,至10月份达到最大值7.99 U·g−1;在种仁中呈现波动上升的趋势,分别于8月和10月出现峰值,且第二个峰值较高,为12.25 U·g−1。表明8月份有大量蔗糖由叶片转运至种仁,10月各器官B-AI活性相对较高可能是因为临近果实成熟期,糖分代谢较活跃,加速完成果实的油脂积累。
-
当S-AI活性较低时NI为蔗糖分解的关键酶,叶片中S-AI活性一直较低,而NI活性约为S-AI的5~10倍呈先升高后下降的趋势,其峰值出现在9月,为62.80 U·g−1,但各月份间差异较小;种仁中NI活性呈先下降后升高的变化趋势,9月出现谷值4.81 U·g−1,10月份活性最高为 39.61 U·g−1,这利于蔗糖向种仁运输,并进一步转化形成油脂;但在果皮中,4个试验期均未测到NI的活性,推测与果皮为未成熟组织有关。
-
由表2可知高州油茶叶片、果皮、种仁的糖积累与SS-Ⅱ、SPS、S-AI存在显著相关性,B-AI对果皮和种仁的糖积累存在显著相关性,NI与叶片糖积累存在显著相关性,因此高州油茶糖积累的过程受到多种糖代谢酶的综合调控。其中SS-Ⅱ活性与叶片葡萄糖含量、果皮和种仁的蔗糖含量呈极显著正相关,SPS活性与果皮果糖含量显著正相关,S-AI与种仁蔗糖含量显著正相关,B-AI与果皮葡萄糖含量极显著正相关,NI与叶片葡萄糖含量显著正相关。结合图4可知各器官SS-Ⅱ的活性高于SPS的活性,因此SS-Ⅱ是调控高州油茶生长发育过程中糖分积累的关键酶。
-
光合产物的运输分配是多个器官共同参与的复杂生理生化过程,源叶同化后进行“源”器官装载、韧皮部维管束长距离运输、“库”器官卸载及韧皮部后运输[28]。运输至各库器官的光合产物并非均匀分配的,源端供应能力、库端竞争能力及韧皮部运输能力的差异共同决定了植物光合产物的分配[29]。当光合产物在果实中大量分配积累,作物易高产。按照优先权级别的高低,各器官对光合产物竞争能力的大小依次为种子>新鲜果实>叶>形成层>根[30]。在试验期,光合产物在各器官的分配中心逐渐由叶片转移至种仁,产生这一现象的原因也是源库器官存在活力差异,通常情况下,树体生长中心的活力最强,源器官同化的光合产物,会优先分配给树体的生长中心。随着树体的生长发育,分配中心也会发生变化,在发育前期,叶片作为库的活力更强,同化物更多的保留在叶片内从而满足其生长发育需求,在对马尾松(Pinus massoniana Lamb.)的研究中也发现类似结论[31]。随着果实的发育和成熟,生长中心转向种仁,同化物更多的向种仁转运和积累,这一结论与何雪菲等对库尔勒香梨的研究结果基本一致[32]。发育前期13C光合产物在运输趋于稳定后,近期合成的光合产物主要在叶进行积累,这一时期叶对光合产物的需求量更大,该时期源器官叶固定和吸收的光合产物主要用于自身生长。
-
糖类是光合作用的主要产物,其主要成分是可溶性糖和淀粉,绿色植物体内可溶性糖主要为葡萄糖、果糖和蔗糖[33-34]。不同树种、同树种不同品系、同植株不同器官及同器官不同时期富集糖的种类存在差异[35-37]。在实验期内,种仁中的可溶性糖含量先增后降,果皮与叶片的可溶性糖含量则呈现“增、降、增”的变化趋势。各器官淀粉含量变化与可溶性糖含量变化呈相反的趋势,说明不同生长发育期同器官积累利用的主要糖类不同,分析这一现象的成因是在果实发育过程中,优先利用可溶性糖合成油脂,当可溶性糖含量不满足继续合成油脂时,则利用淀粉转化合成油脂,从而产生可溶性糖与淀粉含量在各器官交替积累的现象。同时研究发现,各器官可溶性糖含量基本表现为果皮>种仁>叶片,淀粉含量表现为叶片>种仁>果皮,表明各器官富集糖类有所差异。果皮可溶性糖含量高,可能是因为前期果实发育以果皮为主,而随着果实逐渐成熟,需要大量葡萄糖合成纤维素进而合成木质素,完成果皮的木质化;叶片中淀粉含量高,可能是因为以蔗糖为主的可溶性糖向外大量地运输。
7—8月、9—10月分别为油茶果实膨大和油脂合成转化的关键期,果实消耗大量能量实现发育和成熟。种仁前期果糖和葡萄糖含量较高,且二者含量都处于连续减少的状态,说明大量还原糖被呼吸所消耗,产生的能量用于种仁的各项生命代谢活动。蔗糖含量逐渐升高,中后期蔗糖成为种仁主要富集的可溶性糖这与张亚若等人的观点相似[38]。实验期末果实临近成熟时,果皮中主要积累果糖和葡萄糖这与“闽43”油茶糖积累情况相似[13]。
源叶合成的糖向库器官果实的运输与果实品质密切相关[39],大多数植物源器官光合作用固定的碳会以磷酸单糖(果糖、葡萄糖等)的形式存在,进一步形成淀粉后贮藏在叶绿体中,这是植物夜间储存利用糖类的模式,同时磷酸单糖能够在运输到细胞质后合成蔗糖,这也是源器官向库器官运输糖的又一主要形式[40]。
高州油茶发育前期叶片蔗糖含量最高,有利于蔗糖向果实转移,在种仁中完成积累,运输到果皮的蔗糖会分解为果糖和葡萄糖被利用,果皮在发育后期依旧会进行增厚和延伸,继续完成木质化,果皮与种仁对养分进行激烈竞争,呈现出果大皮厚的现象。
-
糖代谢相关酶对各器官糖含量,特别是果实糖分的积累具有重要作用。SS-Ⅱ和SPS不仅参与蔗糖的合成,同时具有将蔗糖分解为果糖和尿苷二磷酸葡萄糖(UDPG)的功能,能将蔗糖进一步转化为果糖和葡萄糖[41- 42]。不同器官中蔗糖合成酶类的功能存在差异[13],本研究发现SPS与SS-Ⅱ在叶片和果皮中起到的作用近乎相反,而在种仁中两者的作用则基本相同。转化酶根据作用位置的不同被分为AI和NI,AI根据功能不同分为S-AI和B-AI,其中B-AI主要作用于韧皮部,与质外体卸载密切相关[23],低活性的B-AI利于源器官蔗糖向外转运[43]。叶片中B-AI活性8月份最低,然而种仁中B-AI活性达到一个小高峰,此时大量蔗糖由叶片转运至种仁,是造成8月份种仁可溶性糖含量最高的原因之一。叶片中S-AI活性始终较低,这与赖呈纯等人的研究结论相似[44],果皮中S-AI活性呈下降趋势,但总体活性较高,这也解释了果皮中蔗糖含量极低,果糖和葡萄糖含量较高这一现象。S-AI在库器官能调控细胞膨大,研究发现S-AI活性在种仁发育前期逐渐升高,成熟期降低,推测其在种仁中的作用是促进种仁发育成熟。NI作为蔗糖分解的关键酶,在库器官活性越高,利于筛管-伴胞复合体中维持稳定的蔗糖浓度差,完成蔗糖的卸载[45]。叶片NI活性约为S-AI的5~10倍,这可能是因为当S-AI活性较低时,NI为蔗糖分解的关键酶[46]。种仁中NI活性在发育后期逐渐升高,这利于蔗糖向种仁运输并转化形成油脂。本研究在果皮中未能检测到NI的活性,推测可能与果皮是未成熟组织有关[47]。
本研究发现SPS和SS-Ⅱ与叶片、果皮和种仁的可溶性糖含量都呈正相关关系(相关性见表2),而且SS-Ⅱ的活性高于SPS,说明SPS和SS-Ⅱ同时影响着高州油茶糖分的积累,且SS-Ⅱ是糖分积累的关键酶。目前在枣(Ziziphus jujuba Mill.)、甜菜(Beta vulgaris L.)和苹果(Malus pumila Mill.)的研究中都发现SS-Ⅱ是积累蔗糖关键合成酶[48-51]。
糖代谢相关酶对调节油茶糖积累具有重要作用,各代谢酶对可溶性糖总量以及葡萄糖、果糖、蔗糖的积累作用和影响机制存在差异。因此可以进一步分析不同油茶品种糖积累差异的相关代谢酶作用方式以及深层分子机理,从而为油茶果实性状影响机理提供参考。
-
高州油茶标记的光合产物运输稳定后,在发育前期主要保存在叶片之中,由于果实生长发育,种仁逐渐成为了同化物分配的中心。在糖积累情况上,各器官可溶性糖含量基本表现为果皮>种仁>叶片,淀粉含量表现为叶片>种仁>果皮,种仁在发育前期主要积累果糖和葡萄糖,发育后期则主要积累蔗糖。在发育后期运输到果皮的蔗糖会分解为果糖和葡萄糖,果皮依旧会进行增厚和延伸,继续完成木质化,此时果皮与种仁会对养分进行激烈竞争,最终呈现出果大皮厚的现象。SPS和SS-Ⅱ功能互补,同时影响着高州油茶糖分的积累,且SS-Ⅱ是糖分积累的关键酶;NI为叶片主要转化酶,种仁中S-AI与NI的活性基本相同,二者分别在发育前期和后期发挥作用;果皮中蔗糖转化主要依靠S-AI;B-AI主要在发育后期起作用,但活性相对较低,转化能力有限。
高州油茶糖积累及其代谢相关酶活性
Sugar Accumulation and the Relevant Enzymes Activities of Camellia gauchowensis
-
摘要:
目的 研究高州油茶生长发育过程中各源库器官糖积累特征及其与糖代谢相关酶活性的关系,为进一步完善华南地区特色油茶品种糖积累理论提供依据。 方法 以高州油茶为研究对象,利用13C同位素脉冲标记法测定不同发育时期各源库器官的13C含量,同时测定对应时期各器官非结构性碳水化合物(NSC)含量、糖组分特征及相关酶活性的变化。 结果 1)13C标记的光合产物在运输趋于稳定后,在发育前期主要积累在叶片中,后期种仁逐渐成为了同化物分配积累的中心。2)各器官可溶性糖含量基本表现为果皮>种仁>叶片,淀粉含量表现为叶片>种仁>果皮3)SPS和SS-Ⅱ与叶片、果皮和种仁的可溶性糖含量都呈正相关关系;B-AI主要在发育后期起着作用,种仁中B-AI活性分别在8月和10月存在峰值;在叶片中,NI为主要的糖转化酶,活性在 50~60 U·g−1 之间;种仁中,S-AI与NI的活性大致相同,S-AI主要在发育前期起作用,而NI在发育后期起作用。 结论 高州油茶发育前期光合产物主要积累在源器官叶片之中,随着果实生长发育种仁逐渐成为了同化物分配的中心;在糖积累情况上,种仁在发育前期主要积累果糖和葡萄糖,发育后期则主要积累蔗糖。在发育后期运输到果皮的蔗糖会分解为果糖和葡萄糖,果皮依旧会进行增厚和延伸,继续完成木质化,此时果皮与种仁会对养分进行激烈竞争,最终呈现出果大皮厚的现象。SPS和SS-Ⅱ功能互补,同时影响着高州油茶糖分的积累,且SS-Ⅱ是糖分积累的关键酶;可能是引起各源库器官糖含量差异的主要原因,高州油茶糖积累受糖代谢相关酶的综合调控,NI为叶片的主要转化酶,S-AI与NI分别在种仁发育前后期发挥作用,果皮中蔗糖转化主要依靠S-AI;B-AI主要在发育后期起作用,但活性相对较低,转化能力有限。 Abstract: :Objective To study the characteristics of sugar accumulation in various source-sink organs during the growth and development of Camellia gauchowensis and its relationship with the enzymatic activities related to sugar metabolism for providing a basis for further improving the theory of sugar accumulation in characteristic oil tea camellia varieties in the South China region. Method We employed the 13C isotope pulse labeling method to determine the 13C content in various source-sink organs at different developmental stages of C. gauchowensis. We also measured changes in non-structural carbohydrate (NSC) content, sugar component characteristics, and related enzyme activities in the respective organs during the corresponding periods. Result 1) After the stabilization of the transport of 13C-labeled photosynthates, during the early developmental stages, these products were primarily accumulated in the eaves, while in the later stages, the seed kernels gradually became the central location for assimilate distribution and accumulation. 2) The soluble sugar content in various organs was mainly observed in the order of peels > seeds > leaves, while starch content showed the order of leaves > seeds > peels. 3) The activities of SPS and SS-II were positively correlated with the soluble sugar content in leaves, peels, and seeds. B-AI primarily played a role during the later stages of development, with peak activities in seed kernels occurring in August and October. In leaves, NI served as the primary sugar-converting enzyme, with activity ranging between 50 and 60 U·g−1. In seed kernels, the activities of S-AI and NI were roughly similar, with S-AI primarily acting during the early developmental stages, while NI was more active during the later stages of development. Conclusion In C. gauchowensis, during the early stages of development, photosynthates primarily accumulate leaves of the source organ,. As fruit grows, the seed kernels gradually becomes the central location for assimilate distribution. Regarding sugar accumulation, during the early developmental stages, seed kernels primarily accumulates fructose and glucose, while in the later stages of development, they mainly accumulate sucrose. In the later stages of development, the sucrose transported to the peels will be decomposed into fructose and glucose, and the peels continues to thicken and extend, and continue to complete lignification. At this stage, there is intense competition for nutrients between the peels and seeds, resulting in the phenomenon of thick peels and large fruit size. The functions of SPS and SS-II complement each other and simultaneously influence sugar accumulation in C. gauchowensis, with SS-II being the key enzyme for sugar accumulation. This may be the primary reason for differences in sugar content among various source-sink organs. Sugar accumulation in C. gauchowensis is regulated comprehensively by sugar metabolism-related enzymes. NI serves as the primary conversion enzyme in the leaves, while S-AI and NI play roles in seed kernels during the early and late developmental stages, respectively. In peels, sucrose conversion primarily depends on S-AI. B-AI primarily functions in the later stages of development but with relatively low activity and limited conversion capacity. -
Key words:
- sugar content
- / enzyme activity
- / 13C pulse labeling
- / Camellia gauchowensis
-
表 1 不同生长发育期高州油茶各器官13C的积累量及13C在各器官的分配比例
Table 1. The accumulation of 13C mass in various organs of C. gauchowensis at different growth stages and the percentage of 13C in each organ
月份 植株中13C的积累量
Total accumulation of
13C mass in plants/
(mg·plant−1)各器官13C分配比例
The percentage of 13C in each organ/%枝
Branches叶
Leaves果皮
Peels种仁
Seed kernels7 3.42 ± 0.30 7.77 ± 2.74 Cc 69.84 ± 2.00 Aa 15.94 ± 0.39 Bb 6.45 ± 2.50 Cd 8 5.84 ± 0.22 7.70 ± 2.58 Dc 54.55 ± 1.80 Abc 16.54 ± 0.64 Cb 21.21 ± 1.42 Ba 9 0.38 ± 0.26 13.17 ± 2.21 Cbc 21.48 ± 1.25 Ab 42.55 ± 7.85 Cb 22.81 ± 7.87 Bab 10 0.17 ± 0.13 4.90 ± 1.33 Bab 3.78 ± 2.47 Abc 26.86 ± 3.83 Bb 64.47 ± 6.63 Bab 注:同行数据后不同大写字母表示相同采样时期不同器官间显著差异(p <0.05);同列数据后不同小写字母表示相同器官不同采样时期间差异显著(p <0.05)
Notes: Different capital letters following the data in the same row indicate significant differences between organs of the same sampling period(p <0.05); Different lowercase letters following the data in the same column indicate significant differences between the same organs of different sampling period(p <0.05)表 2 高州油茶各器官糖积累与相关代谢酶活性的相关性
Table 2. Relation between sugar accumulation and activities of sucrose metabolizing enzymes in various organs of C. gauchowensis
部位
Organs糖组分
Sugar componentsSS-Ⅱ SPS S-AI B-AI NI 叶片 Leaves 可溶性糖 soluble sugar 0.482 0.052 0.514 −0.146 0.226 果糖 fructose −0.364 −0.182 −0.700* −0.550 0.038 葡萄糖 glucose 0.895** −0.926** 0.245 −0.284 0.590* 蔗糖 sucrose −0.133 −0.435 −0.306 0.447 −0.009 果皮 Peels 可溶性糖 soluble sugar 0.171 0.140 −0.608* 0.437 果糖 fructose −0.554 0.585* 0.071 0.341 葡萄糖 glucose 0.005 0.477 −0.757 0.857** 蔗糖 sucrose 0.812** −0.749** −0.248 −0.109 种仁 Seed kernels 可溶性糖 soluble sugar 0.066 0.077 0.012 −0.209 −0.400 果糖 fructose −0.835** −0.786** −0.506 −0.577 −0.142 葡萄糖 glucose −0.787** −0.835** −0.457 −0.615* −0.209 蔗糖 sucrose 0.957** 0.601 0.677* 0.288 −0.149 注:*和**分别表示p<0.05和p<0.01显著性水平
Notes: * and ** indicate statistical significance at p < 0.05 and p < 0.01 levels, respectively -
[1] 谭晓风. 油茶分子育种研究进展[J]. 中南林业科技大学学报, 2023, 43(1):1-24. [2] 张立伟, 王辽卫. 我国油茶产业的发展现状与展望[J]. 中国油脂, 2021, 46(6):6-9 + 27. [3] 张立伟. 积极发展木本油料生产提升国内油脂供给能力[J]. 中国粮食经济, 2023, 30(5):69-71. [4] 胡加新, 李蕊萍, 朱 雯, 等. 高州油茶光合生理特性[J]. 华南农业大学学报, 2015, 36(5):111-116. [5] 赵君茹, 朱周俊, 肖诗鑫, 等. 高州油茶无性系叶片解剖结构及抗旱性评价[J]. 分子植物育种, 2022, 20(16):5435-5443. [6] 张应中, 徐煲铧, 王明怀, 等. 高州油茶果实生长性状与品质的动态变化规律[J]. 林业与环境科学, 2020, 36(1):47-52. [7] 张 鹏, 杨 颖, 奚如春, 等. 高州油茶花粉形态及其贮藏特征[J]. 林业科学研究, 2019, 32(1):90-96. [8] 杨 颖, 张 鹏, 奚如春, 等. 高州油茶不同产区果实含油率及脂肪酸组成的变异特征[J]. 经济林研究, 2018, 36(4):104-108 + 144. [9] CHEN J, GUO Y J, HU X W, et al. Comparison of the chloroplast genome sequences of 13 oil-tea camellia samples and identification of an undetermined oil-tea camellia species from Hainan province[J]. Frontiers in Plant Science, 2022, 12: 798581. doi: 10.3389/fpls.2021.798581 [10] YU J, YAN H Q, WU Y G, et al. Quality Evaluation of the Oil of Camellia spp.[J]. Foods, 2022, 11(15): 2221. doi: 10.3390/foods11152221 [11] QI H S, SUN X X, WANG C M, et al. Geographic isolation causes low genetic diversity and significant pedigree differentiation in populations of Camellia drupifera, a woody oil plant native to China[J]. Industrial Crops and Products, 2023, 192: 116026. doi: 10.1016/j.indcrop.2022.116026 [12] MA G Y, XIA T F, SUN X X, et al. Identification and analysis of CdS-RNase in Camellia drupifera: A key determinant of late-acting self-incompatibility[J]. Industrial Crops and Products, 2023, 203: 116990. doi: 10.1016/j.indcrop.2023.116990 [13] 汤 佳. 油茶果实发育及成熟期间主要生理生化指标变化的研究[D]. 福州: 福建农林大学, 2015. [14] 齐红岩, 李天来, 邹琳娜, 等. 番茄果实不同发育阶段糖分组成和含量变化的研究初报[J]. 沈阳农业大学学报, 2001(5):346-348. [15] 陈俊伟. 柑橘果实糖运输与积累的生理机制研究[D]. 杭州: 浙江大学, 2002. [16] 吉训志, 胡丽松, 秦晓威, 等. 胡椒不同时期体细胞胚中糖含量及相关酶活变化[J]. 分子植物育种, 2020, 18(24):8288-8293. [17] 苏 艳, 原牡丹, 侯智霞, 等. 蔗糖代谢相关酶在果实中的作用[J]. 北方园艺, 2008(9):50-54. [18] HE Y, CHEN R F, YANG Y, et al. Sugar metabolism and transcriptome analysis reveal key sugar transporters during camellia oleifera fruit development[J]. International Journal of Molecular Sciences, 2022, 23(2): 822. doi: 10.3390/ijms23020822 [19] 杨柳燕, 陈菁菁, 陈年来. 甜瓜叶片光合产物输出能力对弱光的响应[J]. 中国农业科学, 2018, 51(13):2561-2569. [20] LUNN J E, MACRAE E. New complexities in the synthesis of sucrose[J]. Current opinion in plant biology, 2003, 6(3): 208-214. doi: 10.1016/S1369-5266(03)00033-5 [21] 边彩燕, 姜寒玉, 朱永永, 等. 河西地区赤霞珠葡萄果实发育期糖代谢及相关酶活性的变化[J]. 甘肃农业科技, 2021, 52(6):42-48. [22] 安 娇. 软枣猕猴桃果实发育过程中糖酸组分及其相关酶活性的变化[D]. 延边: 延边大学, 2020. [23] WANG X Y, YOU H L, YUAN Y H, et al. The cellular pathway and enzymatic activity for phloem-unloading transition in developing Camellia oleifera Abel. Fruit[J]. Acta Physiologiae Plantarum, 2018, 40(23): 1-11. [24] 王秀贞, 吴 琪, 王志伟, 等. 花生子仁糖含量与相关酶活性关系的研究[J]. 山东农业科学, 2020, 52(9):19-22. [25] 姚绍嫦, 黄 鼎, 谭 勇, 等. 牛大力块根糖积累及其相关酶活性变化研究[J]. 广西植物, 2021, 41(11):1939-1948. [26] YU F, TRUONG T V, HE Q, et al. Dry Season Irrigation Promotes Leaf Growth in Eucalyptus urophylla x E. grandis under Fertilization[J]. Forests, 2019, 10(1): 67. doi: 10.3390/f10010067 [27] GHRAMH H A, KHAN K A, AHMED Z, et al. Quality evaluation of Saudi honey harvested from the Asir province by using high-performance liquid chromatography (HPLC)[J]. Saudi journal of biological sciences, 2020, 27(8): 2097-2105. doi: 10.1016/j.sjbs.2020.04.009 [28] BRAUN D M, WANG L, RUAN Y L. Understanding and manipulating sucrose phloem loading, unloading, metabolism, and signalling to enhance crop yield and food security[J]. Journal of Experimental Botany, 2014, 65(7): 1713-1735. doi: 10.1093/jxb/ert416 [29] 平晓燕, 周广胜, 孙敬松. 植物光合产物分配及其影响因子研究进展[J]. 植物生态学报, 2010, 34(1):100-111. [30] WARDLAW I F. Tansley Review No. 27 The control of carbon partitioning in plants[J]. New phytologist, 1990, 116(3): 341-381. doi: 10.1111/j.1469-8137.1990.tb00524.x [31] DENG X X, SHI Z, ZENG L X, et al. Photosynthetic product allocations to the organs of pinus massoniana are not affected by differences in synthesis or temporal variations in translocation rates[J]. Forests, 2021, 12(4): 471. doi: 10.3390/f12040471 [32] 何雪菲, 黄 战, 张文太, 等. 施氮水平对库尔勒香梨光合产物分配的影响[J]. 应用生态学报, 2020, 31(8):2637-2643. [33] RAI M K, SHEKHAWAT N S. Recent advances in genetic engineering for improvement of fruit crops[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2014, 116: 1-15. doi: 10.1007/s11240-013-0389-9 [34] IQBAL S, NI X P, BILAL M S, et al. Identification and expression profiling of sugar transporter genes during sugar accumulation at different stages of fruit development in apricot[J]. Gene, 2020, 742: 144584. doi: 10.1016/j.gene.2020.144584 [35] 李 洁, 姚宝花, 宋宇琴, 等. 枣不同品种和果实不同部位糖积累及相关酶活性[J]. 林业科学, 2017, 53(12):30-40. [36] 刘有春, 陶承光, 魏永祥, 等. 越橘果实糖酸含量和不同发育阶段的变化及其与叶片中可溶性糖含量的相关关系[J]. 中国农业科学, 2013, 46(19):4110-4118. [37] 王 晨, 房经贵, 王 涛, 等. 果树果实中的糖代谢[J]. 浙江农业学报, 2009, 21(5):529-534. [38] 张亚若, 童盼盼, 梁丰志, 等. 枣果实糖组分含量动态变化与相关基因表达分析[J]. 江西农业学报, 2021, 33(3):25-31. [39] 于 波, 秦嗣军, 吕德国. 锌对苹果果实膨大期叶片13C光合产物合成及向果实转移分配的影响[J]. 应用生态学报, 2021, 32(6):2007-2013. [40] 蔡贵芳, 刘 艳, 白立华, 等. 去果河套蜜瓜源叶碳水化合物及其相关酶昼夜变化特征[J]. 西北植物学报, 2012, 32(9):1774-1780. [41] 赵建华, 李浩霞, 尹 跃, 等. 4种枸杞果实发育过程中糖积累与蔗糖代谢酶的关系[J]. 浙江农林大学学报, 2016, 33(6):1025-1032. [42] 陈梓云. 铁皮石斛多糖积累与蔗糖代谢的相关性[D]. 杭州: 浙江农林大学, 2015. [43] 耿彬彬, 刘 姣, 郭育强, 等. 木薯MeCWINV4启动子的克隆及其活性分析[J]. 江苏农业科学, 2016, 44(4):36-40. [44] 赖呈纯, 张富民, 赖恭梯, 等. 摘心对‘巨峰’葡萄生长及蔗糖和淀粉代谢的调控作用[J]. 热带亚热带植物学报, 2022, 30(5):623-635. [45] WAN H J, WU L M, YANG Y J, et al. Evolution of sucrose metabolism: the dichotomy of invertases and beyond[J]. Trends in plant science, 2018, 23(2): 163-177. doi: 10.1016/j.tplants.2017.11.001 [46] WINTER H, HUBER S C. Regulation of sucrose metabolism in higher plants: localization and regulation of activity of key enzymes[J]. Critical reviews in biochemistry and molecular biology, 2000, 35(4): 253-289. doi: 10.1080/10409230008984165 [47] 高 芸. 转化酶研究进展[J]. 现代农业科技, 2010(23):16-18. [48] 李 洁, 姚宝花, 宋宇琴, 等. 枣不同品种和果实不同部位糖积累及相关酶活性[J]. 林业科学, 2017, 53(12):30-40. [49] SHAO K, BAI Z Q, LI M H, et al. Sucrose metabolism enzymes affect sucrose content rather than root weight in sugar beet (beta vulgaris) at different growth stages[J]. Sugar Tech, 2020, 22(3): 504-517. doi: 10.1007/s12355-019-00781-2 [50] SU J, ZHANG C X, ZHU L C, et al. MdFRK2-mediated sugar metabolism accelerates cellulose accumulation in apple and poplar[J]. Biotechnology for Biofuels, 2021, 14(1): 137. doi: 10.1186/s13068-021-01989-9 [51] TONG X L, WANG Z Y, MA B Q, et al. Structure and expression analysis of the sucrose synthase gene family in apple[J]. Journal of Integrative Agriculture, 2018, 17(4): 847-856. doi: 10.1016/S2095-3119(17)61755-6 -




 下载:
下载: