-
磷(P)是植物细胞内磷酸、磷脂和蛋白质等物质的重要组分,也是植物中必要的大量营养元素之一[1]。它不仅参与植物多种生理过程如光合作用、酶活性调节等,还参与调控植物的能量代谢和信号传导[1-2]。尽管大多数土壤中总磷储量充足,但有机磷与无机磷大多表现出了低溶解度和低流动性,使土壤可利用磷含量极低(<1%),特别是在酸性土壤中[3]。据估计,全球约40%的可耕地因缺磷而限制了作物生产力[4]。施用磷肥是提高作物生产力的重要途径[5]。然而,在实际农林实践中磷肥的施用也存在许多问题。一方面,全球约80%的磷矿石资源被用于生产磷肥,但磷矿石是不可再生资源。中国2014 年磷矿石产量为1.2 × 1011 kg,若以每年10%的年均增长率计算,中国磷矿石储量将在2028 年消耗殆尽[6]。另一方面,土壤磷肥的利用效率极低,约70%的磷肥被土壤中的Ca2+、Mg2+、Al3+、Fe3+ 等阳离子迅速结合,转化为难溶性磷,难以被植物吸收利用[7]。此外,过量使用磷肥不仅加快了自然界磷矿资源的枯竭速度,还可能造成水体富营养化等环境问题[8]。因此,运用生物途径将无效态的磷从土壤中释放,并提高土壤磷有效性是维持农业生态系统稳定的重要措施。
植物在长期的生物进化过程中形成了一系列对低磷胁迫的适应性机制以提高磷的利用效率,包括重建根系形态、释放根系分泌物、形成植物-微生物的共生关系等[9-10]。植物根系分泌物是与土壤界面能量、物质和信息传递的重要媒介[10],不仅可以改善根际土壤的理化性质,调节土壤酶活性,还可以调控根际微生物的群落构建,从而提高植物对养分的利用率[11]。植物根系释放分泌物活化土壤无效态的磷是植物面对低磷胁迫的重要手段。低磷水平下,水稻(Oryza sativa L.)根系分泌物总量是正常磷水平的1.5~5倍[12]。大豆(Glycine max (L.) Merr.)根系有机酸释放量是正常磷水平的2.1~5.8倍[13]。因此,不同种类根系分泌物是如何提高土壤磷有效性?根系分泌物提高土壤磷有效性的作用机制又是什么?本文基于国内外根系分泌物研究热点和上述科学问题,探究根系分泌物提高土壤磷有效性的潜在作用机制,旨在为解析植物磷高效利用机理和培育磷高效利用品种提供理论基础。
-
植物生长过程中,通过根系主动或被动向生长介质释放的所有物质统称为根系分泌物。根系分泌物的组成复杂,包括高分子量(High molecular weight, HMW)和低分子量(Low molecular weight, LMW)分子。HMW分泌物包括分泌酶、粘胶类、黄酮类和生长素等,其中多糖的羟基与土壤中磷结合位点相互作用,将磷释放到土壤溶液中易于植物吸收[14];磷酸酶的分泌也可以水解土壤难溶性磷,提高磷的生物有效性。LMW分泌物包括有机酸、酚类、维生素、氨基酸、糖类和植物铁载体等,其中酚类物质可以通过络合反应(complexation)分解铁氧化合物(Fe-oxides)提高土壤磷可利用性[15]。柠檬酸(citrate acid)、苹果酸(malate acid)和草酸(oxalate acid)等有机酸的释放可以直接促进土壤磷的活化。植物根系分泌物可以直接活化土壤难溶性磷,还可以促进菌根形成,招募解磷微生物间接调控土壤磷转化。因此,植物根系分泌物对土壤磷活化和提高植物磷高效利用具有重要作用。
-
酸性磷酸酶(Acid phosphatase, APase)是一类能催化水解有机磷单脂或酸酐并释放磷酸根离子(PO43-)的酶类。复杂的难溶性有机磷经过植物根系释放的APase水解后,成为易被植物获取利用的磷酸盐;脂类化合物也可经APase催化裂解释放无机磷,进而提高土壤中磷的生物有效性[16]。低磷环境下,高等植物通过根系分泌APase来适应低磷胁迫[17]。大量研究表明,低磷胁迫时,白羽扇豆(Lupinus albus L.)[18]、拟南芥(Arabidopsis thaliana (L.) Heynh.)[19]和油茶(Camellia oleifera Abel)[20]等植物根系合成和分泌更多的磷酸酶以促进有机磷的活化,从而提高土壤磷的有效性。不同种植物或不同基因型植物分泌酸性磷酸酶的能力不同。鹰嘴豆(Cicer arietinum L. ‘Sona’)根系分泌的酸性磷酸酶是玉米(Zea mays L.)‘Zhongdan No. 2’ 的2~3倍[14]。根系积累和分泌酸性磷酸酶的能力是选育磷高效利用品种的重要指标,植物体内磷代谢和土壤磷矿化速率较快,更有利于磷的运输与再利用[6]。目前,已知参与植物适应低磷胁迫的酸性磷酸酶主要属于紫色酸性磷酸酶(Pruple acid phosphatase, PAP)家族,例如大豆的GmPAP1-like、拟南芥的AtPAP10、AtPAP12、AtPAP26、菜豆(Phaseolus vulgaris L.)的PvPAP3等[22-24]。PAP因其酪氨酸残基和发色基团铁离子发生的电子转移导致呈现出特殊的紫色或粉色而得名[25]。不同物种基因组测序结果表明,PAP的同源性较低,但却呈现出高度的保守性。PAP结构域中包含了可以结合Fe3+、Fe2+、Zn2+和Mn2+等金属离子的7个保守氨基酸,形成PAP的催化中心[26]。低磷胁迫诱导杉木(Cunninghamia lanceolata (Lamb.) Hook.)根系ClPAP18b基因表达,过表达ClPAP18b基因可以增强拟南芥耐低磷胁迫能力[27]。Antonyuk等[28]从黄花羽扇豆(Lupinus luteus L.)中鉴定纯化得到一种磷酸二酯酶(PPD1),其属于一组新的高分子量植物PAPs,和甘薯(Ipomoea batatas (L.) Lam.)的PAPs[29]有相似的Fe3+-Mn2+催化位点。此外,PPD1的N末端结构域(N- terminal)具有独特折叠蛋白(fibronectin type III-like fold),这在其他植物的PAPs中是不存在的。然而目前,PAPs的N- terminal对其生物学特性和植物磷酸酶功能的影响尚不明确[26]。植物分泌的PAP能活化多种有机磷。Liang等[22]从菜豆根系纯化得到的紫色酸性磷酸同工酶PvPAP3,揭示其参与根系对外源ATP的活化。在菜豆和拟南芥等植物根系分泌PAP具有活化外源dNTP、DNA、ADP和6−磷酸果糖等有机磷的功能[18]。此外,植物中PAP编码基因的过表达可以显著提高转基因植物植酸酶活性,从而提高对植酸磷的活化能力[27]。在水稻中发现一种新型PAP(OsPAP10c),过表达OsPAP10c 可以使培养基中的APase活性增加10倍以上[30]。Liu等[31]克隆了植物根系中PAP的SgPAP23基因,其编码蛋白对植酸磷具有较高的活性。同时转基因菜豆毛根和拟南芥根系中超表达该基因时,分泌植酸酶的能力显著增强。
-
低分子量有机酸(Low molecular weight organic acids, LMWOA)是至少含有一个羧基且摩尔质量少于104 g·mol−1的有机化合物,可以活化土壤中无效态的磷。LMWOA主要来源于植物根系分泌物和动植物残体的分解[32]。目前,在农业土壤中所鉴定出的LMWOA种类繁多,主要可分为脂肪族和芳香族。脂肪族包括甲酸、乙酸、月桂酸、草酸、酒石酸和柠檬酸等,芳香族包括苯甲酸、肉桂酸、阿魏酸、水杨酸和对羟基苯甲酸等(图1)[7]。低磷胁迫会导致植物根系LMWOA的分泌发生变化。已有研究发现,低磷诱导的LMWOA种类和含量受植物品种和土壤环境的影响。低磷胁迫下,大豆“黔豆11号”根系柠檬酸、苹果酸和草酸的分泌量别是正常磷水平的3.1、2.4和5.3倍,大豆“滇86-4”根系琥珀酸和草酸的分泌量时正常磷水平的3.4和2.3倍[13]。油茶根系分泌物中LMWOA含量在低磷水平下是正常磷水平的1.13~5.12倍[33]。磷缺乏迫使马尾松(Pinus massoniana Lamb.)根系有机酸分泌提高了60.4%~142.9%,以促进芳香族的苹果酸、乙酸和草酸的分泌为主[34]。
-
土壤中难溶性无机磷通过水解产生PO43-,才能被植物吸收利用。植物分泌的LMWOA主要通过以下途径活化土壤中难溶性无机磷:1)改变土壤pH,促使含有无机磷的难溶性矿物质(磷酸钙、磷灰石等)溶解[35];2)与Fe、Al等金属阳离子发生络合反应,促进含磷化合物溶解[36];3)有机酸阴离子与土壤中无机磷阴离子竞争相同的吸附位点[37]。LMWOA对无机磷的活化效果受LMWOA种类和土壤类型影响。在酸性(pH <6)和中性(pH 6~8)土壤中,低分子量有机酸分别能提高土壤有效磷含量329%和320%,而在碱性(pH> 8)壤中效仅为56.9%[38]。张金昕等[39]研究结果表明不同LMWOA对灰潮土壤磷活化能力存在差异,苹果酸和柠檬酸对土壤磷的平均活化率在164%以上,而草酸只有在一定浓度下才促进土壤磷活化。添加LMWOA可促使温带林地土壤中无机磷向有效性更高的Al-P、Fe-P形态转化,从而提高了土壤供磷能力。此外,在碱性石灰性土壤中,草酸对土壤无机磷活化能力更强[41]。这是因为碱性土壤中以磷酸钙盐为主,且草酸易与钙离子络合;而柠檬酸则对酸性土壤中铁离子和铝离子的络合能力更强[6]。目前,关于有机酸对无机磷的活化研究大多数关注于其最终释放量,而土壤中无机磷的活化是一个持续的动态过程。因此,了解有机酸提高土壤无机磷可用性的持续能力有助于更深入理解其作用机制。
-
现有研究主要集中于LMWOA对无机磷的活化,而对LMWOA促进土壤有机磷的释放的关注较少。以往研究指出,有机磷需经过矿化分解转化为无机磷后,才能被植物吸收利用。而部分有机磷如肌醇六磷酸盐不需要经过矿化作用,可作为植物的直接磷源[42]。Giles等[43]发现,添加细菌来源的有机阴离子可以促进钙肌醇六磷酸的溶解,从而提高磷的有效性;Wang等[44]研究发现:不同类型土壤中,与柠檬酸和苹果酸相比,草酸对有机磷的活化效果均更强,有机酸的酸性强度可能会影响土壤有机磷的活化。而Wei等[45]研究发现,在多种酸性土壤中添加低分子有机酸,仅有柠檬酸能够促进有机磷活化,并指出所涉及的活化机制可能与无机磷相似,即表现出对铁和铝离子的强络合能力。目前,有机酸对土壤有机磷活化的潜在机制尚不明确,需要更多的系统性研究。
综上所述,植物可以通过LMWOA来提高土壤有机磷和无机磷的有效性,外源不同LMWOA对土壤磷活化效果因土壤类型,植物种类和气候类型存在较大差异[46-48]。研究外源LMWOA对土壤磷活化作用对LMWOA运用于农业生态系统,提高土壤磷素有效性具有重要意义。此外,植物分泌物中的许多物质对土壤磷活化具有重要作用。例如,根系可以分泌质子和无机离子,降低土壤pH,通过还原反应和螯合作用提高土壤磷有效性[49]。一些多糖和酚类物质可以通过络合反应(complexation)分解铁氧化合物(Fe-oxides)增加土壤磷可用性[15]。根系分泌物种类复杂,各组分之间亦存在协同关系。目前根系分泌物中许多组分对土壤磷活化的作用机制尚不清晰,也许未知的磷高效活化分泌物还未被发掘。加强根系分泌物种类的鉴定和发掘,探讨不同组分根系分泌物对土壤磷活化的机制具有重要的实践价值。
-
根际是植物、土壤和微生物相互作用的微域,根系分泌物对根际微生物群落构建起着重要作用[50]。根系分泌物中含有多种碳代谢物不仅是微生物生长的微域,同时也是植物和微生物之间信息交换的信号分子[51]。此外,根系分泌物可选择富集根际微生物促进土壤磷的活化。参与土壤中磷活化的两个关键微生物群分别为丛枝菌根(arbuscular mycorrhiza,AM)真菌和解磷微生物。
-
AM真菌,隶属球囊菌门(Glomeromycota),能与大约80%的陆生植物根系形成共生关系[52]。植物通过光合作用为AM真菌提供生长所需碳源,作为回报AM真菌向植物转运多种营养物质[53]。AM真菌还具有促进植物生长、改善植物营养状况、提高植物抵抗生物和非生物逆境等功能[54-55]。根系分泌物对菌根形成起着决定性作用,如根系分泌的独角金内酯(Srrigolactones, SLs)可以作为信号分子促进AM真菌的定殖。在1996年,Cook等[56]首次从棉花(Gossypium hirsutum)根系分泌物中分离出独角金醇,也是最早发现的天然SLs。SLs的生物合成和分泌高度依赖养分的可用性,特别是磷酸盐(Pi)。在同一株植物中,相比非宿主细胞侧根(FLRs),AMF诱导的CCD基因在寄主大侧根(LLRs)强烈表达,这表明AMF调控SL生物合成是局部的。然而,相比LLRs,FLRs却拥有更高水平的Pi含量,在FLRs中,Pi水平的增加可能会抑制SL的生物合成,从而限制AMF定殖[57]。López-Ráez等[58]研究发现Pi饥饿显著增加了SLs释放,促进菌丝分支。然而,在高Pi下生长的植物的根系分泌物缺乏SLs,同时失去了刺激AM真菌定殖的能力[59]。外源高Pi供应的条件下,植物抑制AMF定殖是限制AMF消耗碳水化合物而产生的积极策略。Breuillin等[60]研究发现高Pi抑制编码催化类胡萝卜素生物合成和加工后续步骤的酶的众多基因,如SLs生物合成酶CCD8基因。因此,SLs的减少可能是导致植物对AMF依赖性降低的重要原因。根系分泌物中SLs是植物根系与AM真菌进行信息交流的最主要信号分子,但除了SLs外,最新研究表明,根系分泌物中黄酮类物质可以促进AM真菌的孢子萌发和菌丝生长[61]。Tian等[61]研究表明根系分泌物中的类黄酮可以促进了AM真菌的定殖,同时土壤中添加槲皮素也可以增强AM真菌定殖。Xing等[62]发现食草植物轻度取食通过增加根系分泌物中黄酮类化合物含量来促进AM真菌定殖。
AM真菌定殖对促进植物磷吸收和提高土壤磷有效性具有重要作用。黄雨轩等[63]接种幼套近明球囊霉(Claroideogolmus etuicatum)显著提高油茶幼苗土壤速效磷含量,降低了Al-P、Fe-P、Ca-P、O-P 4种磷形态含量。Huang等[64]研究发现接种AMF提高了土壤磷酸酶活性和易溶解磷含量。目前已知AM真菌提高土壤磷有效性的机理如下:1):AM真菌可以通过根外菌丝直接吸收土壤中的无机磷。其菌丝长度可达植物根系长度的13倍,覆盖范围的700倍,远超根系长度[65]。Schnepf等[66]通过单个AM真菌菌丝营养吸收的数学模型发现:菌丝吸收磷的速率比根高出一个数量级。2)AM真菌定殖可以提高土壤磷酸酶活性。Xie等[67]和Wu等[68]接种AM真菌提高了土壤酸性和碱性磷酸酶活性。3)接种AM真菌可以促进根系分泌物中有机酸的释放,以提高土壤磷的有效性。Liu等[69]研究发现,接种AM真菌提高了紫云英(Astragalus sinicus L.)根系分泌物中甲酸的含量,促进植物对生物量的积累。Ma等[70]接种AM真菌促进了羟基苯甲酸(p-hydroxybenzoic)、对羟基苯烯酸(p-coumaric)和咖啡酸的(caffeic acid)分泌等有机酸分泌,提高根系活力。4)AM真菌同样可以释放有机酸等物质溶解土壤难溶性磷[71]。Bharadwaj等[72]用胡萝卜毛根作为宿主,鉴定所收集到的菌丝分泌物,其主要包括果糖和葡萄糖等糖类、柠檬酸和琥珀酸等有机酸、天冬氨酸和谷氨酸等氨基酸。AM菌丝通过根外菌丝释放分泌物,造成了菌丝表明富集大量的碳,吸引土壤微生物的定殖。实际上,AM真菌缺乏分泌磷酸酶的能力,使其不能直接利用有机磷[73]。然而,AM真菌可以通过菌丝分泌物招募解磷微生物,促进解磷微生物分泌的磷酸酶活性增强其活化有机磷的能力[71,74]。一方面,菌丝分泌物作为碳源促进解磷细菌生长,另一方面,菌丝分泌果糖作为信号分子刺激解磷细菌磷酸酶蛋白基因的表达[75]。综上所示,菌根植物除了可以通过根系分泌物提高土壤磷有效性,还可以通过SLs等物质促进菌根结构的形成来提高土壤磷有效性。
-
解磷微生物是土壤中能够将难溶性磷转化为易与植物吸收形式的一类土壤微生物。目前发现的解磷微生物共240种,包含了99个属,在磷的生物化学循环中具有重要作用[76]。一方面,解磷微生物可以分泌一系列化学物质来促进土壤磷活化。另一方面,解磷微生物通过呼吸作用产生CO2、与NH4+同化、释放H2S来降低土壤pH,从而溶解难溶性磷酸盐[76]。在农业生态系统中,解磷微生物可以提高磷肥的利用效率促进作物生长,提高作物品质。在田间试验结果表明,接种解磷微生物Bacillus safensis,姜黄(Curcuma longa L.)土壤速效磷显著提高了143.0%~246.0%,根茎产量提高了29%~120%,磷吸收量增加了51%~223.0%,姜黄素含量增加了30.0%~32.5%[77]。此外,解磷微生物还可以减少土壤磷肥的流失和改善土壤环境。Yu等[78]研究表明解磷微生物JP233中代谢的2-酮葡萄糖酸(2KGA)对土壤磷有效性起着重要作用,接种JP233在显著提高植株生长的同时减少了土壤磷的流失,从而提高土壤磷的利用效率。
根系分泌物可以诱导解磷微生物富集间接提高土壤磷的有效性。黄顶菊(Flaveria bidentis (L.) Kuntze)根系分泌物中的正己烷萃取物和二氯甲烷萃取物,可以显著提高解磷微生物的数量[79]。小白菜(Brassica rapa L.)根系分泌物中麦芽糖和葡萄糖等糖类物质对解磷细菌具有导向性,可以促进其在植物根系定殖[80]。番茄(Solanum lycopersicum L.)根系分泌物中苹果酸和柠檬酸等LMWOA有利于解磷微生物在植物根际的生长繁殖[81]。LMWOA可以促进解磷微生物在根际生长并调控根际解磷细菌的种群数量[82]。Wang等[83]研究发现LMWOA可以调控携带phoD的细菌种群结构,当草酸含量增多时,携带phoD的假单胞菌属Pseudomonas和芽孢杆菌属Bacillus的丰度显著增加。研究表明在低磷水平下,植物根系会分泌更多的LMWOA,导致土壤中解磷微生物的相对丰度增加[84]。此外,根系分泌的氨基酸对解磷微生物的生物量、生物膜形成具有重要作用。棉花根系分泌物中的精氨酸、丙氨酸、赖氨酸等可以促进枯草芽孢杆菌B. subtilis(一种高效解磷微生物)的生物膜形成[85]。
根系分泌物可以刺激解磷微生物活性间接提高土壤磷的有效性。黄顶菊根系分泌物处理后,40个芽孢杆菌菌株中有26株显著提高了土壤有效磷含量[79]。此外,根系分泌物中的糖类物质对解磷微生物的解磷能力具有积极作用,Laheurte等[86]研究发现随着糖类物质的增加,解磷微生物的解磷能力也增加。不同种糖类物质对不同解磷微生物解磷能力也有所差异。相比于葡萄糖、蔗糖和果糖等糖源,木糖对弯曲芽孢杆菌B. flexus的解磷效果最好[87]。根系分泌物对解磷微生物活性也存在抑制作用,这可能与根系分泌物的浓度和解磷微生物种类有关。王玉书[88]通过空心莲子草(Alternanthera philoxeroides (Mart.) Griseb.)根系分泌物对解磷微生物的影响发现,低浓度的根系分泌物提高了解磷细菌B07的解磷圈直径和解磷指数,降低了解磷细菌B05和B09的解磷能力;而中、高浓度的根系分泌物均抑制了解磷细菌的解磷能力。Pantigoso等[89]探究低磷诱导的根系分泌物对解磷微生物的影响,结果表明:半乳糖醇对苏云金芽孢杆菌B. thuringiensis的解磷能力没有影响,但可以增强阴沟大肠杆菌Enterobacter cloacae等细菌中磷的溶解。综上所述,根系分泌物可以通过富集解磷微生物和激活解磷微生物活性间接调控土壤磷的有效性。深入了解根系分泌物与解磷微生物互作,有望定向调控解磷微生物群落富集与活性,使生物菌剂代替部分磷肥成为可能。
-
土壤中大量无效态的磷是重要的潜在磷源。植物通过改变根系分泌物的种类和数量,活化土壤中难以吸收的磷资源(图2)。不同种类根系分泌物作用效果和机制不同。磷酸酶主要通过催化裂解脂类化合物促进有机磷的矿化;LMWOA的分泌主要通过竞争吸附位点和降低pH的方式促进有机磷和无机磷活化;酚类物质可以通过络合反应(complexation)分解铁氧化合物(Fe-oxides),释放磷酸盐。此外,糖类、氨基酸和植物激素的释放可以作为根际微生物的碳源和信号分子,促使特定微生物在根际定殖并活化土壤无效态磷。由于根系分泌物组分复杂,不同组分之间也存在一定的协同作用。一些根系分泌物对土壤磷的作用机制尚不明确。研究不同根系分泌物组分对土壤磷活化的作用,阐明其机制和活化效果,可为土壤磷活化剂的研发提供依据。
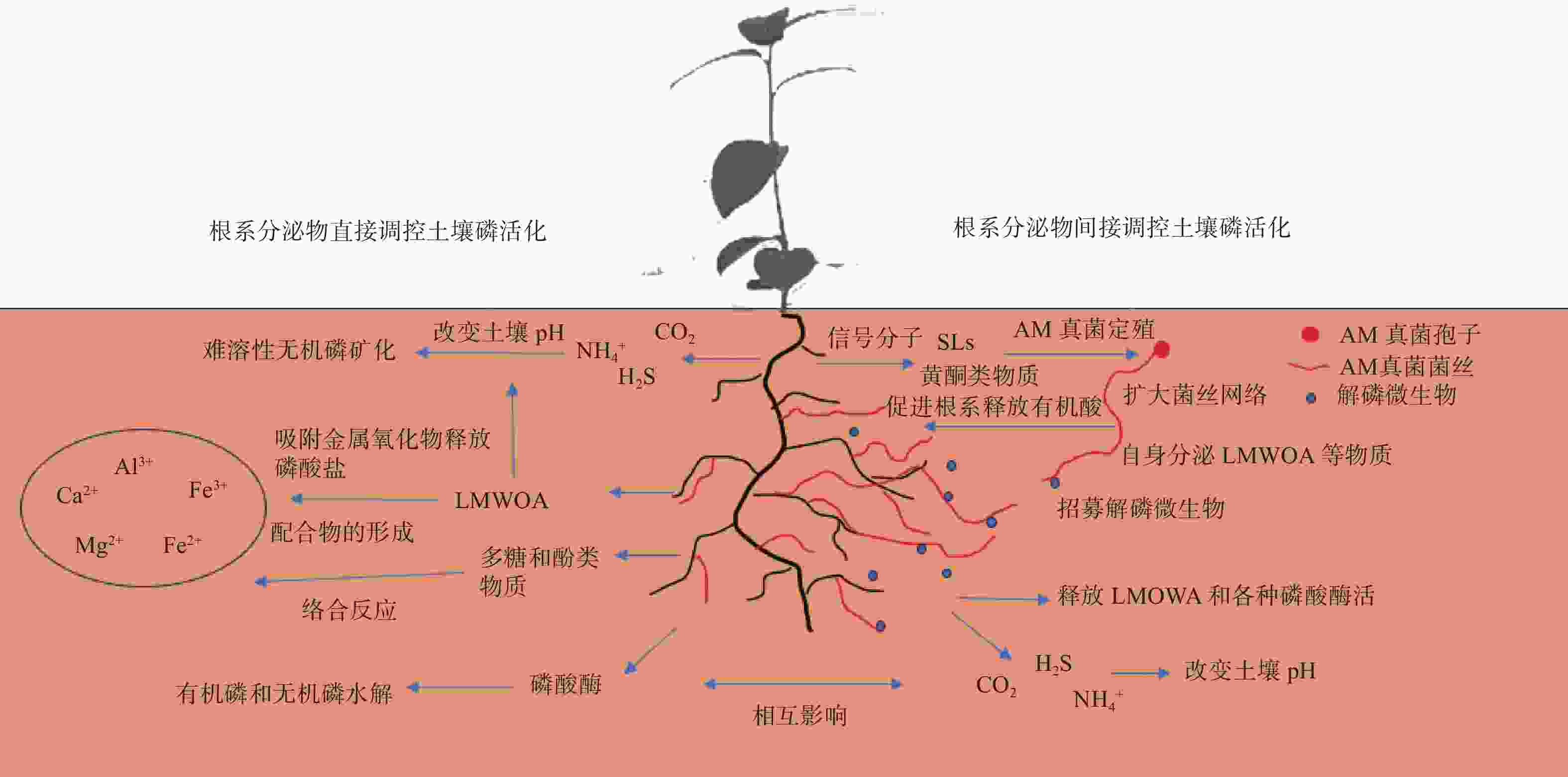
图 2 根系分泌物提高土壤磷有效性的主要作用途径
Figure 2. The main mechanism of root exudates to improve soil phosphorus availability
近年来,根系分泌物对土壤磷有效性的研究不仅在研究技术和方法,还在研究成果转化和实践生产是都取得一定进展。然而,根系分泌物增强土壤磷有效性的研究还需要从以下几个方面更加深入研究:1)根系分泌物的收集和检测方法的改进。目前对根系分泌物的收集方法种类较多,但存在差异[90]。室内盆栽试验通常有水培收集、土培收集和基质培收集等[90]。不同种类收集方式各有优劣势,然而哪一种更能体现原位状态下根系分泌物释放尚不可知。孙晨瑜等[91]研究结果表明水培根系分泌物含量结果与土培收集结果差异显著,这无疑阻碍了根系分泌物的研究进展。此外,由Phillips等[92]设计并由中国科学院尹华军团队改进的根系分泌物原位收集装置的问世,一定程度简化了操作流程,真实地反应根系分泌物的质量和数量。但同时,自然无菌条件难以控制,无法避免微生物和土粒本身的干扰。因此,未来应结合最新技术,研发高效全面的根系分泌物原位收集装置,避免收集过程污染和微生物分解等问题。2)探究不同植物根系分泌物特性。不同种植物根系分泌物质量和数量差距显著[50]。不同种植模式与种植方式的搭配运用,可以促进土壤资源优势互补,提高经济效应。3)加强根系分泌物与根际微生物的信息交流研究。本文仅阐述了植物根系如何释放SLs来促进AM真的定殖以及其生物有效性。了解根际“信号分子”的作用机制,有望通过生物途径定向调控根际微生物群落,以激活更多土壤中无效态磷源。4)探索根系分泌物与磷肥之间的协同增效机制[6]。根系分泌物的添加可以提高土壤磷有效性,赋予根系分泌物对磷肥减施重要实践意义。进行外源根系分泌物和磷肥减施的野外田间试验,深入探究根系分泌物组分与磷肥之间的协同增效机制,以及根系分泌与磷肥配施对土壤化学元素平衡供给和土壤养分有效性的影响,为减少磷肥的田间施用,实现农林“减磷不减产”提供科学依据和实践方法。
根系分泌物提高土壤磷有效性研究概述
Root Exudates Improving Soil Phosphorus Availability: A Review
-
摘要: 磷是植物生长过程中所必需的矿质营养元素,在植物生长发育过程起重要作用。尽管大多数土壤具有足够的总磷储量,但土壤中的有机磷与无机磷大多表现出了低溶解度和低有效性,导致土壤可利用磷含量极低。植物根系分泌物是土壤界面能量、物质和信息传递的重要媒介,可以直接活化土壤无效态磷,也可以通过招募根际微生物间接提高土壤磷的生物有效性。本文结合国内外已有研究,阐明不同根系分泌物提高土壤磷有效性的潜在作用机制,论述根系分泌物如何招募根际微生物促进土壤磷活化,并对未来研究方向进行展望。以期为解析植物磷高效利用机理和培育磷高效利用品种提供理论基础。Abstract: Phosphorus is an essential mineral nutrient element that plays an important role in plant growth and development. Although most soils have sufficient total phosphorus reserves, most of the organic and inorganic phosphorus in the soil exhibit low solubility and low available, leading to the extremely low soil available phosphorus content. Plant root exudates are important mediators linking energy, matter and information transfer at the interface between the plant root system and the soil. They can directly regulate the activation of soil ineffective phosphorus, and also can indirectly improve the bioavailability of soil phosphorus by recruiting inter-root microorganisms. In this paper, the potential mechanisms of different root exudates to improve soil phosphorus effectiveness are elucidated, and how root exudates can recruit inter-root microorganisms to promote soil phosphorus activation is discussed in the light of the existing studies at home and abroad. Meanwhile, the future research direction is also prospected. It will provide a theoretical basis for analyzing the mechanism of efficient plant phosphorus utilization and cultivating phosphorus efficient varieties.
-
Key words:
- soil phosphorus
- / root exudates
- / organic acids
- / rhizosphere microorganisms
-
[1] VANCE C P, UHDE-STONE C, ALLAN D L. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource[J]. New phytologist, 2003, 157(3): 423-447. doi: 10.1046/j.1469-8137.2003.00695.x [2] LAMBERS H, FINNEGAN P M, LALIBERTÉ E, et al. Phosphorus nutrition of Proteaceae in severely phosphorus-impoverished soils: are there lessons to be learned for future crops[J] Plant Physiology, 2011, 156(3): 1058-1066. [3] BÜNEMANN E K. Assessment of gross and net mineralization rates of soil organic phosphorus–A review[J]. Soil Biology and Biochemistry, 2015, 89: 82-98. doi: 10.1016/j.soilbio.2015.06.026 [4] BALEMI T, NEGISHO K. Management of soil phosphorus and plant adaptation mechanisms to phosphorus stress for sustainable crop production: a review[J]. Journal of soil science and plant nutrition, 2012, 12(3): 547-562. [5] GONG H, MENG F, WANG G, et al. Toward the sustainable use of mineral phosphorus fertilizers for crop production in China: From primary resource demand to final agricultural use[J]. Science of The Total Environment, 2022, 804: 150183. doi: 10.1016/j.scitotenv.2021.150183 [6] 王永壮, 陈 欣, 史 奕, 等. 低分子量有机酸对土壤磷活化及其机制研究进展[J]. 生态学杂志, 2018, 37(7):2189-2198. [7] ZHU J, LI M, WHELAN M. Phosphorus activators contribute to legacy phosphorus availability in agricultural soils: A review[J]. Science of the Total Environment, 2018, 612: 522-537. doi: 10.1016/j.scitotenv.2017.08.095 [8] VENEKLAAS E J, LAMBERS H, BRAGG J, et al. Opportunities for improving phosphorus–use efficiency in crop plants[J]. New phytologist, 2012, 195(2): 306-320. doi: 10.1111/j.1469-8137.2012.04190.x [9] 田 江, 梁翠月, 陆 星, 等. 根系分泌物调控植物适应低磷胁迫的机制[J]. 华南农业大学学报, 2019, 40(5):175-185. [10] CHEN Y, BONKOWSKI M, SHEN Y, et al. Root ethylene mediates rhizosphere microbial community reconstruction when chemically detecting cyanide produced by neighbouring plants[J]. Microbiome, 2020, 8(1): 1-17. doi: 10.1186/s40168-019-0777-4 [11] JIN K, WHITE P J, WHALLEY W R, et al. Shaping an optimal soil by root–soil interaction[J]. Trends in Plant Science, 2017, 22(10): 823-829. doi: 10.1016/j.tplants.2017.07.008 [12] BHATTACHARYYA P, DAS S, ADHYA T. Root exudates of rice cultivars affect rhizospheric phosphorus dynamics in soils with different phosphorus statuses[J]. Communications in soil science and plant analysis, 2013, 44(10): 1643-1658. doi: 10.1080/00103624.2013.769562 [13] 杨松花, 石贵阳, 王晶琴, 等. 低磷胁迫下大豆根系分泌物对土壤中难溶性磷的影响[J]. 浙江农业学报, 2023, 35(6):1396-1406. [14] YANG F, QU J, HUANG X, et al. Phosphorus deficiency leads to the loosening of activated sludge: The role of exopolysaccharides in aggregation[J]. Chemosphere, 2022, 290: 133385. doi: 10.1016/j.chemosphere.2021.133385 [15] DUAN X, YU X, LI Z, et al. Iron-bound organic carbon is conserved in the rhizosphere soil of freshwater wetlands[J]. Soil Biology and Biochemistry, 2020, 149: 107949. doi: 10.1016/j.soilbio.2020.107949 [16] DUFF S M, SARATH G, PLAXTON W C. The role of acid phosphatases in plant phosphorus metabolism[J]. Physiologia plantarum, 1994, 90(4): 791-800. doi: 10.1111/j.1399-3054.1994.tb02539.x [17] LIU D. Root developmental responses to phosphorus nutrition[J]. Journal of Integrative Plant Biology, 2021, 63(6): 1065-1090. doi: 10.1111/jipb.13090 [18] LIU P D, XUE Y B, CHEN Z J, et al. Characterization of purple acid phosphatases involved in extracellular dNTP utilization in Stylosanthes[J]. Journal of Experimental Botany, 2016, 67(14): 4141-4154. doi: 10.1093/jxb/erw190 [19] WANG L, LIU D. Functions and regulation of phosphate starvation-induced secreted acid phosphatases in higher plants[J]. Plant science, 2018, 271: 108-116. doi: 10.1016/j.plantsci.2018.03.013 [20] 陈隆升, 陈永忠, 彭邵锋, 等. 油茶对低磷胁迫的生理生化效应研究[J]. 林业科学研究, 2010, 23(5):782-786. [21] LI S M, LI L, ZHANG F, et al. Acid phosphatase role in chickpea/maize intercropping[J]. Annals of Botany, 2004, 94(2): 297-303. doi: 10.1093/aob/mch140 [22] LIANG C, TIAN J, LAM H-M, et al. Biochemical and molecular characterization of PvPAP3, a novel purple acid phosphatase isolated from common bean enhancing extracellular ATP utilization[J]. Plant physiology, 2010, 152(2): 854-865. doi: 10.1104/pp.109.147918 [23] WANG L, LI Z, QIAN W, et al. The Arabidopsis purple acid phosphatase AtPAP10 is predominantly associated with the root surface and plays an important role in plant tolerance to phosphate limitation[J]. Plant Physiology, 2011, 157(3): 1283-1299. doi: 10.1104/pp.111.183723 [24] WU W, LIN Y, LIU P, et al. Association of extracellular dNTP utilization with a GmPAP1-like protein identified in cell wall proteomic analysis of soybean roots[J]. Journal of Experimental Botany, 2018, 69(3): 603-617. doi: 10.1093/jxb/erx441 [25] NAKAZATO H, OKAMOTO T, NISHIKOORI M, et al. The glycosylphosphatidylinositol-anchored phosphatase from Spirodela oligorrhiza is a purple acid phosphatase[J]. Plant physiology, 1998, 118(3): 1015-1020. doi: 10.1104/pp.118.3.1015 [26] 刘攀道, 黄 睿, 许文茸, 等. 植物紫色酸性磷酸酶的研究进展[J]. 热带作物学报, 2019, 40(2):410-416. [27] 周梦岩, 赵铭臻, 李亚超, 等. 杉木紫色酸性磷酸酶基因ClPAP18b的克隆及表达分析[J]. 植物营养与肥料学报, 2021, 27(7):1234-1246. [28] ANTONYUK S V, OLCZAK M, OLCZAK T, et al. The structure of a purple acid phosphatase involved in plant growth and pathogen defence exhibits a novel immunoglobulin-like fold[J]. International Union of Crystallography, 2014, 1(2): 101-109. doi: 10.1107/S205225251400400X [29] DURMUS A, EICKEN C, HORST SIFT B, et al. The active site of purple acid phosphatase from sweet potatoes (Ipomoea batatas) metal content and spectroscopic characterization[J]. European Journal of Biochemistry, 1999, 260(3): 709-716. doi: 10.1046/j.1432-1327.1999.00230.x [30] LU L, QIU W, GAO W, et al. OsPAP10c, a novel secreted acid phosphatase in rice, plays an important role in the utilization of external organic phosphorus[J]. Plant, Cell & Environment, 2016, 39(10): 2247-2259. [31] LIU P, CAI Z, CHEN Z, et al. A root‐associated purple acid phosphatase, SgPAP23, mediates extracellular phytate‐P utilization in Stylosanthes guianensis[J]. Plant, Cell & Environment, 2018, 41(12): 2821-2834. [32] PEÑA A. A comprehensive review of recent research concerning the role of low molecular weight organic acids on the fate of organic pollutants in soil[J]. Journal of Hazardous Materials, 2022, 434: 128875. doi: 10.1016/j.jhazmat.2022.128875 [33] 叶思诚, 谭晓风, 袁 军, 等. 油茶根系及分泌物中有机酸的HPLC法测定[J]. 南京林业大学学报(自然科学版), 2013, 37(6):59-63. [34] 庞 丽, 张 一, 周志春, 等. 模拟氮沉降对低磷胁迫下马尾松不同家系根系分泌和磷效率的影响[J]. 植物生态学报, 2014, 38(1):27-35. [35] ANDERSSON K O, TIGHE M K, GUPPY C N, et al. Incremental acidification reveals phosphorus release dynamics in alkaline vertic soils[J]. Geoderma, 2015, 259: 35-44. [36] STRÖM L, OWEN A G, GODBOLD D L, et al. Organic acid behaviour in a calcareous soil implications for rhizosphere nutrient cycling[J]. Soil Biology and Biochemistry, 2005, 37(11): 2046-2054. doi: 10.1016/j.soilbio.2005.03.009 [37] LAN M, COMERFORD N, FOX T. Organic anions' effect on phosphorus release from spodic horizons[J]. Soil Science Society of America Journal, 1995, 59(6): 1745-1749. doi: 10.2136/sssaj1995.03615995005900060034x [38] 张乃于, 闫双堆, 李 娟, 等. 低分子量有机酸对土壤磷组分影响的Meta分析[J]. 植物营养与肥料学报, 2019, 25(12):2076-2083. [39] 张金昕, 高良敏, 庞振东, 等. 低分子有机酸对林地土壤磷释放及活化影响[J]. 科学技术与工程, 2022, 22(24):10470-10477. [40] 陈立新, 梁薇薇, 段文标, 等. 3种低分子质量有机酸对温带典型林型土壤无机磷组分的影响[J]. 南京林业大学学报(自然科学版), 2018, 42(4):75-82. [41] TAGHIPOUR M, JALALI M. Effect of low-molecular-weight organic acids on kinetics release and fractionation of phosphorus in some calcareous soils of western Iran[J]. Environmental Monitoring and Assessment, 2013, 185: 5471-5482. doi: 10.1007/s10661-012-2960-y [42] KREMER C, TORRES J, BIANCHI A, et al. Myo-inositol hexakisphosphate: Coordinative versatility of a natural product[J]. Coordination Chemistry Reviews, 2020, 419: 213403. doi: 10.1016/j.ccr.2020.213403 [43] GILES C D, HSU P C L, RICHARDSON A E, et al. Plant assimilation of phosphorus from an insoluble organic form is improved by addition of an organic anion producing Pseudomonas sp[J]. Soil Biology and Biochemistry, 2014, 68: 263-269. doi: 10.1016/j.soilbio.2013.09.026 [44] WANG Y, CHEN X, WHALEN J K, et al. Kinetics of inorganic and organic phosphorus release influenced by low molecular weight organic acids in calcareous, neutral and acidic soils[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(4): 555-566. doi: 10.1002/jpln.201500047 [45] WEI L, CHEN C, XU Z. Citric acid enhances the mobilization of organic phosphorus in subtropical and tropical forest soils[J]. Biology and Fertility of Soils, 2010, 46: 765-769. doi: 10.1007/s00374-010-0464-x [46] TRIPATHI K. Effect of organic acid on phosphorus-use efficiency by clusterbean (Cyamopsis tetragonoloba) in arid soil of Rajasthan[J]. Indian journal of agricultural science, 2005, 75(10): 651-653. [47] 廖新荣, 梁嘉伟, 梁 善, 等. 不同种类小分子有机酸对砖红壤磷素形态转化的影响[J]. 华南农业大学学报, 2017, 38(5):30-35. [48] ZHU H, BING H, WU Y, et al. Low molecular weight organic acids regulate soil phosphorus availability in the soils of subalpine forests, eastern Tibetan Plateau[J]. Catena, 2021, 203: 105328. doi: 10.1016/j.catena.2021.105328 [49] 蔡银美, 赵庆霞, 张成富. 低磷下植物根系分泌物对土壤磷转化的影响研究进展[J]. 东北农业大学学报, 2021, 52(2):79-86. [50] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3):298-310. [51] 陆玉芳, 施卫明. 根际化学信号物质与土壤养分转化[J]. 生物技术通报, 2020, 36(9):14-24. [52] SMITH S E, READ D J. Mycorrhizal symbiosis[M]. Academic press, 2010. [53] SMITH S E, SMITH F A, JAKOBSEN I. Mycorrhizal fungi can dominate phosphate supply to plants irrespective of growth responses[J]. Plant physiology, 2003, 133(1): 16-20. doi: 10.1104/pp.103.024380 [54] BERDENI D, COTTON T E A, DANIELL T J, et al. The effects of arbuscular mycorrhizal fungal colonisation on nutrient status, growth, productivity, and canker resistance of apple (Malus pumila)[J]. Frontiers in microbiology, 2018, 9: 1461. doi: 10.3389/fmicb.2018.01461 [55] 林宇岚, 王 琳, 楼玫娟, 等. AM真菌与有机磷配施对油茶光合特性的影响[J]. 江西农业大学学报, 2021, 43(1):136-143. [56] COOK C, WHICHARD L P, TURNER B, et al. Germination of witchweed (Striga lutea Lour. ): isolation and properties of a potent stimulant[J]. Science, 1966, 154(3753): 1189-1190. doi: 10.1126/science.154.3753.1189 [57] FIORILLI V, VALLINO M, BISELLI C, et al. Host and non-host roots in rice: cellular and molecular approaches reveal differential responses to arbuscular mycorrhizal fungi[J]. Frontiers in Plant Science, 2015, 6: 636. [58] LÓPEZ-RÁEZ J A, CHARNIKHOVA T, GÓMEZ-ROLDÁN V, et al. Tomato strigolactones are derived from carotenoids and their biosynthesis is promoted by phosphate starvation[J]. New Phytologist, 2008, 178(4): 863-874. doi: 10.1111/j.1469-8137.2008.02406.x [59] BALZERGUE C, PUECH-PAGÈS V, BÉCARD G, et al. The regulation of arbuscular mycorrhizal symbiosis by phosphate in pea involves early and systemic signalling events[J]. Journal of experimental botany, 2011, 62(3): 1049-1060. doi: 10.1093/jxb/erq335 [60] BREUILLIN F, SCHRAMM J, HAJIREZAEI M, et al. Phosphate systemically inhibits development of arbuscular mycorrhiza in Petunia hybrida and represses genes involved in mycorrhizal functioning[J]. The Plant Journal, 2010, 64(6): 1002-1017. doi: 10.1111/j.1365-313X.2010.04385.x [61] TIAN B, PEI Y, HUANG W, et al. Increasing flavonoid concentrations in root exudates enhance associations between arbuscular mycorrhizal fungi and an invasive plant[J]. The ISME journal, 2021, 15(7): 1919-1930. doi: 10.1038/s41396-021-00894-1 [62] XING Z, MA T, WU L, et al. Foliar herbivory modifies arbuscular mycorrhizal fungal colonization likely through altering root flavonoids[J]. Functional Ecology, 2023. [63] 黄雨轩, 林宇岚, 张林平, 等. AM 真菌和无机磷对油茶苗磷吸收和培养土壤磷组分的影响[J]. 林业科学研究, 2022, 35(5):33-41. [64] HUANG Y, LIN Y, ZHANG L, et al. Effects of Interaction between Claroideogolmus etuicatum and Bacillus aryabhattai on the Utilization of Organic Phosphorus in Camellia oleifera Abel[J]. Journal of Fungi, 2023, 9(10): 977. doi: 10.3390/jof9100977 [65] 薛英龙, 李春越, 王苁蓉, 等. 丛枝菌根真菌促进植物摄取土壤磷的作用机制[J]. 水土保持学报, 2019, 33(6):10-20. [66] SCHNEPF A, JONES D, ROOSE T. Modelling nutrient uptake by individual hyphae of arbuscular mycorrhizal fungi: temporal and spatial scales for an experimental design[J]. Bulletin of Mathematical Biology, 2011, 73: 2175-2200. doi: 10.1007/s11538-010-9617-1 [67] XIE X, WENG B, CAI B, et al. Effects of arbuscular mycorrhizal inoculation and phosphorus supply on the growth and nutrient uptake of Kandelia obovata (Sheue, Liu & Yong) seedlings in autoclaved soil[J]. Applied Soil Ecology, 2014, 75: 162-171. doi: 10.1016/j.apsoil.2013.11.009 [68] WU F, LI Z, LIN Y, et al. Effects of Funneliformis mosseae on the utilization of organic phosphorus in Camellia oleifera Abel[J]. Canadian Journal of Microbiology, 2021, 67(5): 349-357. doi: 10.1139/cjm-2020-0227 [69] LIU Y, MUHAMMAD I, ALLAH D, et al. Response of growth, antioxidant enzymes and root exudates production towards As stress in Pteris vittata and in Astragalus sinicus colonized by arbuscular mycorrhizal fungi[J]. Environmental Science and Pollution Research, 2020, 27: 2340-2352. doi: 10.1007/s11356-019-06785-5 [70] MA J, WANG W, YANG J, et al. Mycorrhizal symbiosis promotes the nutrient content accumulation and affects the root exudates in maize[J]. BMC Plant Biology, 2022, 22(1): 64. doi: 10.1186/s12870-021-03370-2 [71] ZHANG L, XU M, LIU Y, et al. Carbon and phosphorus exchange may enable cooperation between an arbuscular mycorrhizal fungus and a phosphate-solubilizing bacterium[J]. New Phytologist, 2016, 210(3): 1022-1032. doi: 10.1111/nph.13838 [72] BHARADWAJ D P, ALSTRÖM S, LUNDQUIST P-O. Interactions among Glomus irregulare, arbuscular mycorrhizal spore-associated bacteria, and plant pathogens under in vitro conditions[J]. Mycorrhiza, 2012, 22: 437-447. doi: 10.1007/s00572-011-0418-7 [73] EFTHYMIOU A, GRØNLUND M, MÜLLER-STÖVER D S, et al. Augmentation of the phosphorus fertilizer value of biochar by inoculation of wheat with selected Penicillium strains[J]. Soil Biology and Biochemistry, 2018, 116: 139-147. doi: 10.1016/j.soilbio.2017.10.006 [74] 孙宁康, 江飞焰, 张 林, 等. 丛枝菌根真菌 Rhizophagus irregularis 菌丝分泌物可诱导解磷细菌 Rahnella aquatilis 向菌丝移动[J]. 科学通报, 2021, 66(32):4157-4168. [75] ZHANG L, FAN J, DING X, et al. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil[J]. Soil Biology and Biochemistry, 2014, 74: 177-183. doi: 10.1016/j.soilbio.2014.03.004 [76] 陶冬雪, 高英志. 土壤解磷微生物促进植物磷素吸收策略研究进展[J]. 生态学报, 2023, 43(11):4390-4399. [77] DINESH R, SRINIVASAN V, PRAVEENA R, et al. Exploring the potential of P solubilizing rhizobacteria for enhanced yield and quality in turmeric (Curcuma longa L. )[J]. Industrial Crops and Products, 2022, 189: 115826. doi: 10.1016/j.indcrop.2022.115826 [78] YU X, LIU X, ZHU T H, et al. Co-inoculation with phosphate-solubilzing and nitrogen-fixing bacteria on solubilization of rock phosphate and their effect on growth promotion and nutrient uptake by walnut[J]. European Journal of Soil Biology, 2012, 50: 112-117. doi: 10.1016/j.ejsobi.2012.01.004 [79] 韩玲玲. 黄顶菊根系分泌物对芽孢杆菌功能的影响及其主效化感物质的鉴定[D]. 保定: 河北大学, 2021. [80] 王雪菲. 解磷细菌 YL6 在小白菜植株中的定殖及促生机制研究[D]. 咸阳: 西北农林科技大学, 2019. [81] TAN S, YANG C, MEI X, et al. The effect of organic acids from tomato root exudates on rhizosphere colonization of Bacillus amyloliquefaciens T-5[J]. Applied Soil Ecology, 2013, 64: 15-22. doi: 10.1016/j.apsoil.2012.10.011 [82] KHAN M S, ZAIDI A, AHMAD E. Mechanism of phosphate solubilization and physiological functions of phosphate-solubilizing microorganisms[J]. Phosphate solubilizing microorganisms: principles and application of microphos technology, 2014: 31-62. [83] WANG Y, LUO D, XIONG Z, et al. Changes in rhizosphere phosphorus fractions and phosphate-mineralizing microbial populations in acid soil as influenced by organic acid exudation[J]. Soil and Tillage Research, 2023, 225: 105543. doi: 10.1016/j.still.2022.105543 [84] LONG X E, YAO H, HUANG Y, et al. Phosphate levels influence the utilisation of rice rhizodeposition carbon and the phosphate-solubilising microbial community in a paddy soil[J]. Soil Biology and Biochemistry, 2018, 118: 103-114. doi: 10.1016/j.soilbio.2017.12.014 [85] 董丽红, 郭庆港, 张晓云, 等. 棉花根系分泌物对枯草芽胞杆菌 NCD-2 生物膜形成和根际定殖的影响[J]. 植物病理学报, 2015, 45(5):541-547. [86] LAHEURTE F, BERTHELIN J. Effect of a phosphate solubilizing bacteria on maize growth and root exudation over four levels of labile phosphorus[J]. Plant and Soil, 1988, 105: 11-17. doi: 10.1007/BF02371137 [87] 魏 畅, 戚秀秀, 吴 越, 等. 砂质潮土高效溶磷菌的筛选鉴定、条件优化及应用[J]. 生物技术通报, 2021, 37(4):85-95. [88] 王玉书. 外源物质对无机磷细菌生长和溶磷作用的影响[D]. 重庆: 西南大学, 2018. [89] PANTIGOSO H A, MANTER D K, FONTE S J, et al. Root exudate-derived compounds stimulate the phosphorus solubilizing ability of bacteria[J]. Scientific Reports, 2023, 13(1): 4050. doi: 10.1038/s41598-023-30915-2 [90] 郭婉玑, 张子良, 刘 庆, 等. 根系分泌物收集技术研究进展[J]. 应用生态学报, 2019, 30(11):3951-3962. [91] 孙晨瑜, 曾燕红, 马俊卿, 等. 丛枝菌根真菌对黄花蒿生长和根系分泌物化学组成的影响[J]. 热带作物学报, 2020, 41(9):1831-1837. [92] PHILLIPS R P, ERLITZ Y, BIER R, et al. New approach for capturing soluble root exudates in forest soils[J]. Functional Ecology, 2008, 22(6): 990-999. doi: 10.1111/j.1365-2435.2008.01495.x -





 下载:
下载:

