-
磷是林木生长发育所必需的矿质营养元素之一,由于南方酸性土壤对磷的强烈化学固定作用,致使土壤磷素多以Fe-P、Al-P和O-P等难溶态存在,即土壤全磷含量高,而林木可吸收利用的有效磷低[1-2],因此土壤有效磷不足一直是限制南方人工林产量的重要因素[3]。植物在长期的进化过程中,为适应低磷环境形成了复杂的响应调控机制[4]。在磷胁迫条件下这些植物能明显感受到环境的低磷逆境,并能诱导体内产生胁迫信号,引起植物一系列生理生化过程的改变,以增加在磷胁迫条件下完成生命周期的机会。
在我国南方,杉木(Cunninghamia lanceolata (Lamb.)Hook)是人工商品林的当家树种,其生长迅速、产量和质量高,在南方16个省区内均有栽培,栽培历史达到一千多年[5-6]。在长期的演化过程中,杉木体内形成了许多对养分及环境胁迫的适应性机制,前期研究证实,耐低磷杉木基因型在感受环境低磷胁迫后,能诱导体内产生胁迫信号,根系分泌一定数量有机酸,活化土壤中难溶性磷,提高土壤有效磷含量,改善其体内磷的营养状况等过程来适应低磷胁迫逆境[7]。
细胞内的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等酶促系统,是植物抵抗养分胁迫引起氧化胁迫的关键[8]。如潘晓华[9]等研究结果表明,植物抵抗逆境能力的高低与植物保护性酶系统的活性变化之间存在一定的关系。此外,逆境胁迫下不仅会影响植物正常生理功能,而且也会造成植物新陈代谢紊乱,引起植物体内养分吸收失去平衡,改变植物体内化学组分[10]。但是低磷胁迫下杉木养分吸收和体内化学组成是如何变化, 目前尚未有相关文献报道。
傅里叶红外光谱(FTIR)是一种主要基于化合物中极性键和官能团振动的结构分析技术[11]。目前国内外已有一些利用FTIR来研究缺磷[12-14]、缺氮[14]、缺钙[15]等养分胁迫下植物体内化学组分的变化,但是对缺磷条件下杉木不同部位化学组分进行FTIR的研究较少。
有鉴于此,本试验选用杉木幼苗,研究低磷胁迫对杉木幼苗各种抗氧化酶等生理指标的变化影响,探讨抗氧化酶活性与杉木耐低磷能力的关系,揭示低磷胁迫下杉木养分吸收的适应机制,并结合FTIR法测定杉木幼苗不同部位的光谱特性,阐明杉木体内生物大分子对低磷胁迫的响应。
-
植物材料为福建省漳平五一国有林场的1.5代杉木种子园精选的种子经过浸泡消毒后移至培养皿中,待胚芽露出后播种到营养土中并放置在培养箱内培养4个月后,于2016年9月选择生长均一的杉木苗用清水洗干净,再用蒸馏水清洗后,移植到装有500 mL纯水的小红盆中并放到培养箱中培养2天,并依次用1/2和完全Hoagland培养液在小红盆中各培养1~2天。培养期间昼/夜温度为25 ℃/20 ℃,光照时间14 h。预培养5天后,参照陈智裕[16]等人的研究方法,设无磷(0 mmol·L-1),1/4供磷(0.25 mmol·L-1),1/2供磷(0.50 mmol·L-1),正常磷(1.00 mmol·L-1) 4个浓度梯度,其中正常供磷浓度主要是参考杉木人工林土壤有效磷含量设置[17]。磷由KH2PO4提供,用KCl平衡不同供磷处理间K +的差异。每个小红盆分别添加不同磷处理浓度的营养液500 mL进行培养,每盆5株幼苗,每2天更换1次营养液,每个处理4盆,共80株苗。前期实验证明杉木不适合长时间进行水培,从吴鹏飞[17]等人的研究可以得出,水培8天足够引起杉木苗的生理学机制对低磷胁迫的应答,因此培养8天后取样分析。处理期间营养液pH维持在4.5左右。
-
称取叶片或根系0.2 g,加0.05 mol·L-1 pH = 7.8的磷酸缓冲液4 mL于冰浴中的研钵内研磨成匀浆,于4 ℃下10 000 r·min-1冷冻离心20 min,上清液即为待测酶液。
超氧化物歧化酶(SOD)活性采用氮蓝四唑法[18-19];过氧化氢酶(CAT)活性采用紫外吸收法[18];过氧化物酶(POD)活性采用愈创木酚法[18];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[18]。叶绿素含量采用张宪政的乙醇-丙酮提取法[20]。
-
将杉木幼苗分根和叶用105℃杀青后用80℃烘干至恒质量,采用HNO3-HClO4消煮,参照蒋天成[21]等人的ICP法(略有改动),用电感耦合等离子体发射光谱仪(ICP-OES)测定植物Al、Ca、Cu、Fe、Mg、Mn、Na、K、P含量。波长范围为160~800 nm波长连续覆盖。
-
参照高丽丽[15]等人的方法,采用傅里叶变换红外光谱仪(型号:VERTEX 70,德国Bruker公司)测定杉木幼苗根和叶片的光谱特性。波数范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数32次。
-
本研究采用多元统计分析软件(SPSS 19.0)、Excel 2010和Origin 9.0对实验数据进行分析,表中数据均为平均值±标准误差,采用单因子方差分析(ANOVA),通过LSD进行显著性检验,此外,用Pearson相关系数分析各指标间的相关性。
-
经不同程度的供磷处理后,杉木幼苗根内的抗氧化酶SOD(F = 10.73,P= 0.02)、CAT(F = 9.31,P= 0.02)和POD(F = 7.46,P = 0.04) 的活性以及MDA含量(F = 8.82,P= 0.03)发生了显著变化,如表 1所示。低磷胁迫使杉木幼苗根的SOD、CAT活性随着磷胁迫的增加先升高后降低。这说明磷素对杉木幼苗SOD、CAT活性具有诱导作用,一定程度的缺磷使SOD、CAT活性增加,超过一定限度时使得SOD、CAT活性降低。不同的是,低磷胁迫使杉木幼苗根的POD活性随着磷胁迫的增加呈现出升高的趋势,特别是,无磷(0 mmol·L-1)处理比正常供磷(1.00 mmol·L-1)处理明显增加了68.47%,这表明低磷胁迫对杉木幼苗的POD活性具有显著诱导效应。通过对杉木幼苗根的MDA分析表明,随着磷胁迫的增加MDA呈现出先降低再升高后下降的趋势,究其原因可能是在抗氧化酶的作用下,低磷胁迫没有引起杉木苗根系细胞脂质过氧化,即低磷胁迫没有破坏其生物膜的结构与功能。
表 1 低磷胁迫对杉木苗根保护酶活性及MDA含量的影响
Table 1. Effect of low P stress on protective enzyme activity and MDA content in roots of Chinese fir seedlings
生化测定
Biochemical measurements磷浓度Phosphorus concentrations/(mmol·L-1) 0 0.25 0.50 1.00 SOD活性SOD activity/(U·g -1) 48.3±17.42a 103.9±2.30b 127.0±7.21b 117.6±10.09b CAT活性CAT activity/(U·g -1·min-1) 18.4±2.93a 32.2±0.80b 32.1±2.99b 30.9±0.97b POD活性POD activity/(U·g -1·min-1) 604.3±28.41b 484.0±61.59ab 460.5±15.99ab 358.7±24.38a MDA含量MDA content/(mmol·g-1) 1.5±0.12ab 1.6±0.08ab 1.3±0.04a 1.8±0.01b 注:不同小写字母间表示差异显著(P < 0.05); Note: Different lowercase letters indicate significant differences at P < 0.05 level -
经不同程度的供磷处理后,杉木幼苗叶片的抗氧化酶SOD(F = 11.36,P = 0.02)、CAT(F = 16.94,P = 0.01) 和POD(F = 8.25,P = 0.04) 的活性以及MDA含量(F = 10.21,P = 0.02)也发生了显著变化,如表 2所示。低磷胁迫使杉木幼苗叶片的SOD、CAT活性随着供磷程度的降低呈现出先升高后降低的趋势,说明一定程度的缺磷对杉木幼苗叶片中SOD、CAT活性具有显著诱导效应。而不同的是,低磷胁迫使杉木幼苗叶片的POD活性随着磷胁迫的增加呈现出先降低后升高的趋势。但是与正常供磷相比,低磷胁迫没有引起杉木幼苗叶片的MDA含量升高,这说明在抗氧化酶的作用下,低磷胁迫同样没有引起叶片脂质过氧化的产生。
表 2 低磷胁迫对杉木苗叶片保护酶活性及MDA含量的影响
Table 2. Effect of low P stress on protective enzyme activities and MDA content in leaves of Chinese fir seedlings
生化测定
Biochemical measurements磷浓度Phosphorus concentrations/(mmol·L-1) 0 0.25 0.50 1.00 SOD活性SOD activity/(U·g -1) 63.2±5.20a 67.1±6.58a 99.0±2.16b 66.5±4.90a CAT活性CAT activity/(U·g -1·min-1) 8.8±1.48a 9.1±0.53a 17.1±0.87b 5.7±1.52a POD活性POD activity/(U·g -1·min-1) 254.1±19.07b 131.5±14.80a 194.0±23.25ab 213.3±11.85ab MDA含量MDA content/(mmol·g-1) 4.3±0.17ab 3.7±0.15a 4.2±0.21ab 4.8±0.02b 注:不同小写字母间表示差异显著(P < 0.05); Note: Different lowercase letters indicate significant differences at P < 0.05 level. -
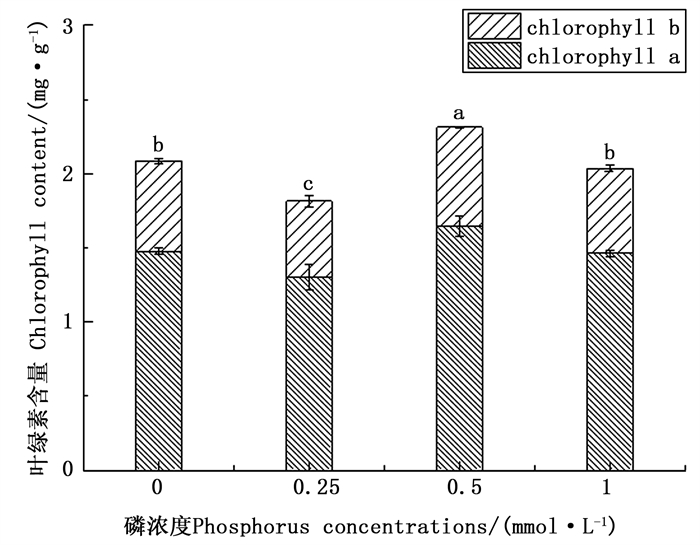
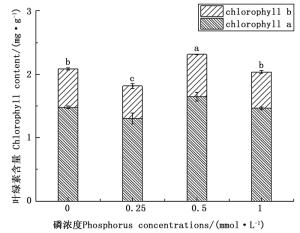
由图 1可以看出:随着磷胁迫的增加,杉木苗叶片的叶绿素总量和叶绿素a的含量呈现出先增加然后减少最后再增加的规律,叶绿素b的含量呈现出相同的变化趋势;这表明低磷胁迫对杉木苗光合作用产生了重要影响。
-
从图 2中可看出,随着磷胁迫的增加,杉木苗根系所含的Mn呈上升趋势(图 2-6),Al、Cu含量先降后升(图 2-1、图 2-3),Na的含量则变化很小(图 2-7),说明低磷胁迫显著提高杉木幼苗根系对Al、Cu、Mn元素的吸收。根系Fe和K的含量则有所下降(图 2-4和图 2-8),Ca含量先升后降(图 2-2)。杉木幼苗叶片中,Fe和Mn的含量随着磷胁迫的增加大体呈降低的趋势,Cu和K的含量呈先上升后下降的趋势,Ca含量与Mg(图 2-5)、Na含量的变化趋势相反,且当供磷浓度为0.25 mmol·L-1时,Mg和Na的含量显著高于正常供磷(P < 0.05),Ca含量则显著低于正常供磷处理(P < 0.05)。而杉木幼苗叶片中Al含量在不同浓度磷处理下基本没有变化。
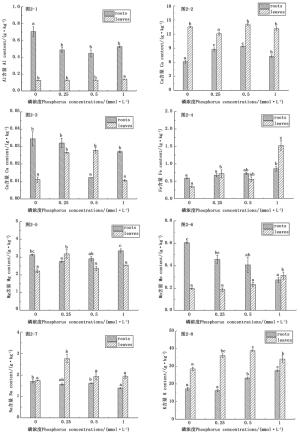
图 2 低磷胁迫对杉木幼苗根、叶金属元素含量的影响
Figure 2. Effects of low P stress on contents of metal elements in roots and leaves of Chinese fir seedlings
杉木幼苗根系Al含量在不同浓度磷处理下均大于叶片含量,而Ca、Na和K在叶片中的积累量大于根系。当供磷浓度为1.00 mmol·L-1时,杉木幼苗根系Mn含量小于叶片中Mn的积累量,随着磷胁迫的增加,根系Mn含量大于叶片中Mn的含量,这可能是由于低磷胁迫使Mn元素在植物体中的运输途径受阻,根系对Mn元素的吸收速率大于其运输速率。
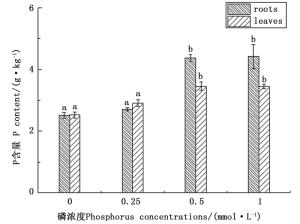
如图 3所示,随着磷胁迫的增加,根系和叶片中P含量均呈下降的趋势,无磷处理与正常供磷相比,杉木幼苗根系中P含量降低了42.99%,而叶片中P含量降低了26.96%,这可能是由于随着磷胁迫的增加,杉木幼苗从环境中所能吸收利用的磷素减少,从而使其体内的磷素积累量减少。
-
通过对磷浓度及杉木幼苗根系各养分含量之间的相关性进行Pearson相关分析,得出(表 3):Fe和磷浓度之间存在极显著的正相关关系(r = 0.998,P < 0.01),Mn和磷浓度之间存在显著的负相关关系(r =-0.975,P < 0.05),Fe和Mn、Na含量之间存在显著的负相关关系(r =-0.986,P < 0.05;r =-0.950,P < 0.05)。
表 3 磷浓度与杉木幼苗根系Al和各养分含量之间的相关系数及显著性检验
Table 3. Correlation coefficient between phosphorus concentration and Chinese fir seedling root Al and nutrient contents and significance test
项目Items 磷浓度Phosphorus concentration Al Ca Cu Fe K Mg Mn Na 磷浓度Phosphorus concentration 1 Al -0.527 1 Ca 0.193 -0.931 1 Cu -0.398 0.695 -0.71 1 Fe 0.998** -0.558 0.224 -0.378 1 K 0.932 -0.381 0.09 -0.541 0.905 1 Mg 0.547 0.411 -0.679 0.139 0.506 0.669 1 Mn -0.975* 0.685 -0.375 0.436 -0.986* -0.85 -0.353 1 Na -0.935 0.444 -0.088 0.088 -0.950* -0.759 -0.504 0.933 1 **. 在0.01水平(双侧)上显著相关。*. 在0.05水平(双侧)上显著相关。
**. Indicates significant differences at P < 0.01 level. *. significant differences at P < 0.05 level.通过对磷浓度及杉木幼苗叶片各养分含量之间的相关性进行Pearson相关分析,得出(表 4):Al和磷浓度之间存在显著的正相关关系(r = 0.969,P < 0.05),Al和Fe、Mn之间存在显著的正相关关系(r = 0.957,P < 0.05;r = 0.981,P < 0.05),Mg和Na之间存在显著的正相关关系(r = 0.980,P < 0.05)。
表 4 磷浓度与杉木幼苗叶片Al和各养分含量之间的相关系数及显著性检验
Table 4. Correlation coefficient between phosphorus concentration and Chinese fir seedling leaf Al and nutrient contents and significance test
项目Items 磷浓度Phosphorus concentration Al Ca Cu Fe K Mg Mn Na 磷浓度Phosphorus concentration 1 Al 0.969* 1 Ca 0.105 0.082 1 Cu -0.174 -0.408 -0.142 1 Fe 0.920 0.957* -0.211 -0.356 1 K 0.415 0.179 0.004 0.820 0.177 1 Mg 0.015 -0.061 -0.918 0.484 0.209 0.388 1 Mn 0.950 0.981* 0.273 -0.440 0.882 0.152 -0.246 1 Na -0.132 -0.233 -0.868 0.614 0.025 0.430 0.980* -0.403 1 *. 在0.05水平(双侧)上显著相关。
*. Indicates significant differences at P < 0.05 level. -
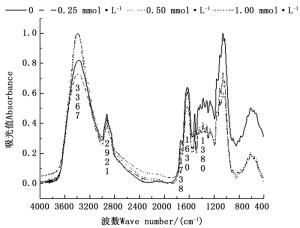
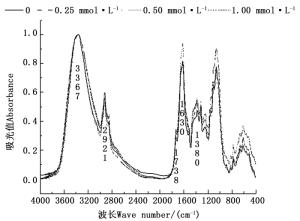
如图 4和图 5所示,在3 367 cm-1波数附近的峰为糖类O-H伸缩振动,主要来自杉木幼苗体内的糖类等碳水化合物[14-15]。与正常供磷处理相比,杉木苗根系在3 367 cm-1特征峰处吸光值随着营养液磷含量的降低而降低,而叶片在各种磷浓度处理下,其吸光值均相等,表明低磷胁迫造成杉木幼苗根系中糖类降低,却对叶片中糖类基本无影响。在2 921 cm-1波数附近为糖类CH3、CH2和CH伸缩振动以及羧酸O-H伸缩振动,主要来自于杉木幼苗植株内的碳水化合物、维生素、油脂、核酸[14-15]。杉木幼苗的根系在2 921 cm-1特征峰处吸光值低磷处理高于正常供磷处理,而叶片中低磷处理与正常供磷处理的差异较小,说明低磷胁迫只对杉木幼苗根系脂类化合物影响较大,促进其脂类化合物的合成,对叶片中脂类化合物影响较小。在1 738 cm-1波数附近为羧酸羰基C = O伸缩振动,在1 630 cm-1波数附近为羰基C = O伸缩振动(酰胺I),在1 380 cm-1波数附近为-CH2-、-CH3-的弯曲振动,主要来自蛋白质[14-15]。在1 738 cm-1附近的特征峰处,低磷处理的杉木幼苗根系的吸光值均比正常供磷处理高,而叶片中仅0.25 mmol·L-1磷浓度处理的吸光值比正常供磷处理高;在1 630 cm-1附近的特征峰处,0、0.50 mmol·L-1磷浓度处理的杉木苗根系的吸光值大于正常供磷处理,而叶片中各磷浓度处理的吸光值均大于正常供磷处理;在1 380 cm-1波数附近的特征峰吸光值,根系中0和0.50 mmol·L-1磷浓度处理大于正常供磷处理,叶片中0、0.50 mmol·L-1磷处理小于正常供磷处理,说明低磷胁迫对杉木幼苗中蛋白质、多肽和氨基酸类物质影响较大。1 150~1 000 cm-1是C-OH和C-O-C伸缩振动,主要来自醇、醚、酯或酚类等碳水化合物[14-15],杉木苗根系在该处的特征峰吸光值无磷处理大于正常供磷处理,说明低磷胁迫促进杉木苗根系碳水化合物的合成。
-
万美亮[22]等对甘蔗的耐低磷能力与保护酶系统的关系进行研究后,认为低磷胁迫诱导甘蔗体内保护酶系统活性升高,是植物耐低磷的生理机制之一。植物细胞抵抗逆境损伤的重要保护酶系统如SOD、CAT和POD等酶类是植物体内活性氧的清道夫,在清除植株体内多余的活性氧,避免细胞受到氧化损伤等过程中发挥着巨大的作用[23]。SOD是生物体内唯一一种以自由基作为底物的抗氧化酶,可通过歧化反应消除O2.-并生成H2O2(O2.-+ O2.-+2H+→H2O2+O2)[23],低于一定浓度的供磷水平使得SOD活性下降,说明杉木幼苗体内积累的O2.-含量超出SOD的清除能力。CAT是植物体内重要的H2O2清除酶之一[24],而H2O2能在CAT和POD的协同作用下分解生成H2O和O2[25]。低于一定浓度的供磷水平时,SOD活性下降而CAT的活性仍高于1.00 mmol·L-1的磷浓度处理,可能是在杉木幼苗细胞内除了SOD歧化产生的H2O2,还有其它来源导致H2O2积累;杉木幼苗根内的POD活性随着磷胁迫的增加呈现出升高的趋势,说明低磷胁迫诱导其POD活性的增加来清除杉木幼苗体内增加的H2O2,与林静雯[26]等人研究草甘膦对杉木种子萌发及幼苗生长的毒性效应的结果相似。由表 1和表 2可以看出,低磷胁迫对杉木幼苗根系的影响比叶片大,说明杉木幼苗根系对低磷胁迫更为敏感,可能原因是杉木幼苗首先由根系吸收有效磷素,然后再传输到茎、叶,而当土壤有效磷不足时,根系首先感知并发生生理响应,因此杉木幼苗根系受低磷胁迫的影响相对较大。本研究发现杉木幼苗根系和叶片的几种保护性酶(SOD、CAT和POD)活性在低磷胁迫后都发生了变化,在不同磷处理条件下的变化存在一定差异性,这与李俊等[24]对不同基因型油菜的研究结果相似。
MDA是生物膜系统膜脂过氧化作用的产物之一,对膜和细胞中的许多生物功能分子如蛋白质,核酸和酶等均有很强的破坏作用,导致细胞损伤,并参与破坏生物膜的结构与功能[27],除此之外,MDA也是反映植物受损伤后自我修复能力的重要指标之一[28]。与正常供磷水平相比,低磷胁迫使杉木幼苗的MDA含量减少,表明在低磷胁迫时杉木植株细胞的膜脂受到的伤害较轻,这是由于杉木幼苗体内保护酶活性的提高,能及时清除植株细胞内产生的自由基,这也进一步验证了低磷胁迫时杉木幼苗具备较强的自我修复能力,与李俊[24]等人对油菜以及陈隆升[29]等人对油茶的研究结果有相似之处。叶绿素是植物光合作用的主要色素,也是植物生长重要因素之一,其含量反映了植物的光合速率水平[26]。杉木幼苗叶绿素含量随着磷胁迫的增加呈现出显著的差异性(P < 0.05),表明低磷胁迫对杉木叶片光合作用各指标影响较大,可能是由于低磷胁迫对杉木叶片中叶绿素合成酶活性产生一定的影响,此外,本研究表明低磷处理造成杉木叶片含量Fe显著降低(图 2-4),相关研究证实Fe是许多重要酶的辅基,对叶绿体构造和合成有重要影响。因此低磷胁迫导致的叶片缺Fe也是造成叶绿素含量降低的重要原因。类似的是,黄勇[30]同样发现,低磷胁迫使得叶绿素含量降低差异显著,与之相反,陈秀铃[31]研究发现,邓恩桉叶片叶绿素含量在低磷胁迫下显著增加,说明不同的植物对缺磷环境的应答具有一定的差异性,植物可通过自身调节叶绿素含量来适应。
有研究发现,逆境胁迫不仅会影响植物叶的正常生理功能,而且会影响其根对养分的正常吸收和传导,造成植物体内营养元素间失去平衡,扰乱其体内的新陈代谢,从而对植物的生长发育产生影响[32]。本试验研究结果表明,低磷胁迫降低了杉木幼苗根系对大量元素K的吸收(图 2-8),说明低磷胁迫抑制杉木苗根系吸收该大量元素,其原因可能是低磷胁迫削弱了杉木植株的生理代谢过程,使得其没有充足的能量供根系细胞主动吸收大量元素K,与王娟[33]等对水生花愈伤组织的研究结果一致。K在植株的新陈代谢过程中发挥重要作用,其含量减少必将会影响杉木幼苗的正常生理过程。Ca元素是细胞壁的组成成分,同时也能使细胞中的膜结构保持稳定[34],本试验中杉木幼苗根系中Ca元素含量先增加后降低(图 2-2),表明低磷胁迫使得细胞中膜结构的稳定性发生变化。肖细元等认为逆境能增加植物对Ca的吸收,有利于维持植物细胞的正常结构和功能,提高其抵抗逆境的能力[35],但是植物细胞内Ca含量过高不利于以无机磷为基础的能量代谢过程[33]。Zobiole[36]等人研究发现,由于逆境抑制大豆植株内有机物的合成和分泌,使得其体内大量元素和微量元素积累量均减少。低磷胁迫下,大量元素P和微量元素Fe在杉木幼苗根系和叶片中的积累量均减少(图 3和图 2-4),与Zobiole[36]等人的研究结果相似。随着磷胁迫的增加,杉木幼苗对磷素的吸收和积累量减少,表明低磷胁迫时杉木幼苗能够调整好对其他养分元素的吸收浓度,来规避P素不足产生的危害,这与陈隆升[37]等人的研究结果相似。研究发现,磷素供应不足是光合作用及光合同化物在地上部分的茎、叶和地下部分的根系之间分配的重要影响因素[38]。本试验中低磷胁迫使得杉木幼苗植株的P素积累量降低,必然影响杉木幼苗的生长发育。在杉木幼苗根系中,Fe和Mn与磷浓度密切相关(r = 0.998,P < 0.01;r =-0.975,P < 0.05),说明杉木苗对养分元素的吸收利用易受外界不利因素的影响。低磷胁迫下,不同养分元素在杉木幼苗根系和叶片中积累量变化不同, 同种营养元素在杉木幼苗植株的不同部位中积累量变化也不同, 可能是因为营养元素在杉木植株的不同部位中所起的作用不同。
在逆境中,植物会通过不同部位糖类、氨基酸和蛋白质等物质含量的变化来响应逆境[39-40]。对比分析不同磷浓度处理下杉木幼苗根、叶FTIR光谱图 3 367、2 924、1 738、1 630、1 380、1 150~1 000 cm-1处特征峰吸光值的变化可以发现,杉木幼苗根和叶片对低磷胁迫存在一定的适应性,叶片受低磷胁迫的毒害程度较根轻。饶通德[41]等人研究发现,香附子的地上部分比地下部分受毒害程度轻。低磷胁迫对杉木幼苗根系和叶片组织在3 367、2 924、1 736、1 630、1 380、1 150~1 000 cm-1处特征峰吸光值影响不同,一定程度的缺磷处理时(与正常供磷处理相比)对根的生理过程影响很小,但是促进叶片中氨基酸、蛋白质和多肽类物质等有机物以及醇、醚、酯或酚类等碳水化合物的合成、分泌和运输;超过一定程度时可能抑制根系和叶片合成、分泌和运输糖类等碳水化合物、氨基酸、蛋白质、多肽、油脂化合物等有机物来应答逆境。本研究与胡博华[42]等人的研究结果有相似之处。胡博华[42]等人对芹菜的研究发现,低程度的Cd2+ 胁迫对其生理过程基本无影响,胁迫程度的增加对芹菜体内有机物的合成、分泌和运输具有抑制作用。乔琳[43]等对玉米叶片谱图研究发现,玉米叶片各组分在Pb2+ 胁迫前后吸收峰的位置和强度发生变化,表明Pb2+ 胁迫下这些基团与Pb2+ 发生了离子交换、络合等对玉米抵抗Pb2+ 胁迫的毒害具有重要作用。但本研究中,低磷胁迫并没有改变杉木幼苗根系和叶片谱图的吸收峰峰形,只改变其特征峰强度,与乔琳[43]等人的研究结果一致。杉木根系糖类等碳水化合物随着磷胁迫的增加而减少可能是由于杉木缺磷时,其根系中的糖类物质参与了与缺磷信号有关的一系列反应,使得植物中响应缺磷信号的基因表达发生变化[44]。而赵建琦[45]等研究发现水稻在缺磷条件下外加蔗糖能够促进水稻对磷素的吸收,并增加水稻的生物量,他们进一步分析发现,是由于蔗糖激发了磷转运蛋白OsPT2的表达,从而促进缺磷水稻对磷素的吸收与转运。此外,研究发现随着磷胁迫程度的增加,植物会通过抑制RNA的合成而抑制蛋白质的合成[46]。因此,本研究中杉木氨基酸、蛋白质、多肽等化合物含量降低的原因可能是由于磷胁迫使得杉木RNA的合成受抑制所导致。
-
(1) 杉木幼苗的根系和叶片通过改变保护酶(SOD、CAT和POD)活性来抑制MDA形成,降低由于低磷胁迫引发的膜脂过氧化对细胞膜系统的破坏。
(2) 低磷胁迫会影响杉木幼苗对养分的吸收利用和运输,扰乱其新陈代谢,同时杉木可以通过增加对其他养分元素的吸收,来规避低磷胁迫产生的伤害。
(3) 在低磷环境中,杉木幼苗植株会通过改变不同部位糖类、氨基酸和蛋白质等物质含量来适应低磷环境。随着磷胁迫的增加,杉木幼苗植株有机物的合成、分泌和运输受到抑制。
杉木对低磷胁迫的响应和生理适应机制
Response and Physiological Mechanism of Chinese Fir to Low Phosphorus Stress
-
摘要:
目的 研究低磷胁迫对杉木幼苗各种抗氧化酶等生理指标的变化影响,探讨抗氧化酶活性与杉木耐低磷能力的关系,揭示低磷胁迫下杉木养分吸收的适应机制,阐明杉木体内生物大分子对低磷胁迫的响应。 方法 通过设置不同磷浓度(0、0.25、0.50、1.00 mmol·L-1)Hoagland营养液,模拟低磷胁迫试验,测定低磷胁迫对杉木幼苗的生理指标的影响,研究低磷胁迫对杉木幼苗养分吸收的影响机制以及测定杉木幼苗不同部位的光谱特性。 结果 随着缺磷程度的增加,杉木幼苗中SOD活性、CAT活性以及叶绿素a、叶绿素b和叶绿素总量均先升后降,根系中POD活性呈现出升高的趋势、MDA含量先降再升后降,叶片中POD活性和MDA含量先降后升。低磷胁迫对杉木幼苗根系和叶片吸收利用营养元素有显著影响。杉木苗根系所含的Mn随着缺磷程度的增加呈上升趋势,而Al和Cu先降后升,Fe和K则有所下降,Ca先升后降。此外,杉木叶片中Fe和Mn的积累量呈降低的趋势,Cu和K先升后降。低磷胁迫对杉木幼苗根系和叶片组织在3 367、2 924、1 736、1 630、1 380、1 150~1 000 cm-1处特征峰吸光值影响不同。 结论 低磷胁迫下,杉木幼苗的根系和叶片会通过改变保护酶(SOD、CAT和POD)活性抑制MDA形成,降低膜脂过氧化对细胞膜系统的破坏,通过增加对其他养分元素的吸收来规避损伤以及通过改变不同部位糖类、氨基酸和蛋白质等物质含量来适应低磷环境。 Abstract:Objective To investigate the response mechanism of low-P stress on the antioxidant enzyme activities, nutrient uptake and bio-macromolecules of Chinese fir. Method The effects of low phosphorus stress on the physiological indexes of Chinese fir (Cunninghamia lanceolata) seedlings, the mechanism of low phosphorus stress on the nutrient uptake of Chinese fir seedlings and the spectral characteristics of different parts of Chinese fir seedlings were studied by setting different phosphorus concentration in Hoagland nutrient solution. Result With the decrease of phosphorus level, the SOD activity, CAT activity, chlorophyll a, chlorophyll b and total chlorophyll content of Chinese fir seedlings rose at initial and then decreased. Low phosphorus stress made POD activity increase, and the MDA content decreased at first and then increased in the roots of Chinese fir. In the leaves, the POD activity and MDA content decreased at first and then increased. Low phosphorus stress had a significant effect on the absorption and utilization of nutrient elements in roots and leaves of Chinese fir seedlings. The content of Mn in Chinese fir roots showed an upward trend with the increasing level of P deficiency. The content of Al and Cu decreased at first and then increased, while the content of Fe and K decreased, and the content of Ca increased at first and then decreased. In addition, the accumulation of Fe and Mn in the leaves of Chinese fir showed a decreasing trend, and the accumulation of Cu and K increased and then decreased. On 3 367, 2 924, 1 736, 1 630, 1 380, 1 150~1 000 cm-1 wavelength, low phosphorus stress had an effect on the root and leaf tissue where the light absorption value of characteristic peak were different. Conclusion Under low phosphorus stress, the root and leaf of Chinese fir inhibit the formation of MDA by changing the activity of protective enzymes (SOD, CAT and POD), and decrease the damage of membrane lipid peroxidation to the cell membrane system. They also avoid the damage of low phosphorus stress by increasing the absorption of other nutrient elements, and adapt to the low phosphorus environment by changing the contents of sugars, amino acids and proteins in different parts of Chinese fir. -
表 1 低磷胁迫对杉木苗根保护酶活性及MDA含量的影响
Table 1. Effect of low P stress on protective enzyme activity and MDA content in roots of Chinese fir seedlings
生化测定
Biochemical measurements磷浓度Phosphorus concentrations/(mmol·L-1) 0 0.25 0.50 1.00 SOD活性SOD activity/(U·g -1) 48.3±17.42a 103.9±2.30b 127.0±7.21b 117.6±10.09b CAT活性CAT activity/(U·g -1·min-1) 18.4±2.93a 32.2±0.80b 32.1±2.99b 30.9±0.97b POD活性POD activity/(U·g -1·min-1) 604.3±28.41b 484.0±61.59ab 460.5±15.99ab 358.7±24.38a MDA含量MDA content/(mmol·g-1) 1.5±0.12ab 1.6±0.08ab 1.3±0.04a 1.8±0.01b 注:不同小写字母间表示差异显著(P < 0.05); Note: Different lowercase letters indicate significant differences at P < 0.05 level 表 2 低磷胁迫对杉木苗叶片保护酶活性及MDA含量的影响
Table 2. Effect of low P stress on protective enzyme activities and MDA content in leaves of Chinese fir seedlings
生化测定
Biochemical measurements磷浓度Phosphorus concentrations/(mmol·L-1) 0 0.25 0.50 1.00 SOD活性SOD activity/(U·g -1) 63.2±5.20a 67.1±6.58a 99.0±2.16b 66.5±4.90a CAT活性CAT activity/(U·g -1·min-1) 8.8±1.48a 9.1±0.53a 17.1±0.87b 5.7±1.52a POD活性POD activity/(U·g -1·min-1) 254.1±19.07b 131.5±14.80a 194.0±23.25ab 213.3±11.85ab MDA含量MDA content/(mmol·g-1) 4.3±0.17ab 3.7±0.15a 4.2±0.21ab 4.8±0.02b 注:不同小写字母间表示差异显著(P < 0.05); Note: Different lowercase letters indicate significant differences at P < 0.05 level. 表 3 磷浓度与杉木幼苗根系Al和各养分含量之间的相关系数及显著性检验
Table 3. Correlation coefficient between phosphorus concentration and Chinese fir seedling root Al and nutrient contents and significance test
项目Items 磷浓度Phosphorus concentration Al Ca Cu Fe K Mg Mn Na 磷浓度Phosphorus concentration 1 Al -0.527 1 Ca 0.193 -0.931 1 Cu -0.398 0.695 -0.71 1 Fe 0.998** -0.558 0.224 -0.378 1 K 0.932 -0.381 0.09 -0.541 0.905 1 Mg 0.547 0.411 -0.679 0.139 0.506 0.669 1 Mn -0.975* 0.685 -0.375 0.436 -0.986* -0.85 -0.353 1 Na -0.935 0.444 -0.088 0.088 -0.950* -0.759 -0.504 0.933 1 **. 在0.01水平(双侧)上显著相关。*. 在0.05水平(双侧)上显著相关。
**. Indicates significant differences at P < 0.01 level. *. significant differences at P < 0.05 level.表 4 磷浓度与杉木幼苗叶片Al和各养分含量之间的相关系数及显著性检验
Table 4. Correlation coefficient between phosphorus concentration and Chinese fir seedling leaf Al and nutrient contents and significance test
项目Items 磷浓度Phosphorus concentration Al Ca Cu Fe K Mg Mn Na 磷浓度Phosphorus concentration 1 Al 0.969* 1 Ca 0.105 0.082 1 Cu -0.174 -0.408 -0.142 1 Fe 0.920 0.957* -0.211 -0.356 1 K 0.415 0.179 0.004 0.820 0.177 1 Mg 0.015 -0.061 -0.918 0.484 0.209 0.388 1 Mn 0.950 0.981* 0.273 -0.440 0.882 0.152 -0.246 1 Na -0.132 -0.233 -0.868 0.614 0.025 0.430 0.980* -0.403 1 *. 在0.05水平(双侧)上显著相关。
*. Indicates significant differences at P < 0.05 level. -
[1] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource[J]. New Phytol, 2003, 157(3): 423-447. doi: 10.1046/j.1469-8137.2003.00695.x [2] Qiu H, Liu C, Yu T, et al. Identification of QTL for acid phosphatase activity in root and rhizosphere soil of maize under low phosphorus stress[J]. Euphytica, 2014, 197(1): 133-143. doi: 10.1007/s10681-013-1058-0 [3] Zhang D, Song H, Cheng H, et al. The Acid Phosphatase-Encoding Gene GmACP1 Contributes to Soybean Tolerance to Low-Phosphorus Stress[J]. Plos Genet, 2014, 10(e10040611). [4] 孔超, 刘军, 姜景民, 等. 毛红椿不同家系磷素利用特性的研究[J]. 林业科学研究, 2012, 25(5): 590-596. doi: 10.3969/j.issn.1001-1498.2012.05.008 [5] 吴蔚东, 张桃林, 高超, 等. 红壤地区杉木人工林土壤肥力质量性状的演变[J]. 土壤学报, 2001, 38(3): 285-294. doi: 10.3321/j.issn:0564-3929.2001.03.007 [6] 陈绍栓. 杉木细柄阿丁枫混交林涵养水源功能和土壤肥力的研究[J]. 生态学报, 2002, 22(6): 957-961. doi: 10.3321/j.issn:1000-0933.2002.06.024 [7] 俞元春, 余健, 房莉, 等. 缺磷胁迫下马尾松和杉木苗根系有机酸的分泌[J]. 南京林业大学学报: 自然科学版, 2007, 31(2): 9-12. doi: 10.3969/j.issn.1000-2006.2007.02.003 [8] 张玉霞, 李志刚, 张玉玲, 等. 缺磷胁迫对大豆膜脂过氧化及保护酶活性的影响[J]. 中国农学通报, 2004, 20(4): 196-197. doi: 10.3969/j.issn.1000-6850.2004.04.069 [9] 潘晓华, 刘水英, 李锋, 等. 低磷胁迫对不同水稻品种叶片膜脂过氧化及保护酶活性的影响[J]. 中国水稻科学, 2003, 17(1): 58-61. [10] Zhang G P, Fukami M, Sekimoto H. Influence of cadmium on mineral concentrations and yield components in wheat genotypes differing in Cd tolerance at seedling stage[J]. Field Crop Res, 2002, 77(PⅡ S0378-4290(02)00061-82-3): 93-98. [11] Baltacioglu H, Bayindirli A, Severcan F. Secondary structure and conformational change of mushroom polyphenol oxidase during thermosonication treatment by using FTIR spectroscopy[J]. Food Chem, 2017, 214: 507-514. doi: 10.1016/j.foodchem.2016.07.021 [12] Sigee D C, Bahram F, Estrada B, et al. The influence of phosphorus availability on carbon allocation and P quota in Scenedesmus subspicatus: A synchrotron-based FTIR analysis[J]. Phycologia, 2007, 46(5): 583-592. doi: 10.2216/07-14.1 [13] Heraud P, Stojkovic S, Beardall J, et al. Intercolonial variability in macromolecular composition inp-starved and p-replete scenedesmus populations revealed by infrared microspectroscopy[J]. J Phycol, 2008, 44(5): 1335-1339. doi: 10.1111/j.1529-8817.2008.00564.x [14] Dean A P, Nicholson J M, Sigee D C. Impact of phosphorus quota and growth phase on carbon allocation in Chlamydomonas reinhardtii: an FTIR microspectroscopy study[J]. Eur J Phycol, 2008, 43(PⅡ 9060603694): 345-354. [15] 高丽丽, 王盛锋, 韩亚, 等. 缺钙胁迫下花生植株的傅里叶红外光谱研究[J]. 光谱学与光谱分析, 2014, 34(11): 2923-2928. doi: 10.3964/j.issn.1000-0593(2014)11-2923-06 [16] 陈智裕, 吴鹏飞, 邹显花, 等. 低磷胁迫下杉木幼苗生长特性与内源激素的关系[J]. 林业科学, 2016, 52(2): 57-66. [17] 吴鹏飞, 马祥庆, 侯晓龙, 等. 缺磷条件不同钙浓度水培杉木营养液酸度的比较[J]. 中国农学通报, 2011, 27(16): 17-21. [18] 孙红英. 低磷和铝毒对杉木幼苗若干生理过程的影响[D]. 福州: 福建农林大学, 2010. [19] 杨梅. 邻羟基苯甲酸胁迫对不同杉木无性系化感效应及差异蛋白质组分析[D]. 福州: 福建农林大学, 2007. [20] 张宪政. 植物叶绿素含量测定——丙酮乙醇混合液法[J]. 辽宁农业科学, 1986(3): 26-28. [21] 蒋天成, 刘守廷, 莫达松, 等. CID-ICP-AES法测定植物中磷含量[C]. 2008年中国机械工程学会年会暨甘肃省学术年会. 中国甘肃兰州, 2008. 3. [22] 万美亮, 邝炎华, 陈建勋. 缺磷胁迫对甘蔗膜脂过氧化及保护酶系统活性的影响[J]. 华南农业大学学报, 1999, 20(2): 1-6. doi: 10.3969/j.issn.1001-411X.1999.02.001 [23] 王晓蓉. 污染物微观致毒机制和环境生态风险早期诊断[M]. 北京: 科学出版社, 2013. [24] 李俊, 张春雷, 秦岭, 等. 不同磷效率基因型油菜对低磷胁迫的生理响应[J]. 中国油料作物学报, 2010, 32(2): 222-228. [25] An J, Zhou Q, Sun Y, et al. Ecotoxicological effects of typical personal care products on seed germination and seedling development of wheat (Triticum aestivum L. )[J]. Chemosphere, 2009, 76(10): 1428-1434. doi: 10.1016/j.chemosphere.2009.06.004 [26] 林静雯, 李莹, 罗洁文, 等. 草甘膦对杉木种子萌发及幼苗生长的毒性效应[J]. 江西农业大学学报, 2015, 37(5): 843-848. [27] Li X, Zhang L, Li Y, et al. Changes in photosynthesis, antioxidant enzymes and lipid peroxidation in soybean seedlings exposed to UV-B radiation and/or Cd[J]. Plant Soil, 2012, 352(1): 377-387. [28] 陈隆升, 陈永忠, 彭邵锋, 等. 油茶对低磷胁迫的生理生化效应研究[J]. 林业科学研究, 2010, 23(5): 782-786. [29] 陈隆升, 陈永忠, 王瑞, 等. 低磷胁迫对不同油茶优良无性系酶活性的影响[J]. 东北林业大学学报, 2013, 41(9): 23-25. doi: 10.3969/j.issn.1000-5382.2013.09.006 [30] 黄勇. 不同桉树品种适应磷胁迫的生理学机制研究[D]. 福州: 福建农林大学, 2007. 57. [31] 陈秀铃. 邓恩桉低磷胁迫下生理生态响应机理研究[D]. 福州: 福建农林大学, 2009. 56. [32] Cakmak I, Yazici A, Tutus Y, et al. Glyphosate reduced seed and leaf concentrations of calcium, manganese, magnesium, and iron in non-glyphosate resistant soybean[J]. Eur J Agron, 2009, 31(3): 114-119. doi: 10.1016/j.eja.2009.07.001 [33] 王娟, 张乐乐, 康宜宁, 等. Pb在水花生愈伤组织中的超微定位及对矿质元素的影响[J]. 水生生物学报, 2012, 36(2): 307-315. [34] 潘瑞炽. 植物生理学[M]. 北京: 高等教育出版社, 2004: 30-32. [35] 肖细元, 廖晓勇, 陈同斌, 等. 砷超富集植物蜈蚣草中磷和钙的亚细胞分布及其与耐砷毒的关系[J]. 环境科学学报, 2006, 26(6): 954-961. doi: 10.3321/j.issn:0253-2468.2006.06.014 [36] Zobiole L H S, Kremer R J, Jr. Oliveira R S, et al. Glyphosate affects chlorophyll, nodulation and nutrient accumulation of "second generation" glyphosate-resistant soybean (Glycine max L. )[J]. Pestic Biochem Phys, 2011, 99(1): 53-60. doi: 10.1016/j.pestbp.2010.10.005 [37] 陈隆升, 陈永忠, 杨小胡, 等. 低磷胁迫对不同油茶无性系幼苗生长及养分利用效率的影响[J]. 南京林业大学学报: 自然科学版, 2014, 38(3): 45-49. [38] 李锋, 潘晓华. 植物适应缺磷胁迫的根系形态及生理特征研究进展[J]. 中国农学通报, 2002, 18(5): 65-69. doi: 10.3969/j.issn.1000-6850.2002.05.020 [39] 孟朝妮, 刘成, 贺军民, 等. 增强UV-B辐射、NaCl胁迫及其复合处理对小麦幼苗光合作用及黄酮代谢的影响[J]. 光子学报, 2005, 34(12): 1868-1871. [40] 王瑞云, 任有蛇, 岳文斌, 等. 低温胁迫对苜蓿幼苗存活及生理生化指标的影响[J]. 激光生物学报, 2006, 15(4): 342-348. doi: 10.3969/j.issn.1007-7146.2006.04.003 [41] 饶通德, 陈书鸿, 潘杰, 等. 傅里叶变换红外光谱法分析香附子对铅胁迫生理响应及其铅积累特性[J]. 西南农业学报, 2015, 28(3): 1073-1077. [42] 胡博华, 徐劼, 段德超, 等. 镉胁迫下芹菜生理响应的傅里叶变换红外光谱研究[J]. 北方园艺, 2015(15): 11-16. [43] 乔琳, 陈松岭, 乔传英. FTIR-ATR、EDS结合生理特性研究铅胁迫对玉米幼苗的影响[J]. 光谱实验室, 2011, 28(5): 2183-2187. doi: 10.3969/j.issn.1004-8138.2011.05.007 [44] Hammond J P, White P J. Sucrose transport in the phloem: integrating root responses to phosphorus starvation[J]. J Exp Bot, 2008, 59(1): 93-109. [45] 赵建琦, 吴学能, 曹越, 等. 缺磷条件下蔗糖对水稻磷素吸收利用起重要作用[J]. 中国水稻科学, 2013, 27(1): 65-70. doi: 10.3969/j.issn.1001-7216.2013.01.009 [46] 庞欣, 李春俭, 张福锁. 缺磷胁迫对黄瓜体内磷运输及再分配的影响[J]. 植物营养与肥料学报, 1999, 5(2): 42-48. -




 下载:
下载: