-
ABC转运蛋白(ATP-binding cassette transporters)组成了已知转运蛋白家族中最大的超家族,它是由含NBD(Nucleotide-binding domain)、TMD(Transmembrane domain)、NTE(N-terminal extension)等结构域的蛋白共同组成的[1-2]。ABC转运蛋白具有跨膜结构域,可作为转运肽、糖、脂、重金属螯合物等有机物的膜整合蛋白来行使其功能[3]。根据ABC转运蛋白所含有结构域的类型和数量等因素,将其分为ABCA-ABCI等九个亚族[4]。不同亚族的功能及所处的亚细胞位置等存在一定的差异。ABC转运蛋白广泛存在于动物、植物、真菌、细菌等生物中,不同生物间ABC转运蛋白数量存在较大的差异[5]。ABC转运蛋白在抗真菌毒素或转运细胞毒素的过程中起着重要作用[6]。目前已知,ABC转运蛋白在保护人类血脑屏障不受外源化学物质或有毒代谢产物影响等作用;在植物中参与病原微生物应答、重金属调节、次生代谢产物运输以及植物生长等过程; 在真菌中具有分泌性信息素、合成铁硫蛋白、保护病原真菌不受细胞抗真菌毒素的影响及核糖体合成等功能[7-9]。病原真菌在侵入植物寄主的过程中,需要这些转运蛋白帮助克服寄主产生的抗真菌化合物或细胞毒素对自身的毒害作用[10]。
桉树焦枯病(Calonectria leaf blight)是热带和亚热带地区桉树种植区危害最为严重的病害之一,严重威胁桉树产业的发展[11]。桉树焦枯病菌是由丽赤壳属(Calonectria)真菌引起的病害,其无性态为帚梗柱孢属(Cylindrocladium)真菌[12]。据统计Calonectria现有集群13个,共71种,其中C. pseudoreteaudii是福建省内发现最早、分布最广、致病力最强的病原菌株[13-15]。桉树富含次生代谢物质,包括类黄酮类和鞣质等酚类化合物以及蒎烯、萜烯醇等挥发性化感物质,这些物质有利于桉树抵御虫害、病害等有害生物的侵袭[16]。课题组前期研究也表明桉树叶片中多酚类物质含量、黄酮类化合物含量、多酚氧化酶活性水平及其同工酶谱带均与桉树对焦枯病抗性成正相关[17]。有鉴于此,本文在课题组前期已对桉树焦枯病菌(Ca. pseudoreteaudii)的全基因组进行测序的基础上,通过生物信息学方法对桉树焦枯病菌ABC转运蛋白进行鉴定及分类,并进一步进行亚细胞定位预测和系统进化分析等,旨在明确ABC转运蛋白在焦枯病菌对桉树侵染过程中所起的作用,为揭示桉树焦枯病菌致病机制提供理论依据。
-
供试菌株为Ca. pseudoreteaudii YA51, 由福建农林大学森林保护研究所于福建永安桉树焦枯病危害区采集分离获得[12]。该菌株全基因组测序和组装委托给北京诺禾致源生物信息科技有限公司(Novogene)完成,GeneBank Assembly accession:MOCD00000000.1。
-
采用HMMER软件(http://hmmer.org/)所提供的hmmsearch功能,将Pfam30.0数据库(http://pfam.xfam.org)中下载蛋白结构域的隐马可夫(HMM, Hidden Markov Model)模型与导入的桉树焦枯病菌蛋白蛋白序列进行比对,E值设定为1e-5,其余参数为默认参数。将筛选出的结果导入Pfam在线数据库进行比对,最终根据HUGO系统分类法进行分类。
-
采用InterPro(http://www.ebi.ac.uk/interpro/)在线分析对桉树焦枯病ABC转运蛋白进行结构域预测,用IBS(Illustrator for Biological Sequences, http://ibs.biocuckoo.org/)绘制其结构域。
-
将桉树焦枯病ABC转运蛋白与TCDB(Transporter Classification Database, http://www.tcdb.org/)数据库进行Blastp比对,E值设定为1e-50。
-
采用ProComp9.0在线工具(http://linux1.softberry.com/berry.phtml)进行亚细胞结构定位预测。
-
通过MEGA7.0软件对ABC转运蛋白氨基酸序列进行MUSCLE比对,进一步通过临近法(Neighbor-joining method)构建系统发育树,Bootstrap值设置为1000次,并采用Poisson模型。
-
通过Hmmer与Pfam比对获得具有ABC转运蛋白结构域的原始数据, 总共在桉树焦枯病菌中鉴定出70个ABC转运蛋白,约占总编码蛋白数量的0.49%(表 1)。这些基因广泛分散于不同的桉树焦枯病菌基因组支架(Scaffod)上。稻瘟病菌(Magnaporthe oryzae)含有50个ABC转运蛋白,约占总编码蛋白数量的0.32%;酿酒酵母(Saccharomyces cerevisiae)含有29个ABC转运蛋白,约占总编码蛋白数量的0.46%;禾谷镰刀菌(Fusarium graminearum)中含有58个ABC转运蛋白,约占总编码蛋白数量的44%,其总量均低于桉树焦枯病菌(表 1)[9, 18]。根据HUGO(Human Genome Organization)系统分类法,将其划分为ABCA(1,1.4%)、ABCB(20,29%)、ABCC(15,21%)、ABCD(2,2.8%)、ABCE(1, 1.4%)ABCF(3,4.3%)、ABCG(24,34%)、ABC1(4,5.7%)8个亚族(表 2),并进行系统命名。其中,ABCG亚族为桉树焦枯病菌最大的ABC转运蛋白亚族,其数量远高于酿酒酵母与稻瘟病菌,说明该亚族存在明显的扩张。桉树焦枯病菌ABC转运蛋白的分类与稻瘟病菌的大致相同,都具有ABC1亚族,酿酒酵母和禾谷镰刀菌中并没有ABC1亚族。
表 1 桉树焦枯病菌、稻瘟病菌、酿酒酵母和禾谷镰刀菌ABC转运蛋白的比较分析
Table 1. Comparatively analysis of ABC transporter in C. pseudoreteaudii、M. grisea、S. Cerevisiae and F. graminearum
菌种
Fungal speciesABCA ABCB ABCC ABCD ABCE ABCF ABCG ABC1 ABC转运蛋白占比
Percent of ABC transporterABC总数
Total ABCs基因总数
Total genes占比
Percent/%桉树焦枯病菌C. pseudoreteaudii 1 20 15 2 1 3 24 4 70 14 355 0.49 稻瘟病菌M. grisea 2 19 10 2 1 5 8 1 50 15 488 0.32 酿酒酵母S. Cerevisiae 0 4 6 3 1 5 10 1 29 6 275 0.46 禾谷镰刀菌F. graminearum 1 14 16 2 1 5 19 0 58 13 313 0.44 表 2 桉树焦枯病菌ABC转运蛋白分类及亚细胞定位分析
Table 2. Classification and subcellular localization of ABC transporter in C. pseudoreteaudii
亚家族
Subfamily基因号
Gene ID命名
Name长度
Length/aa亚细胞定位*
Subcellular
localization亚家族
Subfamily基因号
Gene ID命名
Name长度
Length/aa亚细胞定位*
Subcellular
localizationABCA Cp_Cap08593 CpABCA1 1 621 PM ABCC Cp_Cap14344 CpABCC15 1 429 PM ABCB Cp_Cap00365 CpABCB1 798 EM ABCD Cp_Cap06579 CpABCD1 722 P ABCB Cp_Cap01810 CpABCB2 1 390 PM ABCD Cp_Cap04965 CpABCD2 656 P ABCB Cp_Cap02628 CpABCB3 1 277 PM ABCE Cp_Cap11665 CpABCE1 609 PM ABCB Cp_Cap02815 CpABCB4 1 211 PM ABCF Cp_Cap01280 CpABCF1 743 N ABCB Cp_Cap03102 CpABCB5 1 127 PM ABCF Cp_Cap11255 CpABCF2 752 CY ABCB Cp_Cap07322 CpABCB6 1 190 PM ABCF Cp_Cap12880 CpABCF3 621 CY ABCB Cp_Cap07912 CpABCB7 1 207 PM ABCG Cp_Cap00536 CpABCG1 1 457 PM ABCB Cp_Cap08600 CpABCB8 1 285 PM ABCG Cp_Cap00571 CpABCG2 635 PM ABCB Cp_Cap11484 CpABCB9 1 327 PM ABCG Cp_Cap01821 CpABCG3 1 439 PM ABCB Cp_Cap12067 CpABCB10 1 152 PM ABCG Cp_Cap01775 CpABCG4 701 PM ABCB Cp_Cap12521 CpABCB11 1 304 PM ABCG Cp_Cap02612 CpABCG5 1 468 PM ABCB Cp_Cap12529 CpABCB12 1 254 PM ABCG Cp_Cap02881 CpABCG6 1 433 PM ABCB Cp_Cap13243 CpABCB13 492 M ABCG Cp_Cap03218 CpABCG7 1 491 PM ABCB Cp_Cap00820 CpABCB14 1 048 V ABCG Cp_Cap03468 CpABCG8 1 348 PM ABCB Cp_Cap03996 CpABCB15 714 M ABCG Cp_Cap03823 CpABCG9 1 492 PM ABCB Cp_Cap04716 CpABCB16 838 M ABCG Cp_Cap04531 CpABCG10 755 PM ABCB Cp_Cap07127 CpABCB17 830 PM ABCG Cp_Cap04543 CpABCG11 1 369 PM ABCB Cp_Cap07577 CpABCB18 910 PM ABCG Cp_Cap04568 CpABCG12 611 PM ABCB Cp_Cap12746 CpABCB19 788 M ABCG Cp_Cap04890 CpABCG13 1 080 EM ABCB Cp_Cap12310 CpABCB20 1 427 PM ABCG Cp_Cap05904 CpABCG14 636 PM ABCC Cp_Cap00418 CpABCC1 554 V ABCG Cp_Cap06750 CpABCG15 1 507 PM ABCC Cp_Cap00722 CpABCC2 1 549 V ABCG Cp_Cap07730 CpABCG16 1 476 PM ABCC Cp_Cap01309 CpABCC3 1 382 PM ABCG Cp_Cap08510 CpABCG17 1 544 PM ABCC Cp_Cap01317 CpABCC4 1 556 PM ABCG Cp_Cap08616 CpABCG18 1 504 PM ABCC Cp_Cap02359 CpABCC5 1 340 PM ABCG Cp_Cap08595 CpABCG19 1 221 PM ABCC Cp_Cap02674 CpABCC6 1 709 PM ABCG Cp_Cap08765 CpABCG20 543 PM ABCC Cp_Cap03034 CpABCC7 1 486 V ABCG Cp_Cap08982 CpABCG21 1 399 PM ABCC Cp_Cap04080 CpABCC8 505 PM ABCG Cp_Cap09400 CpABCG22 1 472 PM ABCC Cp_Cap05392 CpABCC9 1 313 PM ABCG Cp_Cap10618 CpABCG23 1 420 PM ABCC Cp_Cap08340 CpABCC10 1 460 PM ABCG Cp_Cap14059 CpABCG24 1 301 PM ABCC Cp_Cap09471 CpABCC11 1 493 PM ABC1 Cp_Cap08118 CpABC1_1 383 M ABCC Cp_Cap11428 CpABCC12 1 550 PM ABC1 Cp_Cap08671 CpABC1_2 694 M ABCC Cp_Cap11474 CpABCC13 1 463 PM ABC1 Cp_Cap09029 CpABC1_3 497 M ABCC Cp_Cap14339 CpABCC14 1 464 EM ABC1 Cp_Cap10407 CpABC1_4 440 M *代表预测的蛋白双定位情况,M代表线粒体膜EM代表内质网,V代表液泡,PM代表细胞膜,P代表过氧化物酶体,S代表分泌蛋白,N代表细胞核,CY代表细胞质。 -
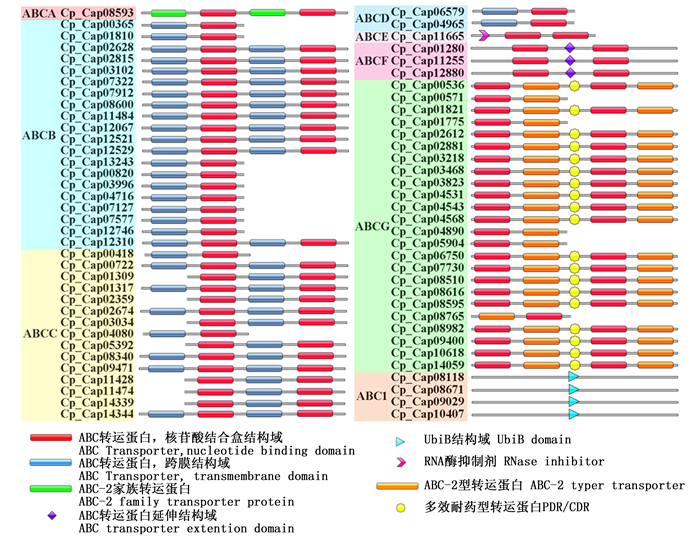
桉树焦枯病菌ABC转运蛋白结构域如图 1所示,其分别由全分子、四分之三分子、半分子及四分之一分子组成。其中,四分之一分子仅存在于ABC1亚族,其结构域为UbiB;ABCA亚族为全分子,其结构域为(TMD-NBD)2,其跨膜结构域与其他亚族不同的是在前两个螺旋之间额外多一个大环;ABCB亚族存在全分子及半分子,其结构域分别为(TMD-NBD)2和TMD-NBD。ABCC亚族通常为全分子,但是在桉树焦枯病菌中预测出较为特殊的半分子及四分之三分子;ABCE及ABCF亚族的结构域均有两个NBD结构域,前者具有RLI结构域,后者在两个NBD中间存在一个延伸结构域(Extension domain);此外,ABCG亚族的结构域为与除ABC1亚族外的其余亚族反向拓扑,其结构域为(NBD-TMD)2,还存在部分半分子。其中,最为特殊的半分子为CpABCG20,其结构域为TMD-NBD,与ABCB等亚族的结构域较为相似,但其却与裂殖酵母(Schizosaccharomyces pombe)的ABCG转运蛋白相似高达73.5%,我们推测其可能为假基因或与测序拼接错误导致编码蛋白序列的预测出错有关。
-
Blastp比对结果如表 3所示,桉树焦枯病菌ABC转运蛋白各亚族功能具有多样性,参与焦枯病菌定殖过程中的各项生理活动。其中,ABCA转运蛋白与稻瘟病菌(M. oryzae)Abc4相似性达到了55%,我们推测其可能参与抗真菌药物及Na+的转运;桉树焦枯病菌共有20个ABCB转运蛋白,分为4类,分别含有13个多药耐药性转运蛋白(MDR,Multidrug Resistance Transporter)、5个重金属转运蛋白(HMT,Heavy Metal Transporter)、1个线粒体肽转运蛋白(MPE,Mitochondrial Peptide Exporter)及1个性信息素转运蛋白(STE,The a-Factor Sex Pheromone Exporter);桉树焦枯病菌ABCC转运蛋白的预测功能主要为药物耦合转运蛋白(DCT,Drug Conjugate Transporter);桉树焦枯病菌ABCD与酿酒酵母ABCD转运蛋白Pxa1p和Pxa2p相似性为30%~40%,其可能作为异源二聚体合成完整的过氧化物酶体,并参与脂肪酸的β氧化。桉树焦枯病菌ABCE转运蛋白与酿酒酵母ABCE(Rli1p)相似性高达73%,其可能主要参与核糖体的合成和翻译的起始;桉树焦枯病菌CpABCF3与酿酒酵母中ABCF(Arb1p)转运蛋白的相似度高达73%,其余两个相似度仅在30%左右。因此,CpABCF3可能与40S和60S核糖体的合成有关;ABCG转运蛋白主要为多效耐药性有关(PDR,Pleiotropic Drug Resistance),除参与药物转运外,还参与多种脂质分子的易位。桉树焦枯病菌ABC转运蛋白除CpABCG8外,与禾谷镰刀菌(Fusarium graminearum)ABCG转运蛋白(FgABC1)的相似度均达到30%,其中,CpABCG9与其相似度达到73%。此外,还含有部分半分子ABCG转运蛋白又被称为WBC(White-brown complex),其在真菌中的功能仍然未知;桉树焦枯病菌ABC1转运蛋白CpABC1_1蛋白与酵母ABC1蛋白(P27697)的相似度为54%,CpABC1_2蛋白没有相似度,其余两个的相似度在30%左右,说明CpABC1_1蛋白可能为辅酶Q的重要辅助因子。
表 3 桉树焦枯病菌ABC转运蛋白各亚族功能预测
Table 3. Predicted of subfamily function of ABC transporter in C. pseudoreteaudii
亚家族Subfamily 功能Function 数量Amounts ABCA 转运植物毒素及药物(Transport phytotoxin and drug) 1 ABCB 多药耐药性转运蛋白(Multidrug Resistance Exporter,MDR) 13 重金属转运蛋白(Heavy Metal Transporter,HMT) 5 线粒体肽转运蛋白(Mitochondrial Peptide Exporter,MPE) 1 性信息素转运蛋白(The a-Factor Sex Pheromone Exporter,STE) 1 ABCC 药物耦合转运蛋白(Drug Conjugate Transporter,DCT) 15 ABCD 过氧化物酶体脂肪酰基辅酶A转运蛋白(Peroxisomal Fatty Acyl CoA transporter,P-FAT) 2 ABCE 核糖体合成及翻译(Sythesis and translation of ribosome) 1 ABCF 40s和60s核糖体合成(Sythesis of 40s and 60s ribosome) 3 ABCG 多效耐药性转运蛋白(Pleiotropic Drug Resistance,PDR) 24 ABC1 辅酶Q辅助因子(Cofactor of CoQ) 4 -
亚细胞结构定位预测如表 2所示,桉树焦枯病菌ABC转运蛋白的亚细胞结构具有多样性,广泛分布于细胞膜、线粒体、内质网、等膜系统上。其中,ABCA亚族位于线粒体膜;ABCB亚族分别位于内质网(1,5%)、线粒体(4,20%)、液泡(1,5%)、细胞膜(14,70%);ABCC亚族分别位于液泡膜(3,20%),细胞膜(11,73%),内质网膜(1,7%);ABCD亚族位于过氧化物酶体上;ABCE亚族位于细胞膜上,ABCF亚族位于核膜及细胞质基质中;ABCG亚族分别位于细胞膜(23,96%),内质网膜(1,4%);ABC1亚族均位于线粒体上。桉树焦枯病菌ABC转运蛋白71%的转运蛋白位于细胞膜、10%位于液泡, 其余部分位于线粒体、过氧化物酶体、内质网等内膜系统上。与已知ABC转运蛋白的亚细胞结构相符,各亚族间的亚细胞结构具有共性,这表明桉树焦枯病菌ABC转运蛋白在功能上具有一定的保守性。
-
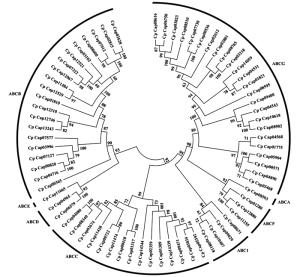
采用MEGA软件构建的neighbor-join系统进化树(图 2)显示,桉树焦枯病菌ABC转运蛋白分为6个亚群。其中,ABCE与ABCD处于同一个亚群,说明其进化关系较为接近。同理,ABCF亚族与ABCA亚族的进化关系较为接近。ABCA亚族、ABCF亚族与ABCG亚族的结构域各不相同,却处在同一分支上,说明这3个亚族的进化关系却较为接近。其余5个亚族的进化关系相当。
-
基于桉树焦枯病菌Ca. pseudoreteaudii的基因组测序数据,本文对桉树焦枯病菌ABC转运蛋白进行全基因组水平鉴定与分类,共获得70个ABC转运蛋白,约占总编码蛋白数量的0.49%。根据ABC转运蛋白的结构域及保守序列的相似性将这些转运蛋白分为8个亚族。此外,稻瘟病菌、禾谷镰刀菌、桉树焦枯病菌ABC转运蛋白的总数均大于酿酒酵母,这可能与这三种病原菌在侵染寄主过程中需要适应更为复杂的环境有关,包括寄主分泌的抗真菌次生代谢产物等。这种扩张现在在焦枯病菌上尤为明显,这与桉树富含次生代谢产物的特性密切相关。
转运蛋白在病原菌侵染过程中起着重要的作用,其通过细胞膜、细胞器膜运输病原菌在侵染过程中所需的营养物质、信号分子和寄主植物分泌的抗真菌毒素等,ABC转运蛋白在其中扮演尤为重要的角色。真菌中,ABCA转运蛋白的数量极少,酿酒酵母中不含有ABCA转运蛋白(表 1),在稻瘟病菌(M.oryzae)及Botryotinia fuckeliana中分别发现两个ABCA转运蛋白[9]。稻瘟病菌的ABCA(Abc4)转运蛋白被验证为与其致病性和附着孢的生成有关[19]。桉树焦枯病菌中含有1个ABCA转运蛋白(表 3),与Abc4相似性达到55%,我们推测其可能与焦枯病菌的致病性存在密切联系;桉树焦枯病菌中共含有13个MDR转运蛋(表 3),其主要与病原菌对药物的抗性机制有关。研究表明,赤霉菌(Gibberella pulicaris)MDR转运蛋白(ABCB亚族)Gpabc1参与转运马铃薯产生的抗真菌毒素,使其能够抵御马铃薯块茎产生的抗真菌毒素日奇素等的毒害作用[20]。除此之外,灰霉菌(Botrytis cinerea)BcatrB转运蛋白、构巢曲霉(Aspergillus nidulans)AtrB转运蛋白均与病原菌的致病性有关[21-22]。桉树焦枯病菌共含有5个HMT转运蛋白(表 3),其主要与重金属物质的转运有关。例如,Botryotinia fuckeliana的HMT蛋白(AbcB蛋白)参与转运铁载体肽分解产物[23]。
桉树焦枯病菌ABCC转运蛋白的预测功能主要为药物耦合转运蛋白(DCT,Drug conjugate transporter),与细胞内毒性化合物的转运有着密切联系,它能将毒性化合物转运至液泡中储存或转运至细胞外[9]。暗示着桉树焦枯病菌ABCC转运蛋白可能参与焦枯病菌到解毒作用的过程中。稻瘟病菌(M. Oryzae)DCT转运蛋白(ABCC亚族)MoABC5参与转运水稻叶片产生的植物毒素,说明其与病原菌对抗真菌毒素的应答存在联系[24]。
桉树焦枯病菌中共含有24个PDR转运蛋白(表 3),PDR转运蛋白除参与药物转运外,还参与多种脂质分子的易位。研究表明,指状青霉菌(Penicillium digitatum)中共有5个ABCG转运蛋白,其在抑霉唑的作用下发生上调表达[25]。禾谷镰刀菌(F. graminearum)的PDR转运蛋白(ABCG亚族)FgABC1与抗真菌化合物苯霜灵的转运密切相关,将其编码基因敲除后,导致病原菌对苯霜灵的敏感性增加[26]。除此之外,酿酒酵母ABCG(Snq2p,Pdr5p,Pdr10p,Pdr11p,Pdr15p)通过输出多种疏水性分子来实现其多效耐药性[27]。酿酒酵母ABCG(Pdr11p,Aus1p)转运蛋白还与固醇类物质的摄入及厌氧生活有关[28]。桉树焦枯病菌ABCG转运蛋白与已知ABCG转运蛋白的功能具有较高的相似度,我们推测其与转运抗真菌化合物、脂类、固醇类等疏水分子存在密切联系。
桉树焦枯病菌中含有大量与抗真菌毒素转运有关的蛋白,包括13个MDR转运蛋白、15个DCT转运蛋白、24个PDR转运蛋白(表 3),约占桉树焦枯病菌ABC转运蛋白的67%,这说明尽管桉树可通过增加多酚类化合物及黄酮类物质等抗真菌毒素提高抗焦枯病的能力,但焦枯病菌则通过ABC转运蛋白和MFS(Major facilitator superfamily)等其他转运蛋白家族的协同作用,将细胞毒素转运到特定的细胞器中储存或分泌到细胞外,减少抗真菌次生代谢产物对病原菌的毒害作用。此外ABCD、ABCE、ABCF、ABC1转运蛋白还参与多项生命活动,包括细胞代谢、翻译、核糖体的合成、mRNA的输出和β氧化等。这些功能在功能在酿酒酵母等真菌中已获得广泛验证[29-32]。
-
ABC转运蛋白在焦枯病菌侵染桉树的过程中可能发挥着多重作用。MDR、PDR、DCT转运蛋白可作为外排泵将焦枯菌中的桉树抗真菌次生代谢物质排到胞外、转运外源化学物质、疏水性化学分子等。还可通过HMT转运蛋白转运重金属化学物质。此外ABCD、ABCE、ABCF、ABC1转运蛋白还参与多项生命活动,包括细胞代谢、翻译、核糖体的合成、mRNA的输出、β氧化和通过为辅酶Q的辅助因子增强呼吸代谢来为焦枯病菌的侵染提供能量等。桉树焦枯病菌ABC转运蛋白的分类、鉴定、功能预测、结构域分析和亚细胞定位预测可为后期ABC转运蛋的功能验证提供参考,为弄清ABC转运蛋白在焦枯病菌致病机制中所起作用奠定基础。
桉树焦枯病菌ABC转运蛋白的鉴定与分析
Identification and Analysis of ABC Transporter in Calonectria pseudoreteaudii
-
摘要:
目的 利用生物信息学方法探讨ABC转运蛋白在焦枯病菌对桉树侵染过程中的解毒作用,为揭示桉树焦枯病致病机制奠定基础。 方法 本文利用BLAST、HMMER、Pfam数据库、TCDB数据库在全基因组内对桉树焦枯病菌的ABC转运蛋白进行鉴定和分类,并通过ProtCamp和IBS分别进行亚细胞定位和结构域图绘制,依据同源性对其功能进行推测分析。 结果 表明:桉树焦枯病菌共有70个ABC转运蛋白,它们分属于8个亚族。71%的转运蛋白位于细胞膜,10%位于液泡,其余部分位于线粒体、过氧化物酶体、内质网等内膜系统上。桉树焦枯病菌ABC转运蛋白包含全分子、四分之三分子、半分子及四分之一分子。根据同源性推测桉树焦枯病菌ABC转运蛋白与MDR、PDR、HMT、MPE、STE、P-FAT等几种转运蛋白具有较高相似性,同时还与核糖体合成、翻译、过氧化物酶体合成的ABC转运蛋白具有较高相似性。 结论 桉树焦枯病菌ABC转运蛋白除作为外排泵转运外源化学物质、疏水性化学分子等物质。还参与细胞代谢、翻译、核糖体的合成、mRNA的输出、β氧化,并通过为辅酶Q的辅助因子增强呼吸代谢等多项生命活动为焦枯病菌的侵染提供能量。 Abstract:Objective Using bioinformatics method to investigate the detoxification of ABC transporters in Calonectria during the process infecting Eucalyptus, and to provide references for revealing the pathogenic mechanism of Calonectria. Method Using BLAST, HMMER, Pfam database, TCDB database to indentify and classify the ABC transporter of Calonectria within the whole genome, and to predict subcellular localization and the domain structure scheme with ProtCamp and IBS, respectively. Result Calonectria has a total of 70 ABC transporters, which belong to 8 subfamilies. 71% of the transporters are located in the cell membrane, 10% in the vacuole, and the rest in the mitochondria, peroxisome, endoplasmic reticulum and other endometrial systems. Calonectria ABC transporter has 4 types of molecules, contains full-size molecules, 3/4 molecules, half molecules and 1/4 molecules. According to the homology it is estimate that Calonectria ABC transporters has high similarity with MDR, PDR, HMT, MPE, STE, P-FAT and other transporters. It also has high similarity with the ABC transporters related to the synthesis of ribosome, translation and synthesis of peroxisome. Conclusion The ABC transporter of Calonectria pseudoreteaudii can transport exogenous chemicals, hydrophobic chemical molecules. It is also involved in cell metabolism, translation, ribosome synthesis, the export of mRNA, beta-oxidation, and provide energy for infecting as a cofactor of coenzyme Q. -
Key words:
- Eucalyptus
- / Calonectria leaf blight
- / ABC transporter
- / domain
- / subcellular localization
-
表 1 桉树焦枯病菌、稻瘟病菌、酿酒酵母和禾谷镰刀菌ABC转运蛋白的比较分析
Table 1. Comparatively analysis of ABC transporter in C. pseudoreteaudii、M. grisea、S. Cerevisiae and F. graminearum
菌种
Fungal speciesABCA ABCB ABCC ABCD ABCE ABCF ABCG ABC1 ABC转运蛋白占比
Percent of ABC transporterABC总数
Total ABCs基因总数
Total genes占比
Percent/%桉树焦枯病菌C. pseudoreteaudii 1 20 15 2 1 3 24 4 70 14 355 0.49 稻瘟病菌M. grisea 2 19 10 2 1 5 8 1 50 15 488 0.32 酿酒酵母S. Cerevisiae 0 4 6 3 1 5 10 1 29 6 275 0.46 禾谷镰刀菌F. graminearum 1 14 16 2 1 5 19 0 58 13 313 0.44 表 2 桉树焦枯病菌ABC转运蛋白分类及亚细胞定位分析
Table 2. Classification and subcellular localization of ABC transporter in C. pseudoreteaudii
亚家族
Subfamily基因号
Gene ID命名
Name长度
Length/aa亚细胞定位*
Subcellular
localization亚家族
Subfamily基因号
Gene ID命名
Name长度
Length/aa亚细胞定位*
Subcellular
localizationABCA Cp_Cap08593 CpABCA1 1 621 PM ABCC Cp_Cap14344 CpABCC15 1 429 PM ABCB Cp_Cap00365 CpABCB1 798 EM ABCD Cp_Cap06579 CpABCD1 722 P ABCB Cp_Cap01810 CpABCB2 1 390 PM ABCD Cp_Cap04965 CpABCD2 656 P ABCB Cp_Cap02628 CpABCB3 1 277 PM ABCE Cp_Cap11665 CpABCE1 609 PM ABCB Cp_Cap02815 CpABCB4 1 211 PM ABCF Cp_Cap01280 CpABCF1 743 N ABCB Cp_Cap03102 CpABCB5 1 127 PM ABCF Cp_Cap11255 CpABCF2 752 CY ABCB Cp_Cap07322 CpABCB6 1 190 PM ABCF Cp_Cap12880 CpABCF3 621 CY ABCB Cp_Cap07912 CpABCB7 1 207 PM ABCG Cp_Cap00536 CpABCG1 1 457 PM ABCB Cp_Cap08600 CpABCB8 1 285 PM ABCG Cp_Cap00571 CpABCG2 635 PM ABCB Cp_Cap11484 CpABCB9 1 327 PM ABCG Cp_Cap01821 CpABCG3 1 439 PM ABCB Cp_Cap12067 CpABCB10 1 152 PM ABCG Cp_Cap01775 CpABCG4 701 PM ABCB Cp_Cap12521 CpABCB11 1 304 PM ABCG Cp_Cap02612 CpABCG5 1 468 PM ABCB Cp_Cap12529 CpABCB12 1 254 PM ABCG Cp_Cap02881 CpABCG6 1 433 PM ABCB Cp_Cap13243 CpABCB13 492 M ABCG Cp_Cap03218 CpABCG7 1 491 PM ABCB Cp_Cap00820 CpABCB14 1 048 V ABCG Cp_Cap03468 CpABCG8 1 348 PM ABCB Cp_Cap03996 CpABCB15 714 M ABCG Cp_Cap03823 CpABCG9 1 492 PM ABCB Cp_Cap04716 CpABCB16 838 M ABCG Cp_Cap04531 CpABCG10 755 PM ABCB Cp_Cap07127 CpABCB17 830 PM ABCG Cp_Cap04543 CpABCG11 1 369 PM ABCB Cp_Cap07577 CpABCB18 910 PM ABCG Cp_Cap04568 CpABCG12 611 PM ABCB Cp_Cap12746 CpABCB19 788 M ABCG Cp_Cap04890 CpABCG13 1 080 EM ABCB Cp_Cap12310 CpABCB20 1 427 PM ABCG Cp_Cap05904 CpABCG14 636 PM ABCC Cp_Cap00418 CpABCC1 554 V ABCG Cp_Cap06750 CpABCG15 1 507 PM ABCC Cp_Cap00722 CpABCC2 1 549 V ABCG Cp_Cap07730 CpABCG16 1 476 PM ABCC Cp_Cap01309 CpABCC3 1 382 PM ABCG Cp_Cap08510 CpABCG17 1 544 PM ABCC Cp_Cap01317 CpABCC4 1 556 PM ABCG Cp_Cap08616 CpABCG18 1 504 PM ABCC Cp_Cap02359 CpABCC5 1 340 PM ABCG Cp_Cap08595 CpABCG19 1 221 PM ABCC Cp_Cap02674 CpABCC6 1 709 PM ABCG Cp_Cap08765 CpABCG20 543 PM ABCC Cp_Cap03034 CpABCC7 1 486 V ABCG Cp_Cap08982 CpABCG21 1 399 PM ABCC Cp_Cap04080 CpABCC8 505 PM ABCG Cp_Cap09400 CpABCG22 1 472 PM ABCC Cp_Cap05392 CpABCC9 1 313 PM ABCG Cp_Cap10618 CpABCG23 1 420 PM ABCC Cp_Cap08340 CpABCC10 1 460 PM ABCG Cp_Cap14059 CpABCG24 1 301 PM ABCC Cp_Cap09471 CpABCC11 1 493 PM ABC1 Cp_Cap08118 CpABC1_1 383 M ABCC Cp_Cap11428 CpABCC12 1 550 PM ABC1 Cp_Cap08671 CpABC1_2 694 M ABCC Cp_Cap11474 CpABCC13 1 463 PM ABC1 Cp_Cap09029 CpABC1_3 497 M ABCC Cp_Cap14339 CpABCC14 1 464 EM ABC1 Cp_Cap10407 CpABC1_4 440 M *代表预测的蛋白双定位情况,M代表线粒体膜EM代表内质网,V代表液泡,PM代表细胞膜,P代表过氧化物酶体,S代表分泌蛋白,N代表细胞核,CY代表细胞质。 表 3 桉树焦枯病菌ABC转运蛋白各亚族功能预测
Table 3. Predicted of subfamily function of ABC transporter in C. pseudoreteaudii
亚家族Subfamily 功能Function 数量Amounts ABCA 转运植物毒素及药物(Transport phytotoxin and drug) 1 ABCB 多药耐药性转运蛋白(Multidrug Resistance Exporter,MDR) 13 重金属转运蛋白(Heavy Metal Transporter,HMT) 5 线粒体肽转运蛋白(Mitochondrial Peptide Exporter,MPE) 1 性信息素转运蛋白(The a-Factor Sex Pheromone Exporter,STE) 1 ABCC 药物耦合转运蛋白(Drug Conjugate Transporter,DCT) 15 ABCD 过氧化物酶体脂肪酰基辅酶A转运蛋白(Peroxisomal Fatty Acyl CoA transporter,P-FAT) 2 ABCE 核糖体合成及翻译(Sythesis and translation of ribosome) 1 ABCF 40s和60s核糖体合成(Sythesis of 40s and 60s ribosome) 3 ABCG 多效耐药性转运蛋白(Pleiotropic Drug Resistance,PDR) 24 ABC1 辅酶Q辅助因子(Cofactor of CoQ) 4 -
[1] Rees D C, Johnson E, Lewinson O. ABC transporters: the power to change. [J]. Nat Rev Mol Cell Biol. 2009, 10(3): 218-227. doi: 10.1038/nrm2646 [2] Hollenstein K, Dawson R J, Locher K P. Structure and mechanism of ABC transporter proteins. [J]. Curr Opin Struct Biol. 2007, 17(4): 412-418. doi: 10.1016/j.sbi.2007.07.003 [3] Theodoulou F L. Plant ABC transporters. [J]. Biochim Biophys Acta. 2000, 1465(1-2): 79-103. doi: 10.1016/S0005-2736(00)00132-2 [4] Vasiliou V, Vasiliou K, Nebert D W. Human ATP-binding cassette (ABC) transporter family. [J]. Hum Genomics. 2009, 3(3): 281-290. [5] Dassa E, Bouige P. The ABC of ABCS: a phylogenetic and functional classification of ABC systems in living organisms. [J]. Res Microbiol. 2001, 152(3-4): 211-229. doi: 10.1016/S0923-2508(01)01194-9 [6] Stefanato F L, Abou-Mansour E, Buchala A, et al. The ABC transporter BcatrB from Botrytis cinerea exports camalexin and is a virulence factor on Arabidopsis thaliana. [J]. Plant J. 2009, 58(3): 499-510. doi: 10.1111/j.1365-313X.2009.03794.x [7] Mahringer A, Fricker G. ABC transporters at the blood-brain barrier. [J]. Expert Opin Drug Metab Toxicol. 2016, 12(5): 499-508. doi: 10.1517/17425255.2016.1168804 [8] Xie X, Wang G, Yang L, et al. Cloning and characterization of a novel Nicotiana tabacum ABC transporter involved in shoot branching. [J]. Physiol Plant. 2015, 153(2): 299-306. doi: 10.1111/ppl.12267 [9] Kovalchuk A, Driessen A J. Phylogenetic analysis of fungal ABC transporters. [J]. BMC Genomics. 2010, 11: 177. doi: 10.1186/1471-2164-11-177 [10] Agrios G N. Plant pathology[M]. 5th ed. Amsterdam: Elsevier Academic Press, 2004: 922. [11] Booth T H, Jovanovic T, Old K M, et al. Climatic mapping to identify high-risk areas for Cylindrocladium quinqueseptatum leaf blight on eucalypts in mainland South East Asia and around the world. [J]. Environ Pollut. 2000, 108(3): 365-372. doi: 10.1016/S0269-7491(99)00215-8 [12] 陈全助, 陈慧洁, 郭文硕, 等. 桉树焦枯病菌(Calonectria pseudoreteaudii)生物学特性测定[J]. 福建林学院学报. 2014, 34(4): 328-332. doi: 10.3969/j.issn.1001-389X.2014.04.007 [13] Chen S F, Lombard L, Roux J, et al. Novel species of Calonectria associated with Eucalyptus leaf blight in Southeast China. [J]. Persoonia. 2011, 26: 1-12. doi: 10.3767/003158511X555236 [14] Chen Q, Guo W, Feng L, et al. Transcriptome and proteome analysis of Eucalyptus infected with Calonectria pseudoreteaudii. [J]. J Proteomics. 2015, 115: 117-131. doi: 10.1016/j.jprot.2014.12.008 [15] Lombard L, Crous P W, Wingfield B D, et al. Phylogeny and systematics of the genus Calonectria. [J]. Stud Mycol. 2010, 66: 31-69. doi: 10.3114/sim.2010.66.03 [16] Tian L W, Xu M, Li Y, et al. Phenolic compounds from the branches of Eucalyptus maideni. [J]. Chem Biodivers. 2012, 9(1): 123-130. doi: 10.1002/cbdv.201100021 [17] 冯丽贞, 陈全助, 郭文硕, 等. 桉树的次生代谢及其对焦枯病抗性的关系[J]. 中国生态农业学报. 2008(02): 426-430. [18] Paumi C M, Chuk M, Snider J, et al. ABC transporters in Saccharomyces cerevisiae and their interactors: new technology advances the biology of the ABCC (MRP) subfamily. [J]. Microbiol Mol Biol Rev. 2009, 73(4): 577-593. doi: 10.1128/MMBR.00020-09 [19] Gupta A, Chattoo B B. Functional analysis of a novel ABC transporter ABC4 from Magnaporthe grisea. [J]. FEMS Microbiol Lett. 2008, 278(1): 22-28. doi: 10.1111/j.1574-6968.2007.00937.x [20] Fleissner A, Sopalla C, Weltring K M. An ATP-binding cassette multidrug-resistance transporter is necessary for tolerance of Gibberella pulicaris to phytoalexins and virulence on potato tubers. [J]. Mol Plant Microbe Interact. 2002, 15(2): 102-108. doi: 10.1094/MPMI.2002.15.2.102 [21] Stefanato F L, Abou-Mansour E, Buchala A, et al. The ABC transporter BcatrB from Botrytis cinerea exports camalexin and is a virulence factor on Arabidopsis thaliana. [J]. Plant J. 2009, 58(3): 499-510. doi: 10.1111/j.1365-313X.2009.03794.x [22] Andrade A C, Del S G, Van Nistelrooy J G, et al. The ABC transporter AtrB from Aspergillus nidulans mediates resistance to all major classes of fungicides and some natural toxic compounds. [J]. Microbiology. 2000, 146 (Pt 8): 1987-1997. [23] Kragl C S M E M. The Aspergillus fumigatus ABC transporter AbcB is involved in excretion of siderophore breakdown product. [Z]. Edinburgh, Scotland, UK: 2008130. [24] Kim Y, Park S Y, Kim D, et al. Genome-scale analysis of ABC transporter genes and characterization of the ABCC type transporter genes in Magnaporthe oryzae. [J]. Genomics. 2013, 101(6): 354-361. doi: 10.1016/j.ygeno.2013.04.003 [25] Sun X, Ruan R, Lin L, et al. Genomewide investigation into DNA elements and ABC transporters involved in imazalil resistance in Penicillium digitatum[J]. Fems Microbiology Letters, 2013, 348(1): 11-8. doi: 10.1111/1574-6968.12235 [26] Gardiner D M, Stephens A E, Munn A L, et al. An ABC pleiotropic drug resistance transporter of Fusarium graminearum with a role in crown and root diseases of wheat. [J]. FEMS Microbiol Lett. 2013, 348(1): 36-45. doi: 10.1111/1574-6968.12240 [27] Balzi E, Goffeau A. Yeast multidrug resistance: the PDR network. [J]. J Bioenerg Biomembr. 1995, 27(1): 71-76. doi: 10.1007/BF02110333 [28] Wilcox L J, Balderes D A, Wharton B, et al. Transcriptional profiling identifies two members of the ATP-binding cassette transporter superfamily required for sterol uptake in yeast. [J]. J Biol Chem. 2002, 277(36): 32466-32472. doi: 10.1074/jbc.M204707200 [29] Hettema E H, Van Roermund C W, Distel B, et al. The ABC transporter proteins Pat1 and Pat2 are required for import of long-chain fatty acids into peroxisomes of Saccharomyces cerevisiae. [J]. EMBO J. 1996, 15(15): 3813-3822. doi: 10.1002/j.1460-2075.1996.tb00755.x [30] Dong J, Lai R, Nielsen K, et al. The essential ATP-binding cassette protein RLI1 functions in translation by promoting preinitiation complex assembly. [J]. J Biol Chem. 2004, 279(40): 42157-42168. doi: 10.1074/jbc.M404502200 [31] Dong J, Lai R, Jennings J L, et al. The novel ATP-binding cassette protein ARB1 is a shuttling factor that stimulates 40S and 60S ribosome biogenesis. [J]. Mol Cell Biol. 2005, 25(22): 9859-9873. doi: 10.1128/MCB.25.22.9859-9873.2005 [32] Do T Q, Hsu A Y, Jonassen T, et al. A defect in coenzyme Q biosynthesis is responsible for the respiratory deficiency in Saccharomyces cerevisiae abc1 mutants. [J]. J Biol Chem. 2001, 276(21): 18161-18168. doi: 10.1074/jbc.M100952200 -




 下载:
下载: