-
近年来,对“激发效应”已有大量研究,激发效应在森林、农田、草地等生态系统中广泛存在[1-3]。激发效应的大小与外源有机物的组成有关[4-6]。田耀武等[7]研究表明,凋落物对三峡库区典型流域退耕地土壤SOC密度影响显著;史学军等[8]发现,含凋落物土壤有机碳矿化包含快速分解和缓慢分解2个过程,快速分解日均分解量大,持续时间短,缓慢分解却与之相反。王晓峰等[9]发现,杉木(Cunninghamia lancceolata (Lamb.) Hooker)人工林深层土壤有机碳分解速率显著低于表层土壤,但其激发效应却显著高于表层土壤,肖欣等[10]关于马尾松(Pinus massoniana Lamb.)人工林的土壤有机碳特征与凋落物质量的研究发现,凋落物未分解层C含量及C/N值越小,分解速率越快时,土壤有机碳密度增加也越快。
以红松(Pinus koraiensis Sieb.et Zucc.)为建群种的红松阔叶混交林主要分布于我国的长白山、完达山和小兴安岭地区,是我国北方林区的主要植被类型。由红松和其他阔叶树种组成的红松阔叶混交林,是小兴安岭南坡森林系统地带性顶极类型,具有维护和调节区域气候环境的生态作用。由于该植被类型处于温度相对偏低的北方温带地区,关于温度的变化,尤其是温度升高是否会使该地区的凋落物对土壤有机碳矿化作用产生明显的影响,是否会通过激发效应改变土壤有机碳分解速率等问题知之较少。因此,本文通过设置温度的变化梯度,进行室内培养试验和矿化指标的测定,分析了添加不同树种枯叶外源有机物与温度耦合作用对土壤有机碳激发效应的影响,旨在为红松阔叶混交林土壤碳周转和碳固定提供基础数据和科学依据。
-
研究地位于黑龙江省伊春市带岭区小兴安岭山脉东南部的凉水国家级自然保护区(47°6′49″~47°16′10″ N,128°47′8″~128°57′19″ E),海拔280~707 m,是典型的低山丘陵地貌。该地处于欧亚大陆东缘,具有明显的温带大陆性季风气候,春季来得迟缓,大风天多,降水较少;夏季短,降水集中,气温较高;秋季降温急剧,多出现早霜;冬季漫长,多风雪,严寒而干燥。年极端最高气温38.7 ℃,年极端最低气温-43.9 ℃,年平均气温-0.3 ℃,≥10 ℃的积温约为l 700 ℃,≥0 ℃的积温为2 200~2 400 ℃。年平均降水量676.0 mm,年平均相对湿度78%,年平均蒸发量805 mm,无霜期100~120 d,积雪期130~150 d,年日照时数1 850 h左右,日照率43.5%。该区地带性植被是以红松为主的针阔混交林,森林覆盖率达98%,是我国目前保存最为典型和完整的原生红松针阔混交林分布区之一。境内地带性土壤以暗棕壤为主,占全区总面积的85%。
-
2011年10月,在凉水国家级自然保护区原始红松阔叶混交林典型地段,选取代表性的试验样地(10 m×10 m)1块。在试验样地内,按照“S”型设置土壤采样点,用内径为10 cm的土钻,采集0~20 cm土样,共计20个。将采集的20个土壤样品充分混合,组成一个土样,拣去石块、植物根系等杂物,过2 mm筛,装入无菌封口袋,然后放入4 ℃恒温箱保存,用于室内培养实验和烘干法测定土壤含水量。
2011年10月,在选取的红松阔叶混交林典型试验样地内,收集当年凋落的新鲜枯叶,在自然条件下风干,去除杂物后,将枯叶分拣为红松枯叶、椴树(Tilia amurensis Rupr.)和枫桦(Betula costata Trautv.)枯叶,将椴树和枫桦枯叶进行等量混合组成阔叶枯叶(以下简称“阔叶枯叶”),分别将其放入60 ℃的烘箱中烘干。研磨,过2 mm筛,将其放入牛皮纸袋保存备用。
-
共设置25、30、35 ℃ 3个温度,每个温度下设置6个处理。第一个处理(T):称取保存于4 ℃恒温箱中相当于50.00 g烘干土的新鲜土样,放入500 mL广口瓶中进行培养;第二个处理(H2T):红松枯叶和烘干土样按质量比为1∶25进行混合培养;第三个处理(H4T):红松枯叶和烘干土样按质量比为1∶12.5进行混合培养;第四个处理(K2T):阔叶枯叶和烘干土样按质量比为1∶25进行混合培养;第五个处理(K4T):阔叶枯叶和烘干土样按质量比为1∶12.5进行混合培养;第六个处理(H2K2T):红松枯叶、阔叶枯叶、烘干土样按质量比为1∶1∶25进行混合培养。每个处理3个重复,共计54个样品。
-
将牛皮纸袋的红松枯叶和阔叶枯叶样品分别置于60 ℃烘箱再次烘干,把烘干后的枯叶样品取出,按照以上试验设计方案分别称取不同质量的枯叶加入到装有烘干土样的带塞广口培养瓶,不同处理配比情况见表 1。将枯叶和烘干土样混合均匀,向铺于培养瓶底部的混合样品均匀加入蒸馏水,使其含水量达到最大持水量的60%,作为好气处理[11],且适时添加蒸馏水,始终使混合样品的含水量保持在最大持水量的60%。
表 1 不同处理烘干土和枯叶配比
Table 1. The ratio of oven-dry soil and dead leaves of different treatments
处理
Treatment烘干土质量
Oven-dry soil mass/g红松枯叶干物质量
The dry matter mass of Korean pine dead leaves/g阔叶枯叶干物质量
The dry matter mass of dead broad leaves/gT 50.00 0.00 0.00 H2T 50.00 2.00 0.00 H4T 50.00 4.00 0.00 K2T 50.00 0.00 2.00 K4T 50.00 0.00 4.00 H2K2T 50.00 2.00 2.00 在500 mL带塞广口培养瓶里放入1个100 mL离心管,加入30 mL 0.15 mol·L-1标定的NaOH溶液,保证在测定周期内能全部吸收所产生的CO2并有剩余,将培养瓶加盖涂抹凡士林密封好,采用恒温箱控制温度,放于25、30、35 ℃的恒温箱中培养(培养期间,定期通气,以保证微生物活动所需氧气),培养一定时间后把离心管里的溶液全部转出并换上新的NaOH溶液继续培养。隔3 d以称质量法补充水分,使土壤湿度始终保持在混合样品最大持水量的60%。针对土壤呼吸中CO2释放速率先快后慢的特点[8],本试验设计的培养时间设定为5、10、20、35、60、90 d。
-
采用烘干法测定土壤含水量,采用BaCl2沉淀-酸碱滴定法[8]测定培养期间培养瓶里土样和枯叶混合样品CO2的释放量。
-
$ \begin{aligned} \text { 土壤有机碳矿化量 }\left(\mathrm{mg} \cdot \mathrm{kg}^{-1}\right)=\left(V_{\mathrm{NaOH}} \times\right. \left.C_{\mathrm{NaOH}(\text { 初始加人) }}-V_{\mathrm{HCl}} \times C_{\mathrm{HCl}} \text { (滴定消㓞) }\right) \times M_{C} / m_{\text {土样 }} \end{aligned} $
式中: VNaOH、VHCl分别代表NaOH、HCl的体积,CNaOH、CHCl分别代表NaOH、HCl的物质的量浓度,MC代表碳的摩尔质量,m土样代表土壤样品质量。
-
$ 土壤有机碳矿化速率 \left( {{\rm{mg}} \cdot {\rm{k}}{{\rm{g}}^{ - 1}} \cdot {{\rm{d}}^{ - 1}}} \right) = 土壤 有机碳矿化量/培养时间 $
-
$ PE = \left( {\left( {{C_1} - {C_2}} \right)/{C_2}} \right) \times 100\% $
式中: PE表示激发效应;C1表示来自加入凋落物后土壤原有有机碳矿化释放的CO2量;C2表示来自未加入凋落物的土壤原有有机碳矿化释放的CO2量[12]。
-
利用Excel 2003软件对实验数据进行基本统计和作图。利用SPSS17.0统计软件对培养时间、温度和不同处理进行多因素方差分析,同时采用非参数检验法对同一温度下相同培养时间不同处理、同一温度下相同处理不同培养时间、同一处理相同培养时间不同温度之间土壤碳矿化速率的差异进行显著性分析。显著性水平设为0.05。
-
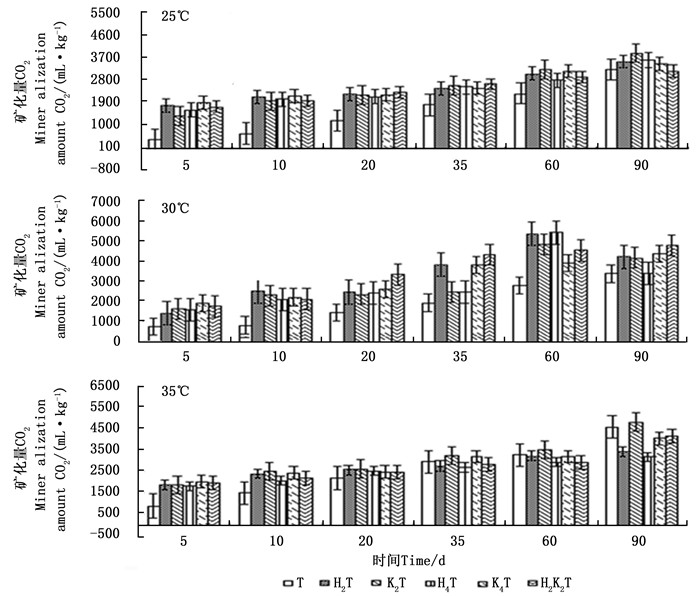
从图 1可以看出:无论在25、30 ℃还是35 ℃培养温度下,随着培养天数的延长,相同温度不同处理土壤有机碳矿化量总体上表现出逐渐增多的趋势。
图 1 不同温度不同处理土壤有机碳矿化量随培养时间的变化(平均值±标准差,n=3)
Figure 1. Variation in mineralization amount of SOC under different temperature and treatments over inoculation days(Mean±SD, n=3)
在培养温度为25 ℃,培养天数为5、10 d时,K4T处理的有机碳矿化量最大,K2T处理最小;20 d和35 d时,H2K2T处理的有机碳矿化量最大,H4T和K4T处理的最小;60、90 d时,K2T处理的有机碳矿化量最大,H4T、H2K2T矿化量最小。说明在25 ℃时,含有阔叶枯叶的处理(K4T、H2K2T、K2T)的有机碳矿化量最大。
在培养温度为30 ℃,培养5 d时,K4T处理有机碳矿化量最大,H2T处理最小;培养天数为10 d时,H2T处理有机碳矿化量最大,H4T处理最小;培养天数为20、35、90 d时,H2K2T处理有机碳矿化量最大,H4T处理最小;培养天数为60 d时,H2T处理有机碳矿化量最大,K4T处理最小。说明在30 ℃时,含有红松枯叶(H4T、H2T、H2K2T)的处理不同时间段有机碳矿化量最大。
在35 ℃,5 d时各添加外源有机物处理K4T的有机碳矿化量最大,H2T处理最小;10、20、35、60、90 d时K2T处理有机碳矿化量最大,10、35、60、90 d时H4T处理最小;20 d时H2K2T处理最小。说明在35 ℃时,含有阔叶枯叶(K4T、K2T)的处理不同时间段有机碳矿化量最大。因此,在25、35 ℃时,添加阔叶枯叶的处理优于红松枯叶的处理。30 ℃时,添加红松枯叶的处理优于阔叶枯叶的处理。
培养天数相同,培养温度为30、35 ℃的T处理有机碳矿化量均高于25 ℃的。培养天数为5、10、20 d时,不同处理下的有机碳矿化量的大小次序为35 ℃>30 ℃>25 ℃。培养天数为35、60、90 d时,不同处理下的有机碳矿化量却为30 ℃>35 ℃>25 ℃。说明培养天数较短时,随温度的升高土壤有机碳矿化呈现上升的趋势,但随着培养天数的延长,培养温度对其影响相对减弱。综上,30、35 ℃的有机碳矿化量均高于25 ℃的有机碳矿化量。
有机碳矿化量数据的三因素方差分析和多重比较分析表明,温度、时间以及处理对有机碳矿化量均有显著影响,且三因素之间的两两交互作用也均显著(P < 0.05)。25 ℃和30、35 ℃呈现显著差异(P < 0.05)。30 ℃和35 ℃的差异不显著(P>0.05)。不同培养天数彼此之间均差异显著(P < 0.05);对照(T处理)与其他处理的差异显著(P < 0.05),H2T、K2T和H4T 3个处理之间无显著差异(P>0.05),H2T、K2T、K4T和H2K2T 4个处理之间无显著差异(P>0.05)。
-
利用测定时间间隔内CO2释放总量除以间隔天数,得到土壤有机碳日均矿化量的变化曲线[8]。由图 2可见:在25、30、35 ℃的不同温度培养下,不同处理混合土样的土壤有机碳矿化速率随着培养天数的变化大体上呈现出逐渐减少的趋势。在土壤有机碳矿化初期(约在培养20 d),其速率相对较大,其间下降明显较快;随时间推移趋于平缓的减小。35 ℃的矿化速率略大于25、30 ℃的。35 d之前T处理的有机碳矿化速率均低于其他处理的,且变化不大。35 d之后T处理的有机碳矿化速率降低较慢或趋于稳定。据此推测,培养时间越长,温度对土壤有机碳矿化的影响在逐渐减弱。
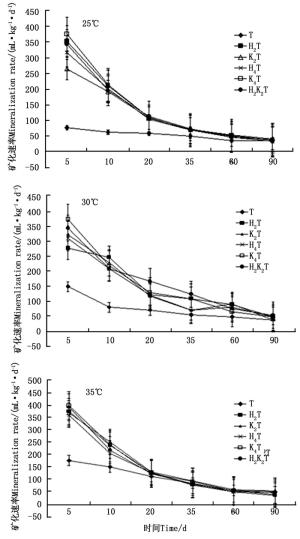
图 2 不同温度不同处理土壤有机碳矿化速率随培养时间的变化(平均值±标准差,n=3)
Figure 2. Variation in SOC mineralization rates of different temperature and treatments over inoculation days(Mean±SD, n=3)
从图 2可以看出:T处理曲线的斜率最小,矿化速率最小。说明外源有机物添加有助于提高土壤有机碳的矿化。K4T与H2K2T处理的碳矿化速率大致相同;K2T处理的有机碳矿化速率比K4T处理的小,H2T处理的有机碳矿化速率比H4T处理的大,说明枯叶种类和数量对土壤有机碳矿化速率的影响并不一致。
对有机碳矿化速率进行三因素方差分析和多重比较分析,结果表明,温度、时间以及处理水平均对有机碳化量均有显著影响,且三因素之间的两两交互作用也均显著(P < 0.05)。25、30、35 ℃彼此间的差异显著(P < 0.05);不同培养天数彼此之间的差异均显著(P < 0.05);不同处理间差异显著(P < 0.05)。
-
加入外源有机物能促进或抑制土壤原有有机物的矿化,引起正的或负的激发效应。由图 3可知:培养期间作为外源有机物的枯叶的添加可以刺激土壤释放更多的CO2,25、30、35 ℃ 3个温度下的各种处理对土壤的矿化作用均在不同程度逐渐减弱,但一直保持促进作用。25 ℃时各处理的激发效应大小依次为:K4T>H2T>K2T>H2K2T=H4T;30 ℃时为:H2K2T>H2T>K4T>K2T>H4T;35 ℃时为:K2T>K4T>H2K2T>H2T>H4T。说明25、35 ℃时,添加阔叶枯叶的处理优于添加红松枯叶。随着培养天数的推移,25 ℃时不同培养天数的激发效应大小依次为:5 d>10 d>20 d>35 d>60 d>90 d;30 ℃时为:10 d>5 d>20 d>60 d>35 d>90 d;35 ℃时为:5 d>10 d>20 d>35 d>60 d>90 d。由此可见,培养天数越短,激发效应越强。

图 3 不同温度不同处理碳激发效应随培养时间的变化(平均值±标准差,n=3)
Figure 3. Variation in priming function of different temperature and treatments over inoculation days(Mean±SD, n=3)
对激发效应进行三因素方差分析和多重比较分析,结果表明,温度、时间以及处理水平均对激发效应均有显著影响(P < 0.05),多重比较结果表明:35 ℃和25 ℃激发效应差异明显(P < 0.05);5 d和35 d、60 d、90 d激发效应差异明显(P < 0.05);不同处理之间激发效应无显著差异(P>0.05)。
-
温度和时间是土壤有机碳矿化的重要影响因素。大量的研究表明,温度升高、时间的推移等影响着土壤微生物的活性、数量和群体组成,从而影响土壤的矿化速率[13-15]。
本研究对红松阔叶混交林土壤进行室内培养试验,结果发现,添加外源有机物,土壤有机碳矿化量随温度的增加而增加。这也与前人的一些研究结果相一致[16-17]。出现这种现象的主要原因可能是,温度通过影响土壤微生物的活性、数量和群落组成来影响土壤碳矿化量。土壤中微生物酶的活性,在一定范围内是随着温度的升高而增强,进而使CO2释放量增加。在实验室内,不同温度下添加细根(草根)对土壤活性有机碳的影响的研究结果显示:随着培养温度升高,各处理释放的生物碳增多,土壤微生物数量增加[18]。另外,在本研究中,添加阔叶凋落物的土壤有机碳矿化速率和累积矿化量均高于添加红松凋落物的土壤,这与王丹等[19]对长白山森林土壤碳矿化及其温度敏感性的影响研究结果一致。凋落物类型对土壤有机碳矿化有显著影响,高菲等[20]认为原因可能与凋落物的数量、组成、微生物的数量和活性、土壤有机碳含量、林内小气候等有关。
不同的凋落物添加对土壤有机碳矿化速率具有不同的影响,其分解包括快速分解和慢速分解2个过程,前者日均分解量大、土壤有机碳矿化速率快,但持续时间较短,缓慢分解过程则分解量较小但持续时间长[8, 21]。对常绿阔叶林和杉木人工林土壤有机碳矿化研究时发现,温度由9 ℃升高到28 ℃,林地土壤有机碳矿化速率则提高了3.1~4.5倍[22]。Leirs等[23]则发现土壤有机碳矿化速率随温度呈指数形式增长。在不同环境因子对樟子松(Pinus sylvestris var. mongholica)人工林土壤有机碳矿化的研究表明,不同土壤水分条件下,樟子松人工林土壤碳矿化速率也随温度升高呈指数增长趋势[24]。本试验3个温度下培养的土壤有机碳矿化速率曲线显示:T处理在35 d前的有机碳矿化速率,均低于其他混合凋落物处理的有机碳矿化速率,且速率变化不大。到培养后期,T处理的可矿化碳量基本都比混合凋落物样品的可矿化碳量多。随着时间的延续,各个温度下的矿化速率的差别不大,可以推测时间越久,温度对土壤有机碳矿化速率的影响在减弱。20 d(P<0.05)具有显著性差异,在35、60、90 d差异不显著(P>0.05)。即0~20 d时,添加外源有机物的土壤有机碳矿化量最快。这与前人的研究结果基本一致[8, 12, 24]。
加入外源有机物能促进或抑制土壤原有有机物的矿化,引起正的或负的激发效应[25-26]。外源有机物的加入,能够促进或者抑制土壤原有有机质的分解,可能是由于土壤中微生物活性、数量和组成的改变而引起的,与外源有机物的生化组成、CPN、施用数量以及土壤性质等有关,但其中的机制还有待进一步研究。前人研究成果也提出一些假设来解释激发效应[27-28]。根据土壤微生物分解不同有机物质的能力,分为受碳源限制的土著性微生物和受氮源限制的发酵性微生物两大类,土著性微生物来源于土壤;发酵性微生物中一部分来源于外源有机物,一部分来源于土壤。激发效应的正负决定于两种微生物竞争能量、营养物质的程度[28]。本研究中在培养初始阶段(0~20 d),添加外源有机物对土壤碳矿化产生了正激发效应。这可能正是由于加入的外源有机物中含有可溶性易分解的组分,这些组分为微生物生长提供了物质和能量,微生物生长较快,从而促进了土壤原有有机碳的矿化,20 d后,随着培养时间的增加,土壤中最易被利用的各种简单组分逐渐减少,发酵性和土著性两种微生物开始竞争土壤中的能量和营养物质,激发效应的速度开始放缓。
-
相同培养温度,不同处理对土壤有机碳矿化量影响不同。在25、35 ℃时,添加阔叶枯叶的处理优于红松枯叶的处理。30 ℃时,添加红松枯叶的处理优于阔叶枯叶的处理。土壤有机碳矿化量随温度的增加而增加。30、35 ℃的有机碳矿化量高于25 ℃的有机碳矿化量。添加不同外源有机物的土壤有机碳矿化速率包括快速分解(0~20 d)和慢速分解(20~90 d)2个过程。0~20 d时,添加外源有机物的土壤有机碳矿化量最快,但持续时间较短。20~90 d时,温度对土壤有机碳矿化的影响在逐渐减弱。添加外源有机物对土壤有机碳矿化产生了正激发效应。随着培养时间的增加,激发效应的速度开始放缓。
综上,室内培养条件下,添加外源有机物后,温度升高能对红松阔叶混交林土壤有机碳矿化作用产生明显的激发效应,而且,激发效应受所添加的外源有机物的种类、数量及所处的温度和时间等因素的影响。野外条件下,影响土壤有机碳矿化的因素十分复杂,具体情况还需要进行更深入的研究。
外源有机物与温度耦合作用对红松阔叶混交林土壤有机碳的激发效应
Priming Effect of Coupling Function of Exogenous Organic Matter and Temperature on Soil Organic Carbon of Pinus koraiensis Broad-leaved Mixed Forest
-
摘要:
目的 探讨添加不同比例外源有机物与温度对森林土壤有机碳矿化的影响,以期进一步认识二者与土壤有机碳的生态联系。 方法 将凉水国家级自然保护区红松阔叶混交林试验样地内收集的红松枯叶、椴树和枫桦枯叶(阔叶枯叶)作为外源有机物,通过实验室培养法,在恒温箱内模拟了红松枯叶和不同添加比例的阔叶枯叶在不同培养温度(25、30、35 ℃)和培养时间(5、10、20、35、60、90 d)的矿化过程,利用碱液吸收法测定了不同处理土壤CO2的释放量,计算了其有机碳矿化速率和累积矿化量,分析了其对土壤有机碳的激发效应。 结果 培养温度为25、35 ℃时,混合添加阔叶枯叶的激发效应优于红松枯叶的激发效应。培养温度为30 ℃时,添加红松枯叶的激发效应优于阔叶枯叶的激发效应。3个培养温度下,添加枯叶对土壤矿化过程具有显著的促进作用(P < 0.05)。培养温度为30 ℃时,添加外源有机物对土壤有机碳的激发效应最优。 结论 红松阔叶混交林土壤有机碳的激发效应受添加外源有机物的种类、培养温度以及培养时间等许多因素的影响。 Abstract:Objective The effect of the addition of different proportion of exogenous organic matter on the forest soil organic carbon mineralization was discussed in this study in order to further understand the ecological relationship between the added exogenous organic matter and soil organic carbon. Method The dead leaves of Korean pine (Pinus koraiensis) and other broad-leaved species (e.g. Linden and maple) were collected in Korean pine broad-leaved mixed forest experimental plots in Liangshui National Nature Reserve and regarded as exogenous organic matter. The mineralization process was imitated in the incubators through laboratory incubation method by adding different proportions of Korean pine dead leaves and broad dead leaves at different incubation temperature (25 ℃, 30 ℃, and 35 ℃) and incubation days (5 d, 10 d, 20 d, 35 d, 60 d, and 90 d). The soil CO2 released under different treatments was measured by alkali absorption method, and the mineralization rate and cumulative mineralization amount of soil organic carbon were calculated. And then the priming effect of exogenous organic matters and temperature on soil organic carbon was analyzed. Result At the incubation temperatures of 25 ℃ and 35 ℃, the priming effect of dead broad leaves was better than that of dead Korean pine leaves; while at 30 ℃, the result was opposite. Under the three levels of incubation temperature, the addition of dead leaves produced a significant promoting effect on soil mineralization processes (P < 0.05). At the temperature of 30 ℃, the addition of the exogenous organic matter resulted in the strongest priming effect on the soil organic carbon. Conclusion The priming effect of soil organic carbon in Korean pine broad-leaved mixed forest was influenced by multi-factors, such as the types of added exogenous organic matter, incubation temperature and days. -
Key words:
- soil organic carbon
- / priming effect
- / dead leave
- / temperature
- / coupling
-
表 1 不同处理烘干土和枯叶配比
Table 1. The ratio of oven-dry soil and dead leaves of different treatments
处理
Treatment烘干土质量
Oven-dry soil mass/g红松枯叶干物质量
The dry matter mass of Korean pine dead leaves/g阔叶枯叶干物质量
The dry matter mass of dead broad leaves/gT 50.00 0.00 0.00 H2T 50.00 2.00 0.00 H4T 50.00 4.00 0.00 K2T 50.00 0.00 2.00 K4T 50.00 0.00 4.00 H2K2T 50.00 2.00 2.00 -
[1] Hamer U, Marschner B. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions[J]. Soil Biology and Biochemistry, 2005, 37(5): 445-454. [2] Broadbent F E, Norman A G. Some factors affecting the availability of the organic nitrogen in soil[J]. Soil Science Society of American Proceedings, 1946, 11: 264-267. [3] Bell J M, Smith J L, Bailey V L, et al. Priming effect and C storage in semi-arid no-till spring crop rotations[J]. Biology and Fertility of Soils, 2003, 37(4): 237-244. doi: 10.1007/s00374-003-0587-4 [4] 王志明, 朱培立, 黄东迈. 14C标记秸秆碳素在淹水土壤中的转化与平衡[J]. 江苏农业学报, 1998, 14(2): 112-117. [5] Fierer N, Schimel J P, Cates R G, et al. Influence of balsam poplar tannin fractions on carbon and nitrogen dynamics in Alaskan taiga floodplain soils[J]. Soil Biology and Biochemistry, 2001, 33(12-13): 1827-1839. doi: 10.1016/S0038-0717(01)00111-0 [6] Waldrop M P, Firestone M K. Microbial community utilization of recalcitrant and simple carbon compounds: impact of oak-woodland plant communities[J]. Oecologia, 2004, 138(2): 275-284. doi: 10.1007/s00442-003-1419-9 [7] 田耀武, 黄志霖, 肖文发. 三峡库区典型流域退耕地植物种类及凋落物对土壤有机碳固定的影响[J]. 生态学杂志, 2012, 31(11): 2742-2847. [8] 史学军, 潘剑君, 陈锦盈, 等. 不同类型凋落物对土壤有机碳矿化的影响[J]. 环境科学, 2009, 30(6): 1832-1837. doi: 10.3321/j.issn:0250-3301.2009.06.046 [9] 王晓峰, 汪思龙, 张伟东, 杉木凋落物对土壤有机碳分解及微生物生物量碳的影响[J]. 应用生态学报, 2013, 24(9): 2383-2398. [10] 肖欣, 王雄涛, 欧阳勋志. 马尾松人工林土壤有机碳特征及其与凋落物质量的关系[J]. 南京林业大学学报: 自然科学版, 2015, 39 (4): 3-8 [11] 李忠佩, 张桃林, 陈碧云. 可溶性有机碳的含量动态及其与土壤有机碳矿化的关系[J]. 土壤学报, 2004, 41(4): 544-552. doi: 10.3321/j.issn:0564-3929.2004.04.008 [12] 孙中林, 吴金水, 葛体达, 等. 土壤质地和水分对水稻土有机碳矿化的影响[J]. 环境科学, 2009, 30(1): 214-220. doi: 10.3321/j.issn:0250-3301.2009.01.036 [13] 胡玉福, 彭佳佳, 蒋双龙, 等. 川中丘陵区不同土地利用方式土壤活性有机碳含量特征研究[J]. 水土保持学报, 2014, 28(22): 221-225. [14] 龚伟, 胡庭兴, 王景燕, 等. 川南天然常绿阔叶林人工更新后枯落物对土壤的影响[J]. 林业科学, 2007, 43(7): 112-119. [15] 薛晶月, 张洪轩, 全权, 等, 土地利用方式对中亚热带红壤碳矿化及其激发效应的影响[J]. 应用与环境生物学报, 2014, 20(3): 516-522. [16] Rey A, Petsikos C, Jarvis P G, et al. Effect of temperature and moisture on rates of carbon mineralization in a Mediterranean oak forest soil under controlled and field conditions[J]. European Journal of Soil Science, 2005.56(5): 589-599. doi: 10.1111/j.1365-2389.2004.00699.x [17] 李玉强, 赵哈林, 赵学勇, 等. 土壤温度和水分对不同类型沙丘土壤呼吸的影响[J]. 干旱区资源与环境, 2006, 20(3): 154-158. doi: 10.3969/j.issn.1003-7578.2006.03.030 [18] 冯发堂, 荣丽, 李贤伟, 等, 实验室不同温度下添加细根(草根)对土壤活性有机碳的影响[J]. 林业科学, 2011, 47(4): 1-6 doi: 10.3969/j.issn.1672-8246.2011.04.001 [19] 王丹, 吕瑜良, 徐丽, 等. 植被类型变化对长白山森林土壤碳矿化及其温度敏感性的影响[J]. 生态学报, 2013, 33(19): 6373-6381. [20] 高菲, 林维, 崔晓阳. 小兴安岭两种森林类型土壤有机碳矿化的季节动态[J]. 应用生态学报, 2016, 27(1): 9-16. [21] 杨继松, 刘景双, 孙丽娜. 温度、水分对湿地土壤有机碳矿化的影响[J]. 生态学杂志, 2008, 27(1): 38-42. [22] 王清奎, 汪思龙, 于小军, 等. 常绿阔叶林与杉木林的土壤碳矿化潜力及其对土壤活性有机碳的影响[J]. 生态学杂志, 2007, 26(12): 1918-1923. [23] Leirs M C, Trasar-Cepeda C, Seoane S, et al. Dependence of mineralization of soil organic matter on temperature and moisture[J]. Soil Biology and Biochemistry, 1999, 31: 327-335. doi: 10.1016/S0038-0717(98)00129-1 [24] 王红, 范志平, 邓东周, 等. 不同环境因子对樟子松人工林土壤有机碳矿化的影响[J]. 生态学杂志, 2008, 27(9): 1469-1475. [25] Kuzyakov Y, Friedel J K, Stahra K. Review of mechanisms and quantification of priming effects[J]. Soil Biology and Biochemistry. 2000, 32(11-12): 1485-1498. doi: 10.1016/S0038-0717(00)00084-5 [26] Cheng W X, Parton W J, Gonzaler-Meler M A, et al. Synthesis and modeling perspectives of rhizosphere priming[J]. New Phytologist. 2014, 201(1): 31-44. doi: 10.1111/nph.12440 [27] Kuzyakov Y. Factors affecting rhizosphere priming effects[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(4): 382-396. doi: 10.1002/1522-2624(200208)165:4<382::AID-JPLN382>3.0.CO;2-# [28] Fontaine S, Mariotti A, Abbadie L. The priming effect of organic matter: A question of microbial competition?[J]. Soil Biology and Biochemistry, 2003, 35(6): 837-843. doi: 10.1016/S0038-0717(03)00123-8 -




 下载:
下载: