-
落叶松体细胞胚再生体系是研究裸子植物早期发育调控和形态发生的理想模式系统[1-2]。落叶松体细胞胚胎发生主要分为四个阶段,分别是胚性愈伤组织的诱导阶段、原胚团继代与增殖阶段、体胚诱导与成熟阶段以及体胚萌发阶段[3-5]。早在1990年,研究人员就利用欧洲落叶松(Larix deciduas Mill.)和日本落叶松(Larix leptolepis S. et Z.) 的未成熟合子胚诱导出了胚性愈伤组织,而且接种时只选择没有附带雌配子体组织的幼胚,这样诱导出胚性愈伤组织的频率是最高的[6]。随后大量研究着眼于体细胞胚成熟产量和质量[7-8]。基于落叶松体胚发生同步化的不断完善,研究人员已经利用该体系进行了大量基因调控方面研究[3, 9-13]。尽管在之前的研究中已经通过落叶松体细胞胚获得了再生植株[6, 14-16],但是对其再生能力尚没有相关的探讨。研究发现,外源施加生长素和赤霉酸可以促进进种子萌发[17-18]。在体细胞胚再生方面,外源施加GA3可加快百慕达草(Bermudagrass)体细胞胚萌发[19]。同时施用IAA与GA3可以提高葡萄体细胞胚萌发率[20]。但是相关研究主要集中在被子植物中,裸子植物落叶松中是否可以通过外源添加激素的方法改善其萌发状况,需要进一步研究。
随着植物组织培养技术不断完善,对裸子植物体胚发生的研究已取得长足的进步。但研究人员研究的重点大多集中在前期体细胞胚诱导与成熟过程,对其后期萌发能力的探索亟待加强。本研究利用落叶松体细胞胚再生体系,观察并分析了不同子叶形态的成熟落叶松体胚显微结构,并对其生根能力进行了探索;利用外源施用激素处理方法研究了影响落叶松体胚再生成苗的重要因子。研究结果将为落叶松在应用方面规模化繁殖提供重要科学依据。
-
本实验采用日本落叶松胚性细胞系S287为实验材料。在增殖培养基上进行原胚团继代与增殖培养,在体细胞胚成熟培养基上进行体胚诱导与成熟[4]。外源施用GA3及IAA均购于Sigma公司。
-
将落叶松原胚团转接到成熟培养基培养45天后,分三批挑取共300个单胚(每批次随机统计100个)进行统计,取平均值。在体式显微镜下进行形态观察与拍照。
-
将四种子叶形态的单胚置入FAA固定液(V(70%乙醇)∶V(甲醛)∶V(乙酸)= 9∶1∶1)中固定保存。对固定材料进行脱水、树脂包埋与常规切片,经甲苯胺蓝(TBO)染色后进行显微观察。
-
选取发育良好的落叶松成熟体细胞胚,接种到分别添加了不同浓度的赤霉素GA3和生长素IAA的无菌萌发培养基上,16 h/8 h光照条件下培养。20 d后统计生根率,60 d后统计存活率。
-
对落叶松300个成熟单胚进行统计。结果发现,落叶松体细胞胚主要存在四种子叶形态。在300个成熟落叶松体细胞胚中,正常胚(子叶数目>4)出现的概率约为77.0%(表 1)。发生异常的体细胞胚有三种形态,分别是有2~3片子叶的裂生子叶胚,子叶融合成一片的杯状胚以及无明显形态的畸形胚,三者出现的概率依次是13.7%,7.0%和2.3%数目明显增多,尤其是子叶融合成杯状结构的单胚(表 1)。
表 1 不同子叶形态落叶松体细胞胚所占比率及萌发率
Table 1. The proportion and germination rate of somatic embryos with different cotyledon numbers
描述
Description形态结构
Morphology子叶数目
Cotyledon number(NC)比率
Frequency/%萌发率
Germinationrate/%正常子叶胚
Normal
NC≥4 77.0 17.2 裂生子叶胚
Poorly
separated
2≤NC≥4 13.7 12.4 杯状胚
Cup-like
NC=1 7.0 5.7 畸形胚
Deformed
NC=0 2.3 0 -
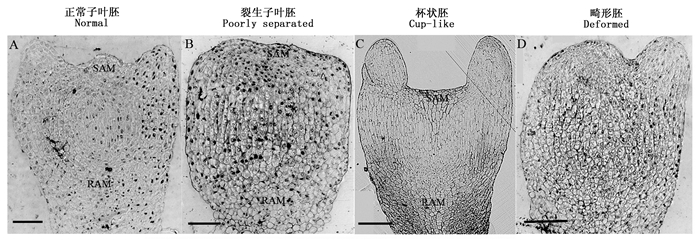
对上述不同子叶形态的落叶松体细胞胚进行树脂切片与显微观察。发现,正常体细胞胚纵切结构细胞走势明显,茎端分生组织(SAM)向上隆起,子叶呈辐射对称(图 1A)。裂生子叶胚的SAM则呈现非常微小的突起,从细胞走向仍可以确认其位置,但子叶不对称且大小不一(图 1B)。与正常子叶胚相比,杯状胚SAM完全呈现扁平状,中间区域也没有隆起,原中柱周围细胞生长不对称(图 1C)。三者的根端分生组织(RAM)没有明显差异。畸形胚则不能发育出完整的SAM和RAM(图 1D)。
-
将成熟体细胞胚接种到萌发培养基上5 d左右体细胞胚颜色变绿,10 d左右子叶伸展,20 d逐渐形成白色短根。分三批次随机选取共300个成熟体胚(每次100个)进行萌发培养,对各形态落叶松体胚的生根率进行统计。结果发现,落叶松正常子叶胚的萌发为17.2%,裂生子叶胚生根率为12.4%,杯状胚生根率约为5.7%,畸形胚在萌发培养基上不能生根,并很快死亡(表 1)。
-
本研究选取的落叶松胚性细胞系不易萌发,为进一步提高其萌发能力,选择外源施用不同浓度的赤霉素GA3和生长素IAA处理发育良好的落叶松成熟体胚(表 2)。培养20 d后对100个样品统计生根率,60 d后统计存活率。结果发现,与未加任何激素处理相比,0.5 mg·L-1 GA3处理的体胚生根能力较其它浓度而言提高了近三倍,但是培养两个月后存活率仅为13%,与对照差异不大。采用不同浓度IAA处理的体胚,以2 mg·L-1 IAA处理结果最佳,其萌发率达到了56%,该浓度下体胚后期存活率仍能保持较高水平。在此基础上,采用GA3和IAA最佳浓度组合处理,发现生根率和存活率并未增加,尤其是60 d后存活的幼苗由最初100个体胚减少到11株(表 2)。
表 2 不同激素处理落叶松体胚萌发率和存活率
Table 2. Embryonic germination and survival rate of different hormone treatments
激素类别
Hormones激素浓度
Hormone concentration/ (mg·L-1)萌发率
Germination rate/%存活率
Survival rate/%- - 11 7 GA3 0.2 19 11 0.5 32 13 1 24 13 2 13 5 5 15 7 IAA 0.2 26 22 0.5 23 18 1 45 38 2 56 47 3 41 29 4 28 12 5 20 14 10 22 14 GA3+ IAA 0.5+2 27 11 -
落叶松极难生根的特性限制了普通组织培养和扦插在落叶松快速扩繁中的应用。因此,体细胞胚胎发生成为优良落叶松株系快速扩繁、人工种子研究及应用的主要途径。本研究选择的S287细胞系为不易萌发细胞系。其诱导的成熟体胚以四种子叶形态存在,其中正常体胚、裂生子叶胚和杯状胚都具有萌发能力,但正常体胚显然比后两者生根能力略强这与之前的研究相一致[20]。显微结构观察结果显示这种结构都发育出了较为完整的SAM,然而,裂生子叶胚和杯状胚的SAM只有轻微隆起或完全呈现扁平状,这可能是后期再生过程中影响体胚萌发的重要因素。在SAM中心区域,干细胞分裂产生两部分细胞,一部分会始终保持在原来的位置,被称为干细胞后羿(Progeny of stem cells),另一部分则脱离中心区域到周围分生组织区域,被称为子细胞(daughter cells)[21]。与正常胚相比较,后两者的SAM中心区域细胞走向和结构的改变(图 1),进一步说明干细胞群的维持与周围组织细胞提供的各类外源或内源性信号分子密不可分。
三者的RAM未见明显差异,萌发能力上虽有较小波动,但是整体生根能力较弱。利用外源施用激素的方法处理体胚,发现2 mg·L-1 IAA处理后体胚生根能力由11%增加到了56%(表 2)。生长素对根部的形成具有重要促进作用。研究显示,生长素向顶端分生组织运输,在高生长素浓度区域形成器官原基[22],KNOX基因的表达调节生长素极性运输,因此,二者在根端干细胞的维持中存在一定的互作关系。生长素是维持根部分生组织的重要信号分子[23-25]。拟南芥中,生长素正向调控PLETHORA(PLT)基因,后者对根端静止中心(QC)和干细胞活性的维持具有重要作用[26]。SHORT-ROOT (SHR)和SCARECROW(SCR)基因对干细胞分化具有重要调控作用。Homeobox (HB)家族的WUSCHEL (WUS)与CLAVATA (CLV)基因形成反馈调节环保持干细胞数量的恒定[22, 25]。因此,有必要利用分子生物学手段对影响四种形态胚生根能力的因子做进一步剖析。
事实上,影响体细胞胚萌发的因素很多,包括一系列内源和外源因素。需要研究人员进一步挖掘。本研究对不同子叶形态的落叶松体细胞胚的萌发能力进行了统计,并利用外源施用激素的方法发现生长素IAA是落叶松体胚再生成苗且能保持存活的重要影响因子。在理论上,为研究裸子植物体细胞胚再生与基因功能研究奠定了良好的基础,同时在实践中,为落叶松在应用方面规模化繁殖提供重要科学依据。
-
本研究发现,落叶松子叶数目不同的成熟体细胞胚其萌发能力各不相同,这可能是由于分生组织发育的差异造成的。通过不同浓度激素处理发育良好的落叶松子叶胚,发现2 mg·L-1 IAA对落叶松体胚生根具有明显的促进作用,说明IAA在落叶松体细胞胚萌发中发挥重要的调控作用。
落叶松体细胞胚萌发能力研究
Germination Ability of Somatic Embryos in Larix leptolepis
-
摘要:
目的 研究落叶松体细胞胚萌发能力,为落叶松在应用方面规模化繁殖提供理论依据。 方法 以落叶松体胚性细胞系S287的成熟体细胞胚为材料,区分了落叶松体细胞胚的不同子叶形态;进行树脂切片及显微观察后,对其萌发能力进行了统计;并利用外源施用激素的方法研究了影响落叶松体胚再生成苗的重要因子。 结果 成熟的落叶松体细胞胚主要以四种形态存在,分别是正常子叶胚(NC ≥ 4),裂生子叶胚(2<NC < 4),杯状胚(NC=1)以及畸形胚。纵切结构观察显示前三种体胚都能发育出完整的SAM和RAM,萌发率依次为17.2%,12.4%和5.7%,而畸形胚不具有完整的SAM和RAM,在萌发培养基上不能生根,并很快死亡。针对萌发率低的现状,进一步施用不同浓度的GA3和IAA发现,只有2 mg·L-1 IAA对落叶松体胚生根具有明显的促进作用,其萌发率达到了56%,且在后期存活率仍能保持较高水平。 结论 IAA在落叶松体细胞胚萌发中发挥重要的调控作用。 Abstract:Objective Germination ability of somatic embryos in Larix leptolepis was investigated to provide theoretical basis for large-scale breeding. Method The study was conducted by using mature somatic embryos (SEs) from embryonic cell line S287 of L. leptolepis as the material. Four cotyledon shapes were distinguished and analyzed with resin sections method and microscopic observation. The rooting ability of the four types of SEs was calculated and the important factors that affect seedlings regeneration were identified with exogenous application of hormones. Result Four types of mature SEs in L. leptolepis were found in the investigation, i.e. the normal one with cotyledon number (NC) ≥ 4, the poorly separated-cotyledon one with 2 < NC < 4, the cup shape one with NC=1 and the deformed one. Microscopic observation revealed that the first three SEs could develop complete SAM and RAM, with germination rates of 17.2%, 12.4% and 5.7% respectively. However, the abnormal embryos did not have full SAM and RAM, and could not take root and soon died in germination medium. Exogenous application with GA3 and IAA of different concentration showed that 2 mg·L-1 IAA obviously promote the germination ability with 56% germination rate of SEs in L. leptolepis and later maintain a higher survival rate. Conclusion IAA plays a vital role in modulating germination ability of somatic embryos in L. leptolepis. -
Key words:
- Larix leptolepis
- / somatic embryogenesis system
- / germination rate
- / IAA
-
表 1 不同子叶形态落叶松体细胞胚所占比率及萌发率
Table 1. The proportion and germination rate of somatic embryos with different cotyledon numbers
描述
Description形态结构
Morphology子叶数目
Cotyledon number(NC)比率
Frequency/%萌发率
Germinationrate/%正常子叶胚
Normal
NC≥4 77.0 17.2 裂生子叶胚
Poorly
separated
2≤NC≥4 13.7 12.4 杯状胚
Cup-like
NC=1 7.0 5.7 畸形胚
Deformed
NC=0 2.3 0 表 2 不同激素处理落叶松体胚萌发率和存活率
Table 2. Embryonic germination and survival rate of different hormone treatments
激素类别
Hormones激素浓度
Hormone concentration/ (mg·L-1)萌发率
Germination rate/%存活率
Survival rate/%- - 11 7 GA3 0.2 19 11 0.5 32 13 1 24 13 2 13 5 5 15 7 IAA 0.2 26 22 0.5 23 18 1 45 38 2 56 47 3 41 29 4 28 12 5 20 14 10 22 14 GA3+ IAA 0.5+2 27 11 -
[1] 齐力旺. 华北落叶松体细胞胚胎发生与遗传转化系统建立的研究[D], 2000, 中国林业科学研究院. [2] Jain S M, Gupta P K. Protocol for Somatic Embryogenesis in Woody Plants[J]. Forestry Sciences, 2005(77): 11-24. [3] Li S, Li W, Han S, et al. Stage-specific regulation of four HD-ZIP Ⅲ transcription factors during polar pattern formation in Larix leptolepis somatic embryos[J]. Gene, 2013, 522(2): 177-183. doi: 10.1016/j.gene.2013.03.117 [4] 齐力旺, 韩一凡, 韩素英, 等. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响[J]. 林业科学, 2004, 40(1): 52-57. [5] 吕守芳, 张守攻, 齐力旺, 等. 落叶松体细胞胚胎发生研究进展. 林业科学研究[J]. 2004, 17(3): 392-398. [6] Aderkas P V, Klimaszewska K, Bonga J M. Diploid and haploid embryogenesis in Larix leptolepis, L. decidua, and their reciprocal hybrids[J]. Canadian Journal of Forest Research, 1990, 1(20): 9-14. [7] Teyssier C, Grondin C, Bonhomme L, et al. Increased gelling agent concentration promotes somatic embryo maturation in hybrid larch (Larix x eurolepsis): a 2-DE proteomic analysis[J]. Physiol Plant, 2011, 141(2): 152-65. doi: 10.1111/j.1399-3054.2010.01423.x [8] Belousova A C, Tret'Iakova I N. Patterns of somatic embryo formation in Siberian larch: embryological aspects[J]. Ontogenez, 2008, 39(2): 106-115. [9] Li W, Zhang S, Han S, et al. Regulation of LaMYB33 by miR159 during maintenance of embryogenic potential and somatic embryo maturation in Larix kaempferi(Lamb. ) Carr[J]. Plant Cell, Tissue and Organ Culture, 2013, 113(1): 131-136. doi: 10.1007/s11240-012-0233-7 [10] Zhang Y, Zhang S, Han S, et al. Transcriptome profiling and in silico analysis of somatic embryos in Japanese larch (Larix leptolepis)[J]. Plant Cell Rep, 2012, 31(9): 1637-1657. doi: 10.1007/s00299-012-1277-1 [11] Zhang S, Zhou J, Han S, et al. Four abiotic stress-induced miRNA families differentially regulated in the embryogenic and non-embryogenic callus tissues of Larix leptolepis[J]. Biochem Biophys Res Commun, 2010, 398(3): 355-60. doi: 10.1016/j.bbrc.2010.06.056 [12] Zhang L, Li W, Xu H, et al. Cloning and characterization of four differentially expressed cDNAs encoding NFYA homologs involved in responses to ABA during somatic embryogenesis in Japanese larch (Larix leptolepis). Plant Cell, Tissue and Organ Culture, 2014, 117(2): 293-304. doi: 10.1007/s11240-014-0440-5 [13] Cairney J, Xu N, Pullman G S. Natural and somatic embryo development in loblolly pine[J]. Applied Biochemistry and Biotechnology, 1999. 77(1-3): 5-17. doi: 10.1385/ABAB:77:1-3:5 [14] Yong W K, Yang Y, Noh E R, et al. Somatic embryogenesis and plant regeneration from immature zygotic embryos of Japanese larch (Larix leptolepis)[J]. Plant Cell, Tissue and Organ Culture, 1998. 55(2): 95-101. doi: 10.1023/A:1006120302512 [15] Yong W K, Moon H K. Enhancement of somatic embryogenesis and plant regeneration in Japanese larch (Larix leptolepis)[J]. Plant Cell, Tissue and Organ Culture, 2007. 88(3): 241-245. doi: 10.1007/s11240-007-9202-y [16] Klimaszewska K, Hargreaves C, Lelu-Walter M A, et al. Advances in Conifer Somatic Embryogenesis Since Year 2000[J]. Methods Mol Biol, 2016. 1359: 131-66. [17] Oh E, Yamaguchi S, Kamiya Y, et al. Light activates the degradation of PIL5 protein to promote seed germination through gibberellin in Arabidopsis[J]. Plant J, 2006. 47(1): 124-39. doi: 10.1111/j.1365-313X.2006.02773.x [18] Tsavkelova E A, Cherdyntseva T A, Klimova S Y, et al. Orchid-associated bacteria produce indole-3-acetic acid, promote seed germination, and increase their microbial yield in response to exogenous auxin[J]. Arch Microbiol, 2007. 188(6): 655-64. doi: 10.1007/s00203-007-0286-x [19] Li L, Qu R. In vitro somatic embryogenesis in turf-type bermudagrass: roles of abscisic acid and gibberellic acid, and occurrence of secondary somatic embryogenesis[J]. Plant Breeding, 2002. 121(2): 155-158. doi: 10.1046/j.1439-0523.2002.00684.x [20] López-Pérez A J, Carreño J, Dabauza M. Somatic embryo germination and plant regeneration of three grapevine cvs: Effect of IAA, GA3 and embryo morphology[J]. VITIS-Journal of Grapevine Research, 2015. 45(3): 141-143. [21] 徐云远, 种康. 植物干细胞决定基因WUS的研究进展. 植物生理与分子生物学学报[J], 2005(05): 461-468. [22] Vernoux T, Benfey P N. Signals that regulate stem cell activity during plant development[J]. Curr Opin Genet Dev, 2005. 15(4): 388-394. doi: 10.1016/j.gde.2005.06.008 [23] Byrne M E, Kidner C A, Martienssen R A. Plant stem cells: divergent pathways and common themes in shoots and roots[J]. Curr Opin Genet Dev, 2003. 13(5): 551-557. doi: 10.1016/j.gde.2003.08.008 [24] Shani E, Yanai O, Ori N. The role of hormones in shoot apical meristem function[J]. Curr Opin Plant Biol, 2006. 9(5): 484-489. doi: 10.1016/j.pbi.2006.07.008 [25] Liu B, Wang L, Zhang J, et al. WUSCHEL-related Homeobox genes in Populus tomentosa: diversified expression patterns and a functional similarity in adventitious root formation[J]. BMC Genomics, 2014. 15(1): 1-14. doi: 10.1186/1471-2164-15-1 [26] Aida M, Beis D, Heidstra R, et al. The PLETHORA genes mediate patterning of the Arabidopsis root stem cell niche[J]. Cell, 2004. 119(1): 109-120. doi: 10.1016/j.cell.2004.09.018 -





 下载:
下载: