-
‘金华美女’(Camellia japonica ‘Jinhua Meinü’)是山茶(C. japonica L.)名贵品种‘贝拉大玫瑰’(C. japonica Nuccio’s Bella Rossa)的芽变品种。相比绿色叶片的‘贝拉大玫瑰’,‘金华美女’叶芽呈红色,展叶期间的嫩叶呈深紫色,随着叶片生长,深紫色的叶片颜色逐渐淡化并变为红紫色,待叶片成熟后,呈现暗红色,该特性使其具有既可观花也可观叶的特性,提高了其观赏价值和经济价值。
已有研究表明,花青素苷含量变化是影响植物叶片呈红色或者紫色最主要的因素。常见的红叶或紫叶观赏植物,如红叶石楠(Photinia × fraseri ‘Red robin’)、红花檵木(Loropetalum chinense (R. Br.) Oliver var. rubrum Yieh)、紫色酢浆草(Oxalis corniculata L.)、紫叶李(Prunus cerasifera Ehrh.)等植物的叶片中,都含有较多的花青素苷[1-4]。花青素苷为一种类黄酮化合物,其最初是由苯丙氨酸开始,经过一系列复杂的黄酮代谢途径形成花青素,再通过UDP类黄酮糖基转移酶催化,与糖类化合物通过糖苷键形成稳定的花青素苷。目前,花青素苷合成途径中主要的酶以及对应的功能基因在多种植物中均已经研究,在花青素苷合成过程中均发挥重要的作用。在黄洋葱(Allium cepa L.)DFR启动子区域碱基发生突变后,导致该基因无法正常表达,使该洋葱品种表皮从紫色变成黄色[5]。将百子莲(Agapanthus praecox ssp.)的DFR基因转化到烟草(Nicotiana tabacum L.)中,并在烟草中进行过量表达,会使烟草花色由白色变为红色[6]。在连翘(Forsythia suspense L.)转化体系中,只有同时过量表达DFR和ANS基因才能够改变花色(由白色变红色)[7]。在荔枝(Litchi chinensis Sonn.)和石榴(Punica granatum L.)的果皮从青色变为红色的过程中,可以检测到UFGT基因表达明显上调[8-10]。虽然ANR表达产物不直接催化花青素苷合成,但也有证据显示,该基因的功能与花青素苷合成存在反向调控的关系[11-13]。目前,在模式植物的基因功能水平上已经对花青素苷合成相关基因及部分化合物进行含量分析,但很少有报道能够系统地分析基因表达水平与生物化学水平之间的关系。在经济价值较高的红叶或紫叶观赏植物叶片变色机理的研究中,并没有相关报道分析相关基因与化合物含量变化的关系。
本研究以‘金华美女’叶片为材料,以绿叶山茶‘贝拉大玫瑰’、杜鹃红山茶(C. azalea Wei)和红山茶(C. japonica L.)原种作为参照,分别测定叶片4个不同发育时期的DFR、ANS、UFGT、LAR和ANR基因的表达量,以及多酚合成途径中表儿茶素、花青素苷合成途径中矢车菊素-3-O-葡萄糖苷在叶片中的含量变化,以期从两类合成途径主要产物及相关调控基因的表达量层面揭示红叶品种变化机理,为今后开展分子育种,培育彩叶山茶新品种提供理论依据。
-
自2015年6月25日起,取3株4年生、健康、长势一致的‘金华美女’扦插苗,种植于中国林科院亚热带林业研究所苗圃中,于2016年4月23日起待其叶片由叶芽展开后,取顶端第1片叶后,待第2个叶芽叶片展开后10 d摘取,待第3个叶芽叶片展开后20 d摘取,待第4个叶芽叶片展开后30 d摘取,共4个时期,分别标记为Ⅰ、Ⅱ、Ⅲ和Ⅳ。每个时期在3个同品种不同植株上重复操作5次。所有样品采摘后均液氮研磨后-80℃冰箱保存备用。另取生长环境相同,同株数的‘贝拉大玫瑰’、杜鹃红山茶和1株红山茶原种作为平行对照。
-
叶片总RNA提取按照试剂盒(RN53-EASYspin Plus试剂盒,北京艾德莱生物科技有限公司)说明书进行。所得到RNA经电泳检测应有明显的两条带,同时经分光光度检测,确保所提取RNA的260/280和260/230均介于1.8~2.0,提取完成后置于-80℃下保存。
按照试剂盒(PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit,Takara)进行cDNA合成并将得到的cDNA储存于-20℃下备用。
-
根据NCBI数据库查询已知山茶属(Camellia L.)植物的DFR、ANS、LAR、ANR和UFGT cDNA序列,通过实验室现有的杜鹃红山茶转录组数据进行对比,确定相关基因的保守序列。采用NCBI Primer Designing Tool在线设计软件(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计1对扩增片段长度约100~150 bp且具高度特异性的荧光定量引物(表 1),GAPDH基因为内参基因。
表 1 荧光定量引物
Table 1. The primers for real-time PCR
基因
Gene name引物序列
The sequence of primersGeneBank DFR F
DFR RGTTCGCGATCCAGCGAATTT
TCCAGAGCAACCCTCAATGGAY648027.1 ANS F
ANS RGCCAAAAGAAGAGCTGACGG
CCTTCTTCAACGCCTTCCGAJN944577.1 LAR F
LAR RCCATCGGAGTTTGGGCATGA
GGCACCCCACACTCTTCTATCKR045740.1 ANR F
ANR RGCTACACCGGTCAACTTTGC
ACACGTTTAACCGTTCCTGCAY641729.1 UFGT F
UFGT RTAACCCTTGGGCTAATCCGC
TGTTGTCCGGGATTGGTGAGKP682360.1 使用试剂盒(SYBR® Premix Ex TaqTM,Takara)和QuantStudioTM 7 Flex荧光定量PCR仪(Applied Biosystems)进行荧光定量PCR实验;采用QuantStudioTM Real-Time PCR Software软件进行数据采集;采用Excel 2010软件进行数据分析。
-
叶片总多酚提取参考Inomata等[14]的方法。分别将儿茶素和表儿茶素标准品(购于ChromaDex公司)用甲醇配置成125、62.5、50、25 μg·mL-1 4个浓度的混合标品溶液。
色谱流动相配置及洗脱方法参考Punyasiri等[15]的方法。
-
采用Kerio等[16]的方法进行总花青素苷的提取。分别将矢车菊素-葡萄糖苷标准品配置100、50、25、12.5 μg·mL-14个浓度,使用岛津LC-20液相色谱系统(SPD-20A紫外检测器;Inertsustain C18色谱柱:150 mm×46 mm,5 μm)测定标准品溶液标准曲线和样品的矢车菊素-葡萄糖苷浓度,具体色谱流动相配置及洗脱方法参考Li等[17]的方法。
-
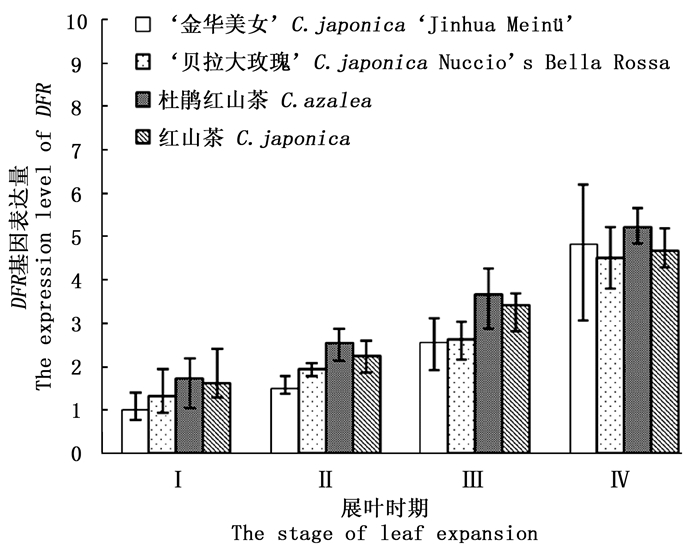
DFR基因功能是催化二氢槲皮素转化为无色矢车菊素,这两类化合物均为无色。图 1显示: 在叶片生长Ⅰ期到Ⅳ期,‘金华美女’和对照组叶片的DFR基因表达量随着叶片生长持续上调,在Ⅳ时期该基因平均表达量约是Ⅰ时期的3.4倍,这说明随着植物叶片生长,类黄酮物质合成速度也在逐渐加快。在叶片生长的相同时期内,4种山茶叶片中DFR表达量差异不显著(P>0.05),这说明DFR基因可能不是导致‘金华美女’与对照组叶色差异的关键基因。因此,初步排除了DFR基因对叶色变异的影响。
-
图 2显示:‘金华美女’叶片的ANS基因表达量与对照组的完全不同,呈现缓慢下降的趋势,到Ⅳ时期,其表达量仅为Ⅰ时期的20%。方差分析结果表明:Ⅰ时期,4种山茶的ANS基因表达量差异不显著,而随着叶片的生长,‘金华美女’与其余3种山茶叶片的ANS表达量差异极显著。ANS基因翻译的蛋白质功能催化无色矢车菊素转变为矢车菊素,在‘金华美女’叶片生长过程中该基因表达量却不断降低,这很可能存在某些因素抑制该基因的表达。
-
图 3显示:‘金华美女’LAR基因的表达量随着叶片的生长而上调,在Ⅳ时期,表达量是Ⅰ时期的9倍,高于此时对照组平均表达量2.57倍。在对照组中,该基因的表达量随着叶片的生长呈逐渐降低的趋势。儿茶素是植物多酚重要的组分,也是LAR基因对应酶蛋白催化的重要产物,其水或醇溶液呈无色透明,不会影响植物组织的呈色。图 4显示:‘金华美女’叶片中儿茶素含量呈逐渐下降趋势,而对照组叶片中儿茶素含量呈逐渐上升趋势。该结果与图 5对应的LAR基因表达量的趋势相反。虽然相应的基因上调表达,但儿茶素的底物即无色矢车菊素可能还是主要通过ANS途径合成矢车菊素,这导致‘金华美女’儿茶素含量出现降低的趋势,从最初的0.54 mg·g-1降低至0.27 mg·g-1。从化学结构上看,无色矢车菊素因为有邻位羟基(图 5)[18],化学基团不稳定,更容易生成矢车菊素。这就可能会导致LAR基因在上调表达的情况下,儿茶素含量仍出现降低。该结果说明‘金华美女’叶片中儿茶素合成基因LAR的生物学功能受到了抑制,在表达量上升的情况下,并不能高效地催化合成儿茶素,这很可能是受到其它代谢途径的竞争。
-
图 6显示:‘金华美女’叶片的ANR基因表达量与对照组的差异明显。在‘金华美女’叶片中,该基因的表达量水平在不同展叶时期,均明显低于对照组。尽管‘金华美女’叶片中的ANR表达量逐渐上升,但在Ⅳ时期仅上升了1.87倍,此时对照组的ANR平均表达量仍高于‘金华美女’5.8倍。由图 6也可以看出:ANR基因在对照组内保持较高的一致性,这说明该基因在绿色叶片中的表达非常稳定。
表儿茶素是ANR基因对应蛋白催化合成的重要化合物,该物质的水溶液和醇溶液均为无色透明溶液,在植物叶片中不会改变原有叶色。图 7显示:‘金华美女’叶片中表儿茶素由Ⅰ时期的0.21 mg·g-1下降至Ⅳ期的0.04 mg·g-1,含量降低了81%。在同一叶片生长时期内,‘金华美女’叶片中的表儿茶素含量明显低于对照组。对照组内可能由于植株年份以及生长状态的关系,也有较大的差异,但含量则显著高于‘金华美女’。这说明, 一方面叶片中花青素苷合成过程可能消耗了大量表儿茶素的底物,即矢车菊素;另一方面也可能由于合成表儿茶素对应的基因或者酶发生了改变,迫使矢车菊素在叶片中主要的转化途径发生改变。
综上所述,‘金华美女’叶片中表儿茶素途径受到了某些因素的强烈抑制,无论是基因表达水平还是化学水平,都大大低于对照组。由于ANR基因所在的生物学途径距离花青素苷合成途径很近,因此,该途径合成能力强弱很可能会通过花青素积累的方式影响‘金华美女’叶片中花青素苷的合成能力,进而影响叶色。
-
矢车菊素-3-O-葡萄糖苷(Cy3g)是一种常见的植物色素,呈红色,该物质的积累能够明显改变植物组织的颜色。该物质是由UFGT基因翻译的蛋白酶进行催化合成的。‘金华美女’叶片中UFGT基因表达量在4个时期基本呈先下降再上升的趋势(图 8),而对照组叶片中UFGT基因呈逐渐下降的趋势。在Ⅰ和Ⅱ时期,该基因在4种山茶叶片中的表达量差异不显著;在Ⅲ和Ⅳ时期,‘金华美女’的UFGT基因表达量显著高于对照组(P<0.05),这说明此时期该基因表达量水平出现了明显的差异。图 9表明:‘金华美女’叶片中矢车菊素-3-O-葡萄糖苷含量在4个时期介于1.2~1.4 mg·g-1,其中,Ⅱ时期的含量最高;而对照组叶片矢车菊素-3-O-葡萄糖苷在Ⅱ时期含量最高,红山茶含量可达0.42 mg·g-1,但随着叶片继续生长,含量迅速下降。通过对比,在这4个时期,‘金华美女’叶片中矢车菊素-3-O-葡萄糖苷含量明显高于对照组,尤其在叶片生长Ⅳ时期,含量高于对照组40至上百倍。由此可见,在‘金华美女’叶片生长过程中,UDP糖基转移酶(UFGT)持续催化花青素合成花青素苷,花青素苷是植物中重要的色素,色素大量的积累很大程度导致了‘金华美女’与对照组叶片颜色的差异。
通常山茶属植物的嫩叶也呈现短期的红色,这可能也是UFGT基因发挥作用;而在Ⅲ和Ⅳ时期,‘金华美女’叶片中UFGT基因表达量显著高于对照组叶片,这也反应了叶片颜色变化的实际情况。在Ⅲ和Ⅳ时期,对照组叶片颜色已经呈现绿色,而此时‘金华美女’叶片仍然呈红色。因此,通过UFGT基因表达量变化,可以初步推测该基因的持续表达在叶片变红过程中起重要作用。
-
目前,在植物多酚研究过程中,已确认多酚类物质主要由儿茶素和表儿茶素合成途径得到[19]。从目前的类黄酮合成途径可以推测,多酚含量降低可能会导致叶片中花青素含量上升,由于花青素含量的上升,又可能会促使UFGT基因持续进行表达,以消耗叶片中化学结构不稳定的花青素,减少对叶片生理的影响,使叶片积累化学性质更加稳定的花青素苷,这就可能改变整个叶片的颜色。通过与对照组对比可以看出,本试验中,山茶叶片中的ANR基因和UFGT基因在叶片中存在一定的负相关性,这与先前对苹果(Malus pumila Mill.)果皮、葡萄(Vitis vinifera L.)果皮和红掌(Anthurium andraeanum Linden)叶色变色的研究结果基本一致[12]。
过去,很少有文献报道多酚和植物叶色之间的相关性。本试验利用红叶的‘金华美女’与‘贝拉大玫瑰’、杜鹃红山茶和红山茶这3种绿叶山茶进行比较,分别从花青素苷合成途径中基因表达水平和上下游产物的化学水平对红叶山茶品种叶色变异现象进行了初步解释,发现多酚与叶色之间存在明显的负相关性。根据现有的类黄酮代谢途径,本试验结果显示:‘金华美女’叶色变异很可能是因为ANR基因表达水平受到了明显的抑制,并影响了矢车菊素转化为表儿茶素的效率,进一步改变了类黄酮代谢途径正常的走向。因此,今后需要从基因结构、下游产物结构的角度进一步探讨多酚合成途径与叶色形成关系,从根本上解释‘金华美女’叶色变异产生的原因,这将有助于通过分子育种方式改造山茶属植物或者其它科属植物,培育更多的彩叶观赏植物。
-
根据RT-PCR结果,初步排除DFR基因表达量与‘金华美女’叶色变异的相关性。通过对叶片矢车菊素-3-O-葡萄糖苷含量的分析看出,‘金华美女’叶片中含有较多的矢车菊素-葡萄糖苷,这也可以排除ANS基因发生功能性突变的可能性。若LAR基因发生突变导致基因功能改变,则上游底物无色矢车菊素会在叶片积累,这可能会促使ANS基因持续高表达,也可能会促使DFR基因下调表达;同时该基因下游的儿茶素含量在叶片生长过程中也会保持较低水平,而在Ⅰ时期,‘金华美女’儿茶素含量0.54 mg·g-1,与对照组相差并不大,根据这些数据,可以排除LAR发生功能性突变的可能性。在Ⅰ和Ⅱ 2个时期内,‘金华美女’和对照组叶片中UFGT基因表达量的差异不显著,但在Ⅲ和Ⅳ时期,‘金华美女’叶片中该基因表达量明显高于对照组。通过对矢车菊素-3-O-葡萄糖苷含量测定和叶色的直接观察,也能看出‘金华美女’叶片中UFGT基因持续表达,这说明UFGT基因的功能是正常的,但不能完全排除UFGT相关调控基因发生突变致使无法下调UFGT基因表达量的可能性。通过对ANR基因表达量和表儿茶素含量的分析看出,‘金华美女’叶片ANR基因表达量以及表儿茶素含量均明显低于对照组。通常在生物体内基因发生突变的概率比较低,而2个基因同时发生突变,又恰好改变植物叶片颜色的概率更低,考虑到ANR基因所在合成途径的关键位置以及该基因下游产物的含量,故推断ANR基因功能发生改变的概率较大,并影响了下游转录与表达。
红叶山茶品种花青素苷相关基因表达水平及代谢产物分析
Analysis of Gene Expressing and Metabolites for Synthesising Anthocyanins Influencing the Red Color of Leaves of Camellia Cultivar
-
摘要:
目的 通过对花青素苷相关合成基因的表达水平和代谢产物的分析,系统地阐明‘金华美女’叶色变异与基因表达的关系。 方法 以‘金华美女’为材料,‘贝拉大玫瑰’、杜鹃红山茶和红山茶为参照组,使用NCBI Primer Designing Tool设计山茶DFR、ANS、LAR、ANR和UFGT基因的荧光定量引物,使用实时荧光定量PCR仪测定这5个基因在叶片4个发育时期的表达量;采用高效液相色谱仪测定对应时期的多酚合成途径的主要次生代谢产物(儿茶素、表儿茶素),以及花青素苷合成途径的主要代谢产物矢车菊素-3-O-葡萄糖苷的含量。 结果 表明:(1)在4个时期中,红叶品种叶片中DFR基因表达量与对照组差异不显著,ANS、LAR、ANR和UFGT基因在4个时期的表达量与对照组存在显著差异,这说明‘金华美女’类黄酮代谢途径相关基因在表达水平上发生了改变;(2)‘金华美女’叶片中多酚含量明显低于对照组,其中,表儿茶素含量仅为0.04~0.21 mg·g-1,这说明在生理水平上,‘金华美女’叶片中多酚合成途径可能受阻;(3)‘金华美女’叶片中矢车菊素-3-O-葡萄糖苷含量达1.2~1.4 mg·g-1,4个生长阶段均显著高于对照组,这说明‘金华美女’叶片具备持续合成花青素苷的能力。 结论 根据试验结果,推断‘金华美女’叶色变异的主要原因可能是由于花青素还原酶基因的表达水平受到了抑制,降低了矢车菊素催化成表儿茶素的效率,使叶片类黄酮代谢途径中以多酚为主的合成方向转向花青素苷合成方向。 Abstract:Objective By analyzing the quantitative change of structural genes and metabolite of anthocyanin in 4 growth stages, the relationship between leaf-color mutation and gene expression was systematically illustrated. Method The leaves of Camellia japonica 'Jinhua Meinü' were selected taking the leaves of C. japonica 'Nuccio's Bella Rossa', C. azalea, and C. japonica as control. NCBI Primer Designing Tool was used to design the primers and the gene expressing of DFR, ANS, UFGT, ANR and LAR were analyzed by real-time PCR and measured the contents of catechins, epicatechins and cyanidin 3-O-glucoside by HPLC. Result (1) In the four growth stages, no significant difference was found in the expressing of DFR, nevertheless, the expressing of ANS, UFGT, ANR and LAR between red and green cultivar were obviously different, which indicating the express levels of those genes of flavonoids metabolic pathways had been altered in the leaves of C. japonica 'Jinhua Meinü'. (2) The content of polyphenols in the leaves of C. japonica 'Jinhua Meinü' were at a significantly lower level than the control groups, in particular, the content of epicatechins was only 0.04-0.21 mg·g-1, which suggesting the synthetic route of polyphenols were astricted in physiological level. (3) The average content of cyanidin 3-O-glucoside in the leaves of C. japonica 'Jinhua Meinü' was 1.2-1.4 mg·g-1, which was at a significantly higher level than the control groups in all the four growth stages. The content of cyanidin 3-O-glucoside could explain the capacity of synthesizing anthocyanins was kept in the leaves of the red cultivar. Conclusion According to above data, it can be preliminary inferred that the leaf color of C. japonica 'Jinhua Meinü' related to the change of anthocyanins metabolic pathway. -
Key words:
- camellia
- / anthocyanins
- / polyphenols
- / synthetic route
- / gene expressing
- / leaf color
-
表 1 荧光定量引物
Table 1. The primers for real-time PCR
基因
Gene name引物序列
The sequence of primersGeneBank DFR F
DFR RGTTCGCGATCCAGCGAATTT
TCCAGAGCAACCCTCAATGGAY648027.1 ANS F
ANS RGCCAAAAGAAGAGCTGACGG
CCTTCTTCAACGCCTTCCGAJN944577.1 LAR F
LAR RCCATCGGAGTTTGGGCATGA
GGCACCCCACACTCTTCTATCKR045740.1 ANR F
ANR RGCTACACCGGTCAACTTTGC
ACACGTTTAACCGTTCCTGCAY641729.1 UFGT F
UFGT RTAACCCTTGGGCTAATCCGC
TGTTGTCCGGGATTGGTGAGKP682360.1 -
[1] 蒋益花, 蒋新龙. 红花继木叶红色素的提取及性质研究[J]. 中国调味品, 2005(11): 38-42. [2] 薛晓丽. 紫叶李叶中花青素含量的测定[J]. 湖北农业科学, 2010, 49(4): 956-958. doi: 10.3969/j.issn.0439-8114.2010.04.061 [3] 蒋新龙. 紫叶酢浆草色素的提取及性质研究[J]. 食品科技, 2006, 31(5): 72-76. [4] 胡旭芳. 红叶石楠红色素中花色苷成分的定性和定量研究[J]. 农学学报, 2013, 3(12): 45-47. doi: 10.3969/j.issn.1007-7774.2013.12.010 [5] Kim S, Yoo K S, Pike L M. Development of a PCR-based marker utilizing a deletion mutation in the dihydroflavonol 4-reductase (DFR) gene responsible for the lack of anthocyanin production in yellow onions (Allium cepa)[J]. Theor Appl Genet, 2005, 110(3): 588-595. doi: 10.1007/s00122-004-1882-7 [6] Mori S, Otani M, Kobayashi H, et al. Isolation and characterization of the dihydroflavonol 4-reductase gene in the monocotyledonous ornamental Agapanthus praecox ssp. orientalis (Leighton) Leighton[J]. Scientia Horticulturae, 2014, 166(1): 24-30. [7] Rosati C, Simoneau P, Treutter D, et al. Engineering of flower color in forsythia by expression of two independently-transformed 4-reductase and anthocyanidin synthase genes of flavonoid pathway[J]. Molecular Breeding, 2003, 12(3): 197-208. doi: 10.1023/A:1026364618719 [8] Li X J, Zhang J Q, Wu Z C, et al. Functional characterization of a glucosyltransferase gene, LcUFGT1, involved in the formation of cyanidin glucoside in the pericarp of Litchi chinensis[J]. Physiologia Plantarum, 2016, 156(2): 139-149. doi: 10.1111/ppl.12391 [9] Qi X, Shuai Q, Chen H, et al. Cloning and expression analyses of the anthocyanin biosynthetic genes in mulberry plants[J]. Mol Genet Genomics, 2014, 289(5): 783-793. doi: 10.1007/s00438-014-0851-3 [10] Zhao Z C, Hu G B, Hu F C, et al. The UDP glucose: flavonoid-3-O-glucosyltransferase (UFGT) gene regulates anthocyanin biosynthesis in litchi (Litchi chinesis Sonn. ) during fruit coloration[J]. Molecular biology reports, 2012, 39(6): 6409-6415. doi: 10.1007/s11033-011-1303-3 [11] Bogs J, Downey M O, Harvey J S, et al. Proanthocyanidin synthesis and expression of genes encoding leucoanthocyanidin reductase and anthocyanidin reductase in developing grape berries and grapevine leaves[J]. Plant Physiology, 2005, 139(2): 652-663. doi: 10.1104/pp.105.064238 [12] 李雪, 李志英, 丛汉卿, 等. 红掌ANR基因克隆及其表达与佛焰苞颜色的相关性分析[J]. 分子植物育种, 2013, 11(6): 825-830. [13] Chu Y, Pan J, Wu A, et al. Molecular cloning and functional characterization of(dihydroflavonol-4-reductase)gene from(Calibrachoa hybrida)[J]. Scientia Horticulturae, 2014, 165(70): 398-403. [14] Inomata Y, Terahara N, Kitajima J, et al. Flavones and anthocyanins from the leaves and flowers of Japanese Ajuga species (Lamiaceae)[J]. Biochemical Systematics and Ecology, 2013, 51(4): 123-129. [15] Punyasiri P, Abeysinghe I, Kumar V, et al. Flavonoid biosynthesis in the tea plant Camellia sinensis: properties of enzymes of the prominent epicatechin and catechin pathways[J]. Archives of Biochemistry and Biophysics, 2004, 431(1): 22-30. [16] Kerio L, Wachira F, Wanyoko J, et al. Characterization of anthocyanins in Kenyan teas: Extraction and identification[J]. Food Chemistry, 2012, 131(1): 31-38. [17] Li J B, Hashimoto F, Shimizu K, et al. Chemical taxonomy of red-flowered wild Camellia species based on floral anthocyanins[J]. Phytochemistry, 2013, 85(1): 99-106. [18] Holton T A, Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. The Plant Cell, 1995, 7(7): 1071-1083. [19] Jiang X, Liu Y, Wu Y, et al. Analysis of accumulation patterns and preliminary study on the condensation mechanism of proanthocyanidins in the tea plant (Camellia sinensis)[J]. Sci Rep, 2015, 5: 8742. -





 下载:
下载: