-
土壤作为陆地生态系统的氮库,含氮量巨大,但大部分土壤氮素不能被植物直接吸收利用,只有在微生物的参与下转变为矿质氮,植物才能吸收利用[1]。在过去20年里,大量研究表明增温影响氮循环过程,提高土壤矿化速率,为植物提供更多的无机氮[2-3]。因此,氮素和水分是限制陆地植物生长的关键要素[4-5],在未来气候变化下,其响应变化显得尤为重要。稳定同位素技术可以用于示踪、整合和指示目标物,并且检测快速、结果准确,是一种新颖的发展迅速的生态学研究方法[6]。如δ13C值能反应植物生长期内的生理生态适应特征,可用于估测植物长期水分利用效率[7-9]。氮饱和则是指环境中可利用的氮素超过了植物生长所需[10],叶片δ15N值可以间接地反映氮循环特征,指示生态系统氮饱和状态[11-12]。
我国人工林的一个重要分区就是湿润亚热带地区,杉木(Cunninghamia lanceolata (Lamb.) Hook)则是该地区一种优势造林树种,福建大部分山地丘陵区均有分布,杉木具有生长快、材质好、易加工等优点,对我国林业生产意义重大[13]。因此,在气候变暖背景下,研究亚热带杉木氮饱和程度以及水分利用效率的响应,对于揭示我国人工林如何应对全球气候变暖、保障林业生产长时间稳定发展的同时如何促进森林增汇减排具有重要意义。本研究在福建三明开展模拟增温试验,利用稳定同位素手段,研究增温对氮循环和水分利用效率的影响,以期为森林更好地管理经营提供理论指导。
-
研究区位于福建省三明市森林生态系统与全球变化研究站(26° 19′ N,117° 60′ E),三明陈大林业国有林场观测点。该地区气候类型为中亚热带季风气候,年平均气温19.1℃,年蒸发量1 585 mm,年降水量1 670 mm,降水主要集中在3—8月,相对湿度81%,土壤为红壤[14]。
-
2013年,在三明陈大设置10个2 m×2 m的实验小区,小区四周用PVC板与周围土壤隔离,防止相互干扰,土壤为黑云母花岗岩发育的红壤。每个小区平均分为1 m×1 m的次小区,从当地苗圃选择植株高度、基径、鲜质量基本一致的1年生杉木幼苗(平均株高和基径分别为25.7±2.5 cm和3.4±0.4 mm),随机移植到每个次小区中心[15]。实验共设置对照(CT)和增温(W) 2个处理,并且每一个处理重复5个样方。本实验采用电缆增温[16],2013年10月平行布设电缆,每两条电缆相隔20 cm,布设于土下10 cm处,为消除土壤异质性,对照和增温处理均布设增温电缆,并且于2014年3月开始增温试验,增温幅度为5℃[17]。
-
2016年4月增温满2年时,于每个小区采摘若干杉木当年生鲜叶,根据树高分上、中、下3层,采摘混合带回实验室。于105℃杀青15 min,再将其置于65℃烘箱烘干至恒质量,然后利用自动球磨仪将样品粉碎,过0.149 mm筛,制成待测样品。将粉碎样品用锡纸杯包裹,植物碳氮元素分析仪(Elemental Analyzer Vario EL Ⅲ, Germany)用于测定粉碎样品的碳氮含量,用同位素质谱仪(Thermo scientific MAT253, Germany)测定δ13C和δ15N。
$ \delta^{13} C\left(\%_{0}\right)=\left(R_{\text { sample }}-R_{\text { standard }}\right) / R_{\text { standard }} \times 1000 $
(1) $ \delta^{15} N\left(\%_{0}\right)=\left(R_{\text { sample }}-R_{\text { standard }}\right) / R_{\text { standard }} \times 1000 $
(2) 式中,R分别为13C/12C或15N/14N的比值,Rsample是指杉木叶片或表层土壤的R值,Rstandard则是指国际标准物的R值[18]。
-
于同一时间在每个小区内,采用多点混合法取样,用3.7 cm内径的土钻随机钻取0~10 cm深度的土样,带回实验室混合,剔除砂砾和植物根系等杂物,将土样置于室温下自然风干,研钵研磨过0.149 mm筛,制成待测样品。称取900~1 000 mg土壤样品,土壤碳氮元素分析仪(Elemental Analyzer Vario MAX, Germany)用于测定土壤样品的总有机碳、总氮含量,并且用同位素质谱仪测定土壤δ13C和δ15N值。其中,叶片15N的富集指数(enrichment factors, EF)的计算方法见公式(3):
$ E F=\delta^{15} N_{\text { leaf }}-\delta^{15} N_{\text { soil }} $
(3) 式中,δ15Nleaf是指杉木叶片(当年生)δ15N值,δ15Nsoil是指表层土壤(0~10 cm)δ15N值[19]。
-
实验所得数据用Excel 2013和SPSS 20.0软件进行分析,用Origin 9.0完成绘图。用独立样本t检验分析不同处理下杉木叶片及土壤碳、氮含量以及碳、氮稳定同位素的差异性,显著性水平为p=0.05,用Pearson相关方法检验叶片稳定碳、氮同位素自然丰度值与叶片养分含量间是的相关关系。
-
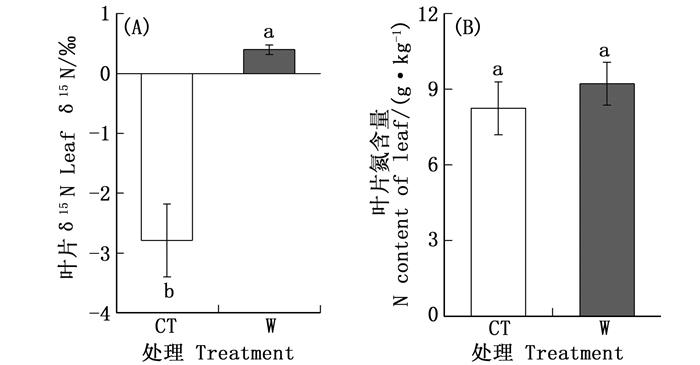
通过分析不同处理杉木叶片δ15N值发现,不同温度处理间叶片δ15N值差异极显著。相比于对照(-2.79‰),增温后(0.40‰)叶片δ15N值显著提高了3.19‰(图 1A)。此外,温度上升促使杉木叶片氮素含量增加11.81%,但是与对照处理相比无显著差异(图 1B)。
-
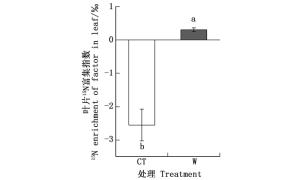
与对照处理(-0.42‰)相比,增温5℃使土壤δ15N值提高了0.53‰(图 2);两种处理间土壤总氮含量无显著差异(表 1)。另外,对照与增温处理的叶片15N富集指数分别为-2.55‰和0.31‰,两种不同处理之间叶片15N富集指数差异极显著。总体来说,增温处理叶片15N富集指数与0更接近(图 3)。
表 1 土壤含水率及其养分含量
Table 1. Moisture and nutrients content of soil
处理
Treatment土壤含水率
Soil water content/%土壤总有机碳
Soil total organic C/(g·kg-1)土壤总氮
Soil total N/(g·kg-1)对照CT 27.42±2.97a 12.80±1.64a 1.06±0.12a 增温W 25.30±2.90b 12.33±1.59a 1.02±0.11a 注:不同小写字母表示不同处理差异显著 -
对杉木叶片碳稳定同位素数据进行独立样本t检验,结果显示不同处理之间δ13C值无显著差异(图 4)。另外,Pearson相关分析显示,叶片δ13C值或δ15N值均与叶片碳、氮元素含量之间无显著相关关系,但叶片δ13C值与δ15N值显著正相关(表 2)。
表 2 叶片稳定碳、氮同位素比值与碳、氮含量以及土壤含水率的关系
Table 2. Correlations of leaf δ13C and δ15N with carbon and nitrogen contents in leaves and soil moisture content
参数
Parameters叶片δ15N
Leaf δ15N叶片δ13C
Leaf δ13C叶片总碳
Leaf total C叶片总氮
Leaf total N叶片C/N
Leaf C/N叶片δ15N Leaf δ15N 1 叶片δ13C Leaf δ13C 0.907* 1 叶片总有机碳Leaf total organic C -0.276 -0.142 1 叶片总氮Leaf total N 0.704 0.457 -0.009 1 叶片C/N Leaf C/N -0.716 -0.464 0.058 -0.995** 1 注: *: p < 0.05; * *: p < 0.01 -
全球变暖已成不争的事实,与之相关的研究也逐渐增多,有研究表明15N可用来评估生态系统的氮饱和状态[12, 20]。本研究中,增温使表层土壤和杉木叶片的δ15N值均显著提高(图 1, 图 2)。这与较多的研究结果类似,陆地植物及其生长的土壤δ15N值随温度增加而上升[21-22]。植物吸收土壤氮素的过程几乎不发生同位素分馏,但参与土壤氮素转化的微生物存在分馏效应,且受温度影响较大[23-24]。前期,刘志江等[25]对本研究区杉木幼林的研究结果表明增温促进土壤矿化,提高土壤有效氮;高金涛[26]高通量测序结果显示,增温后微生物生物量明显下降,但部分优势种群丰度显著提高,加强土壤矿化。另外,由于本研究区高温多雨,较轻的14N易随着淋溶和反硝化过程输出系统,土壤无机氮库15N富集,植物吸收利用无机氮,因此可能导致植物δ15N值上升[27-28]。
Tcherkez和Hodges[29]认为,植物菌根吸收土壤中可利用氮素时会发生氮同位素分馏,而土壤中能被植物利用的有效氮浓度及植物对氮素的需求量决定菌根分馏效应。叶片15N富集指数为当年生叶片δ15N值与表层土壤δ15N值之间的差值[30],郑嘉璐等[10]认为这一差值可能来自于菌根分馏作用。肖好燕等[31]对比杉木人工林和阔叶人工林、天然林的叶片15N富集指数,发现杉木人工林叶片15N富集指数更接近于0,菌根分馏效应更弱,氮饱和程度更高,即叶片15N的富集指数可以用来反映系统氮饱和程度[32]。本研究中,增温处理叶片15N富集指数更接近于0 (图 3),说明气候变暖可能提高生态系统的氮饱和程度。Callesen等[19]研究新英格兰云杉冷杉结果显示,土壤氮饱和程度上升的直观表现是叶片氮含量增加,氮循环加快,系统富集15N;植物吸收氮素过程中菌根分馏效应减弱,叶片δ15N值增大[33]。
-
环境因素会改变叶光合羧化酶活性以及叶片气孔开闭程度,影响胞间二氧化碳(CO2)浓度和大气CO2浓度比值(Ci/Ca),进而影响植物碳同位素分馏效应,其分馏效应与Ci/Ca值之间显著负相关[7]。Ci/Ca值反映净光合同化速率(CO2需求)和气孔导度(CO2供给)两个变量的相对大小,水分利用效率反映的则是同化CO2速率与水分消耗的相对大小,因此,植物的长期水分利用效率变化趋势可以反映在δ13C值上[34],植物δ13C值与其水分利用效率呈正相关关系[35-37]。喻方圆等[38]对针叶树苗的研究表明,热胁迫后马尾松(Pinus massoniana Lamb.)幼苗和花旗松(Pseudotsuga menziesii (Mirbel) Franco)幼苗的δ13C值都没有明显的变化,这与本研究结果类似(图 4)。可能是因为植物δ13C值是受高度遗传控制的,对温度敏感性较小[39]。另外,土壤含水率下降,根系脱水会产生一种根冠信号——脱落酸,抑制气孔开放,减小蒸腾效应,维持一定叶片水分利用效率[40-41]。Saurer等人[42]对比山毛榉(Fagus)、松树(Pinus)和云杉(Picea asperata Mast.)的δ13C值,发现土壤含水率越低,林木δ13C值越高。本研究区位于福建省亚热带,气候湿润,且4月降水尤为丰富[43],虽然增温降低了土壤含水率(表 1),但植物可以通过产生脱落酸维持一定的水分利用效率,故增温后植物δ13C值无显著变化。并且,湿润地区植物脆弱性分割不显著,叶片像“安全阀”一样保护液压通路,使植物面对潜在干旱胁迫时可以保持水的供应和叶片功能[50],短期增温并不能显著影响叶片水分利用效率。
通过对碳稳定同位素自然丰度与碳氮元素含量的相关性分析结果发现,杉木叶片δ13C与叶片δ15N之间存在显著正相关关系(表 2),说明碳代谢过程与氮代谢过程之间存在交集,相辅相成。碳代谢过程中需要的酶以及光合色素的合成都需要氮素参与[45],对照和增温处理叶片氮含量无显著变化(图 1B),也可以从侧面解释增温对叶片δ13C值无显著影响。另外植物对氮素的吸收利用与土壤水分吸收同时进行[46],氮素吸收利用过程中存在同位素分馏效应,因此该地区植物水分利用效率与系统氮饱和状态之间可能存在一个相互促进的关系。
-
通过对比不同处理杉木幼林碳氮同位素特征,可以得出以下结论:1)增温促使杉木叶片和表层土壤δ15N值显著上升,并且促使叶片15N富集指数与0更接近,全球变暖促使该地区生态环境趋于氮饱和;2)增温后,叶片δ13C值无显著变化,即短期增温对植物水分利用效率无显著影响,水分可能不是植物生长的主要限制性因素;3)杉木幼林叶片δ13C值与其δ15N值呈显著正相关关系,说明碳代谢与氮代谢是相辅相成的。在此研究基础上,未来的试验可以进一步深入研究菌根对杉木吸收利用氮素过程中氮同位素分馏效应的影响,以及长期高温胁迫对植物水分利用效率的影响,以期为全球变暖背景下杉木人工林经营策略提供有价值的信息。
短期增温对亚热带杉木幼林碳氮同位素组成的影响
Influence of Short-term Warming on the Composition of Stable Carbon and Nitrogen Isotopes in Cunninghamia lanceolata in Subtropical Region of China
-
摘要:
目的 利用稳定同位素手段,研究增温对氮循环和水分利用效率的影响,揭示亚热带杉木幼苗水分利用效率和氮饱和状态对气候变暖的响应。 方法 在福建省三明市森林生态系统与全球变化研究站,布设发热电缆对土壤进行增温,设置对照(CT)和增温(W)两种实验小区。分别采集不同处理杉木叶片和0~10 cm表层土壤,测定植物-土壤碳、氮稳定同位素,以及碳和氮含量。 结果 显示:增温处理叶片δ15N值(0.40‰)比对照处理(-2.79‰)显著增加了3.19‰;但增温后叶片氮含量只是略有上升,与对照无显著差异;增温后,表层土壤δ15N值显著上升,叶片15N的富集指数比对照处理更接近于0;增温与对照处理叶片δ13C值分别为-29.35‰和-29.08‰,无显著差异;叶片δ13C与δ15N之间存在显著正相关关系。 结论 温度是中亚热带地区氮循环的一个重要影响因素,增温促使杉木叶片和表层土壤δ15N值显著提高,碳代谢与氮代谢相辅相成。 Abstract:Objective To study the effects of warming on nitrogen cycle and water use efficiency by isotopic method, and to explore the response of the water use efficiency and the nitrogen saturation state of subtropical Cunninghamia lanceolata juveniles grown in subtropical region to global warming. Method The experimental site is located in the Global Change Experimental Platforms, in Sanming of Fujian Province, China. The heating cables were used to artificially induce the warming. The treatments of control (CT) and warming (W) were set up. The leaves of C. lanceolata and surface soil (0~10 cm depth) were sampled to examine the contents of their stable N and carbon (C) isotopes, i.e., δ15N and δ13C, and the contents of C and N. Result Compared to the control treatment (-2.79‰), the foliar δ15N of the warming treatment (0.40‰) significantly increased by 3.19‰; but no significant difference was found in the leaf N contents between the control and the warming treatments. After warming, there was a significant increase in surface soil δ15N, and leaf 15N enrichment index was closer to 0 compared to that in the control treatment. The foliar δ13C of the warming and control treatments were -29.35‰ and -29.08‰, respectively. There was a significant positive correlation between foliar δ15N and δ13C. Conclusion These findings suggest that the temperature is an important factor affecting N cycling in subtropical regions. Warming can increase leaf and soil δ15N significantly, and the metabolism of carbon and nitrogen complement each other. -
表 1 土壤含水率及其养分含量
Table 1. Moisture and nutrients content of soil
处理
Treatment土壤含水率
Soil water content/%土壤总有机碳
Soil total organic C/(g·kg-1)土壤总氮
Soil total N/(g·kg-1)对照CT 27.42±2.97a 12.80±1.64a 1.06±0.12a 增温W 25.30±2.90b 12.33±1.59a 1.02±0.11a 注:不同小写字母表示不同处理差异显著 表 2 叶片稳定碳、氮同位素比值与碳、氮含量以及土壤含水率的关系
Table 2. Correlations of leaf δ13C and δ15N with carbon and nitrogen contents in leaves and soil moisture content
参数
Parameters叶片δ15N
Leaf δ15N叶片δ13C
Leaf δ13C叶片总碳
Leaf total C叶片总氮
Leaf total N叶片C/N
Leaf C/N叶片δ15N Leaf δ15N 1 叶片δ13C Leaf δ13C 0.907* 1 叶片总有机碳Leaf total organic C -0.276 -0.142 1 叶片总氮Leaf total N 0.704 0.457 -0.009 1 叶片C/N Leaf C/N -0.716 -0.464 0.058 -0.995** 1 注: *: p < 0.05; * *: p < 0.01 -
[1] 高建梅, 董丽媛, 胡古, 等.哀牢山中山湿性常绿阔叶林土壤氮转化的海拔效应[J].生态学杂志, 2011, 30(10):2149-2154. [2] Butler M, Melillo J M, Johnson J E, et al. Soil warming alters nitrogen cycling in a New England forest:implications for ecosystem function and structure[J]. Oecologia, 2012, 168(3):819-828. doi: 10.1007/s00442-011-2133-7 [3] 马志良, 赵文强, 赵春章, 等.青藏高原东缘窄叶鲜卑花高寒灌丛生长季土壤无机氮对增温和植物去除的响应[J].植物生态学报, 2018, 42(1):86-94. [4] Salih N, Ågren G I, Hallbäcken L. Modeling response of N addition on C and N allocation in Scandinavian Norway Spruce stands[J]. Ecosystems, 2005, 8(4):373-381. doi: 10.1007/s10021-003-0103-6 [5] 韩博, 李志勇, 郭浩, 等.干旱胁迫下5种幼苗光合特性的研究[J].林业科学研究, 2014, 27(1):92-98. [6] 郑秋红, 王兵.稳定性同位素技术在森林生态系统碳水通量组分区分中的应用[J].林业科学研究, 2009, 22(1):109-114. doi: 10.3321/j.issn:1001-1498.2009.01.019 [7] Farquhar G D, O'Leary M H, Berry J A. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves[J]. Functional Plant Biology, 1982, 9(2):281-292. [8] 何春霞, 张劲松, 黄辉, 等.豫东平原3种模式杨树-小麦复合系统水分利用效率的研究[J].林业科学研究, 2015, 28(5):660-668. doi: 10.3969/j.issn.1001-1498.2015.05.009 [9] 赵艳艳, 徐隆华, 姚步青, 等.模拟增温对高寒草甸植物叶片碳氮及其同位素δ13C和δ15N含量的影响[J].西北植物学报, 2016, 36(4):777-783. [10] 郑璐嘉, 黄志群, 何宗明, 等.林龄、叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响[J].林业科学, 2015, 51(1):22-28. [11] Kahmen A, Wanek W, Buchmann N. Foliar δ15N values characterize soil N cycling and reflect nitrate or ammonium preference of plants along a temperate grassland gradient[J]. Oecologia, 2008, 156(4):861-870. doi: 10.1007/s00442-008-1028-8 [12] Sun F F, Kuang Y W, Wen D Z, et al. Long-term tree growth rate, water use efficiency, and tree ring nitrogen isotope composition of Pinus massoniana L. in response to global climate change and local nitrogen deposition in Southern China[J]. Journal of Soils & Sediments, 2010, 10(8):1453-1465. [13] 黄彩芹.杉木高海拔地区造林技术[J].林业实用技术, 2016(1):17-18. [14] 刘小飞, 林廷武, 熊德成, 等.土壤增温及降雨隔离对杉木幼林林下植被生物量的影响[J].亚热带资源与环境学报, 2014, 9(3):92-95. doi: 10.3969/j.issn.1673-7105.2014.03.013 [15] Liu X, Yang Z, Lin C, et al. Will nitrogen deposition mitigate warming-increased soil respiration in a young subtropical plantation?[J]. Agricultural & Forest Meteorology, 2017, 246:78-85. [16] Melillo J M, Butler S, Johnson J, et al. Soil warming, carbon-nitrogen interactions, and forest carbon budgets[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(23):9508-9512. doi: 10.1073/pnas.1018189108 [17] Zhang Q, Xie J, Lyu M, et al. Short-term effects of soil warming and nitrogen addition on the N:P stoichiometry of Cunninghamia lanceolata, in subtropical regions[J]. Plant & Soil, 2016, 411:1-13. [18] Vallano D M, Sparks J P. Foliar δ15N is affected by foliar nitrogen uptake, soil nitrogen, and mycorrhizae along a nitrogen deposition gradient[J]. Oecologia, 2013, 172(1):47-58. doi: 10.1007/s00442-012-2489-3 [19] Callesen I, Nilsson L O, Schmidt I K, et al. The natural abundance of 15N in litter and soil profiles under six temperate tree species:N cycling depends on tree species traits and site fertility[J]. Plant & Soil, 2013, 368(1-2):375-392. [20] Garten C T. Variation in foliar 15N abundance and the availability of soil nitrogen on walker branch watershed[J]. Ecology, 1993, 74(7):2098-2113. doi: 10.2307/1940855 [21] 刘晓宏, 赵良菊, Menassie G, 等.东非大裂谷埃塞俄比亚段内C3植物叶片δ13C和δ15N及其环境指示意义[J].科学通报, 2007, 52(2):199-206. doi: 10.3321/j.issn:0023-074X.2007.02.013 [22] Liu W, Wang Z, Zheng W, et al. Variations in nitrogen isotopic values among various particle-sized fractions in modern soil in northwestern China[J]. Chinese Journal of Geochemistry, 2011, 30(3):295-303. doi: 10.1007/s11631-011-0513-7 [23] Amundson R, Austin A T, Schuur E A G, et al. Global patterns of the isotopic composition of soil and plant nitrogen[J]. Global Biogeochemical Cycles, 2003, 17(1):3101-3110. [24] 刘贤赵, 张勇, 宿庆, 等.陆生植物氮同位素组成与气候环境变化研究进展[J].地球科学进展, 2014, 29(2):216-226. [25] 刘志江, 林伟盛, 杨舟然, 等.模拟增温和氮沉降对中亚热带杉木幼林土壤有效氮的影响[J].生态学报, 2017, 37(1):44-53. doi: 10.3969/j.issn.1673-1182.2017.01.009 [26] 高金涛.模拟增温和氮沉降对中亚热带杉木人工林土壤微生物和酶活性的影响[D].福州: 福建师范大学, 2016. [27] 蒋春来, 张晓山, 肖劲松, 等.我国西南地区氮沉降量不同的森林小流域中土壤自然15N丰度的分布特征[J].岩石学报, 2009, 25(5):1291-1296. [28] Watmough S A. An assessment of the relationship between potential chemical indices of nitrogen saturation and nitrogen deposition in hardwood forests in southern Ontario[J]. Environmental Monitoring & Assessment, 2010, 164(1-4):9-20. [29] Tcherkez G, Hodges M. How stable isotopes may help to elucidate primary nitrogen metabolism and its interaction with (photo) respiration in C3 leaves[J]. Journal of Experimental Botany, 2008, 59(7):1685-1693. doi: 10.1093/jxb/erm115 [30] 周咏春, 程希雷, 樊江文.植物氮同位素组成与其影响因子的关系研究进展[J].草地学报, 2012, 20(6):981-989. [31] 肖好燕, 刘宝, 张宁, 等.亚热带地区典型林分氮保留能力的差异及δ15N空间垂直分异特征[J].亚热带资源与环境学报, 2015, 10(3):17-24. doi: 10.3969/j.issn.1673-7105.2015.03.004 [32] Michener R, Lajtha K. Chapter Ⅲ. Natural 15N and 13C abundance as indicators of forest nitrogen status and soil carbon dynamics[M]//Michener R, Lajtha K. Stable Isotopes in Ecology and Environmental Science, Second Edition. Blackwell Publishing Ltd, 2008: 549-556. [33] Aidar M P. Global patterns of foliar nitrogen isotopes and their relationships with climate, mycorrhizal fungi, foliar nutrient concentrations, and nitrogen availability[J]. New Phytologist, 2009, 183(4):980-992. doi: 10.1111/nph.2009.183.issue-4 [34] Kwak J H, Lim S S, Lee K S, et al. Temperature and air pollution affected tree ring δ13C and water-use efficiency of pine and oak trees under rising CO2, in a humid temperate forest[J]. Chemical Geology, 2016, 420:127-138. doi: 10.1016/j.chemgeo.2015.11.015 [35] Knight J D, Livingston N J, Kessel C V. Carbon isotope discrimination and water-use efficiency of six crops grown under wet and dryland conditions[J]. Plant Cell & Environment, 1994, 17(2):173-179. [36] 苏培玺, 严巧娣.内陆黑河流域植物稳定碳同位素变化及其指示意义[J].生态学报, 2008, 28(4):1616-1624. doi: 10.3321/j.issn:1000-0933.2008.04.032 [37] 刘莹, 李鹏, 沈冰, 等.采用稳定碳同位素法分析白羊草在不同干旱胁迫下的水分利用效率[J].生态学报, 2017, 37(9):3055-3064. [38] 喻方圆, 徐锡增, Robert D G.水分和热胁迫处理对4种针叶树苗木气体交换和水分利用效率的影响[J].林业科学, 2004, 40(2):38-44. doi: 10.3321/j.issn:1001-7488.2004.02.007 [39] 丁明明, 苏晓华, 黄秦军.欧洲黑杨基因资源稳定碳同位素组成特征[J].林业科学研究, 2006, 19(3):272-276. doi: 10.3321/j.issn:1001-1498.2006.03.002 [40] Cowan I R, Raven J A, Hartung W, et al. A possible role for abscisic acid in coupling stomatal conductance and photosynthetic carbon metabolism in leaves[J]. Functional Plant Biology, 1982, 9(9):489-498. [41] 褚广继.植物水分利用效率及其与植物内源激素关系的研究进展[J].畜牧与饲料科学, 2015(5):71-72. doi: 10.3969/j.issn.1672-5190.2015.05.026 [42] Saurer M, Siegenthaler U, Schweingruber F. The climate-carbon isotope relationship in tree rings and the significance of site conditions[J]. Tellus, 2010, 47(3):320-330. [43] Guo J F, Yang Y S, Chen G S, et al. Dissolved organic carbon and nitrogen in precipitation, throughfall and stemflow from Cunninghamia lanceolata plantations in subtropical China[J]. Journal of Forestry Research, 2005, 16(1):19-22. doi: 10.1007/BF02856847 [44] Zhu S D, Liu H, Xu Q Y, et al. Are leaves more vulnerable to cavitation than branches?[J]. Functional Ecology, 2016, 30(11):1740-1744. doi: 10.1111/fec.2016.30.issue-11 [45] 石福孙, 吴宁, 罗鹏.川西北亚高山草甸植物群落结构及生物量对温度升高的响应[J].生态学报, 2008, 28(11):5286-5293. doi: 10.3321/j.issn:1000-0933.2008.11.010 [46] 熊鑫, 张慧玲, 吴建平, 等.鼎湖山森林演替序列植物-土壤碳氮同位素特征[J].植物生态学报, 2016, 40(6):533-542. -





 下载:
下载: