-
美国白蛾(Hyphantria cunea Drury)属鳞翅目灯蛾科,是世界性检疫害虫,我国将其与松材线虫病一起列为一级林业有害生物[1]。国家林业局2017年第2号文件公告,在我国,美国白蛾疫区达11个省(区、市)的558个县级行政区。美国白蛾核型多角体病毒(HycuNPV)对美国白蛾有专一致死性和较好的防治效果[2-5]。我国利用该病毒进行防治工作,已由人工喷施为主推广为大范围、大面积的飞机喷施,并取得了很好的防效[6]。美国、南斯拉夫、原捷克斯洛伐克、保加利亚、原苏联、日本和朝鲜等欧美和亚洲国家也曾利用HycuNPV防治美国白蛾,证明HycuNPV对美国白蛾幼虫具有较高的感染率,并可持续控制美国白蛾的虫口密度,具有不污染环境、对人畜和其它非靶标生物安全的优点[7-11]。可见,HycuNPV是有效防控美国白蛾为害与蔓延的最佳生物药剂之一[9]。
随着分子生物学的发展,杆状病毒基因组序列测定及其功能基因研究进入了活跃时期。Ikeda等完成HycuNPV全基因组序列测定,并与已测序的杆状病毒基因组比较分析后发现,该病毒中有些基因非常保守,而这类基因对病毒的增殖起着重要的作用[12]。为了研究这类基因,作者通过分子生物学技术对杆状病毒的这些基因进行改造、修饰或替换,构建重组型的杆状病毒,从而扩大宿主范围或提高杀虫效率[13-17];还可以通过构建原核表达载体,使这些基因成功地在大肠杆菌中表达,以此验证其蛋白的功能[18-20]。本研究根据Ikdea对HycuNPV全基因组序列的分析,筛选出了功能还未被研究的、保守性高的ORF72基因(ORF72属于GIY-YIG核酸内切酶家族,推测其与病毒DNA的复制有关[21])。利用基因重组技术将目标基因转移到带有GST标签的原核表达载体pGEX-4T-1上,以异丙基-β-D-硫代半乳糖苷(IPTG)为诱导剂,当加入IPTG后, tac被诱导, tac启动子后面的GST标签和连接在GST后面的插入基因就能够表达出来[21]。pGEX-4T-1-ORF72融合蛋白的成功诱导表达、条件的优化及蛋白的分离纯化,为今后ORF72基因功能的研究奠定基础。
-
美国白蛾核型多角体病毒(HycuNPV)由中国林业科学研究院昆虫病毒研发中心保存。大肠杆菌DH5α感受态细胞,表达菌株BL21(DE3)感受态细胞、Rosetta(DE3)感受态细胞均购自天根公司,原核表达载体pGEX-4T-1购自GE Healthcare公司。
-
实验过程中所用引物由金维智生物科技有限公司合成,琼脂糖凝胶DNA回收试剂盒(DP209-03)及质粒小提试剂盒(DP103-02)购自天根公司;限制性内切酶EcoR I、Xho I和T4 DNA连接酶均购自TaKaRa公司。
LB固体培养基(1 L):在950 mL去离子水中加入胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g、琼脂粉15 g、去离子水定容至1 L。
2×SDS上样缓冲液:10% SDS 4 mL,甘油2 mL,β-巯基乙醇1 mL,1 mol·L-1Tris-HCl(pH6.8)1 mL,溴酚蓝20 mg,双蒸水2 mL。
缓冲液A:50 mmol·L-1Tris, 0.2 mol·L-1氯化钠,2 mmol·L-1二硫苏糖醇(DTT),pH8.0。
缓冲液B:50 mmol·L-1Tris, 0.2 mol·L-1氯化钠,2 mmol·L-1 DTT,20 mmol·L-1还原型谷胱甘肽,pH8.0。
-
PTC-200 PCR仪、SiGMA 3k15高速离心机、NANODROP 2000紫外分光光度计、DYY-10C型电泳槽和电泳仪(北京六一仪器厂)、YLN-Ⅲ超强紫外透射仪、G:BOX SYNGENE凝胶成像系统仪、TS-1脱色摇床、NGC Quest 10蛋白纯化系统仪等。
-
按照Murillo等人的方法[23],提取美国白蛾核型多角体病毒总DNA,并以其基因组DNA为模板,根据GenBank数据库提供的HycuNPV ORF72序列(NC_007767.1)设计两端分别含有EcoR I和Xho I酶切位点的引物,引物序列见表 1。
表 1 引物序列
Table 1. The primer sequences
引物 序列 酶切位点 pGEX-4T-1-72-F ACCAGAATTCATGAG TTTGTATCGAAACA EcoR I pGEX-4T-1-72-R AAACCTCGAGTCGCA GCGGCTTGTCGG Xho I PCR反应条件为95℃下预变性处理5 min,然后95℃变性30 s,65℃退火45 s,72℃延伸1 min,33个循环,最后72℃终延伸处理10 min。PCR反应体系见表 2。得到的PCR扩增产物经1.0%琼脂糖凝胶电泳检测。检测正确后切胶回收纯化,回收产物经限制性内切酶EcoR I和Xho I在37℃条件下,双酶切处理3 h,双酶切体系见表 3,酶切完成后1.0%琼脂糖凝胶电泳检测,检测正确后按照琼脂糖凝胶DNA回收试剂盒的使用说明切胶回收待用。同时,将pGEX-4T-1载体质粒利用热击化法转入大肠杆菌DH5α感受态细胞中,涂布到含氨苄青霉素(amp,20 mg·mL-1)抗性的LB固体培养基上37℃过夜培养,挑斑,摇菌,按照质粒小提试剂盒的使用说明提取质粒,同上进行双酶切[23],酶切后经1.0%琼脂糖凝胶电泳检测,检测正确后按照琼脂糖凝胶DNA回收试剂盒的使用说明切胶回收待用。
表 2 PCR反应体系
Table 2. The reaction system of PCR
组成 体积/μL ddH2O 22 HycuNPV DNA(243.2 ng·μL-1) 1 pGEX-4T-1-72-F(20 μmol·L-1) 1 pGEX-4T-1-72-R(20 μmol·L-1) 1 2×Taq MasterMix 25 Total Volume 50 表 3 双酶切反应体系
Table 3. Double restriction-enzyme digestion
组成 体积/μL ddH2O 11 10× H Buffer 2 DNA回收片段(272.6 ng·μL-1) 5 EcoR I(15 U·μL-1) 1 Xho I(15 U·μL-1) 1 Total Volume 20 -
将1.2.1中酶切纯化后的目的基因和载体片段在T4 DNA连接酶作用下4℃过夜连接,连接体系见表 4。连接后将连接液转入大肠杆菌DH5α感受态细胞,37℃下过夜培养,挑选菌落进行PCR鉴定,切取大小正确的条带测序检测。
表 4 T4连接反应体系
Table 4. T4 ligase reaction system
组成 体积/μL ddH2O 4 T4 ligase buffer 1 ORF72(272.6 ng·μL-1) 3 pGEX-4T-1(100 ng·μL-1) 1 T4 ligase(350 U·μL-1) 1 Total Volume 10 -
(1) 菌株的活化:取1 μL重组表达载体pGEX-4T-1-ORF72分别转化于BL21和Rosetta感受态细胞中,37℃过夜培养后,分别挑选2个菌落在含amp(20 mg·mL-1)的LB液体培养基中37℃、200 r·min-1震荡过夜培养。
(2) 菌株的诱导:将活化后的菌液按1.0%比例接入含有amp的LB液体培养基中,于37℃,200 r·min-1条件下培养,3 h后加入IPTG至终浓度分别为0.1、0.2、0.4、0.6、0.8和1.0 mmol·L-1,分别在16、25、30、37℃不同温度条件下诱导培养8 h后取样。
(3) 样品的处理:取不同菌株在不同温度和不同诱导浓度下的样品各1 mL,12 000 r·min-1离心1 min,弃上清,加入0.1 mol·L-1磷酸缓冲液(1×PBS)1 mL重悬菌体沉淀,12 000 r·min-1离心1 min洗涤,弃掉上清液,加入50 μL 1×PBS再次重悬菌体沉淀,再加入等体积2×SDS上样缓冲液,100℃煮沸5 min使蛋白质变性,12 000 r·min-1离心3 min,取上清,12% SDS-PAGE上样检测。
(4) ORF72蛋白诱导表达条件的筛选:①蛋白表达菌株的筛选:在相同IPTG诱导浓度(1.0 mmol·L-1)、相同诱导时间(8 h)、相同诱导温度(25℃)条件下,将重组质粒分别在BL21和Rosetta表达菌株中进行表达,诱导后的蛋白样品进行SDS-PAGE上样分析,通过表达量的多少筛选出最佳的表达菌株。以未诱导的BL21和Rosetta表达菌株为阴性对照。②蛋白表达诱导温度的筛选:选择1.3.1中筛选出的最适表达菌株,然后在1.0 mmol·L-1 IPTG诱导浓度,16、25、30和37℃4种不同诱导温度条件下进行蛋白的诱导表达,8 h后取样品进行SDS-PAGE上样分析,以未诱导的表达菌株为阴性对照。③蛋白表达诱导浓度的筛选:通过1.3.1和1.3.2筛选出最适表达菌株和最适诱导温度,取同等条件下不同诱导浓度(0.1、0.2、0.4、0.6、0.8和1.0 mmol·L-1 IPTG)表达的样品,进行SDS-PAGE上样分析,以未诱导的样品作为阴性对照。④蛋白表达诱导时间的筛选:通过以上条件的筛选,在最适表达菌株、最适诱导温度和最适诱导浓度条件下,分别取诱导4、6、8和12 h后的样品进行SDS-PAGE上样分析。以未诱导的4、6、8和12 h后的样品作为阴性对照。
(5)ORF72蛋白可溶性表达的鉴定:为进一步确定ORF72蛋白为可溶性蛋白还是包涵体蛋白,将在Rosetta表达菌株中诱导表达后的菌体进行超声破碎,而后离心,收集上清和沉淀,分别于50 μL的1×PBS再次重悬菌体,加入等体积2×SDS上样缓冲液,100℃煮沸5 min使蛋白质变性,12 000 r·min-1离心3 min,12% SDS-PAGE上样检测。
-
以Rosetta表达菌株中筛选出的最适蛋白诱导表达条件对ORF72融合蛋白进行大量的诱导表达,取诱导后的蛋白样品50100 mL超声破菌,包涵体在50 mmol·L-1Tris和500 mmol·L-1氯化钠的缓冲液(pH8.0)中洗涤2次,然后在含有8 mol·L-1尿素、20 mmol·L-1DTT和50 mmol·L-1Tris的缓冲液(pH8.0)中变性溶解至30 mL(密封搅拌,4℃条件下溶解过夜),包涵体溶解后,分别在6 mol·L-1尿素、4 mol·L-1尿素、2 mol·L-1尿素和1 mol·L-1尿素中进行分步透析使蛋白复性。复性后利用NGC Quest 10蛋白纯化系统仪在缓冲液A和缓冲液B中进行纯化,通过带有GST标签的亲和层析柱过滤,去除杂质,使其在保持蛋白质生物学活性的同时,将含有ORF72的融合蛋白分离纯化出来。
-
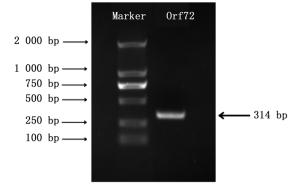
以HycuNPV基因组DNA为模版,经表 1中引物扩增,得到带有双酶切位点的ORF72基因片段,其大小为314 bp(如图 1)。连接转化后,送金维智生物科技有限公司测序,其与GenBank数据库中提供的ORF72基因片段大小一致,且含有双酶切位点。
-
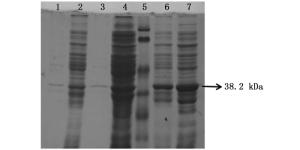
将含有重组质粒的表达菌株BL21(DE3)和Rosetta(DE3)分别用1.0 mmol·L-1的IPTG在25℃条件下进行诱导,8 h后收集诱导菌株。12% SDS-PAGE凝胶电泳鉴定,其结果见图 2。
根据生物信息学分析,推测ORF72蛋白质大小为12.2 kDa,pGEX-4T-1载体上所带GST标签蛋白大小为26 kDa,故推测诱导表达出的融合蛋白大小为38.2 kDa。图 2显示该融合蛋白在BL21和Rosetta表达菌株中均有明显表达,且目的蛋白大小与预测蛋白大小相吻合,而在未经诱导的表达菌株中没有出现明显条带,证明蛋白表达成功。在两种不同菌株中,该蛋白都有明显表达,但在Rosetta表达菌株中的表达量明显比在BL21表达菌株中的表达更为富集,表达量更高。因此,ORF72蛋白的表达菌株选择Rosetta(DE3)更为合适。
-
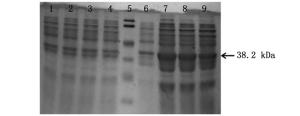
在IPTG浓度为1.0 mmol·L-1,诱导时间为8 h条件下,通过不同温度(16、25、30和37℃)诱导重组质粒在Rosetta(DE3)表达菌株中进行表达,诱导表达后的蛋白样品,经12% SDS-PAGE电泳分析,结果如图 3所示。在16、25、30和37℃下均出现大小约为38.2 kDa的蛋白条带,其大小与推测的融合蛋白大小相符。该蛋白在16℃条件下诱导时蛋白表达量最少,25℃条件下蛋白表达量最多,随着温度的升高,蛋白表达量又呈下降趋势。以此,该融合蛋白在25℃条件下诱导最佳。
-
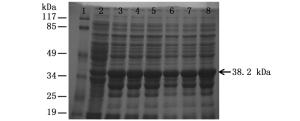
在相同诱导温度(25℃)条件下,IPTG浓度分别为0.1、0.2、0.4、0.6、0.8和1.0 mmol·L-1,在Rosetta(DE3)表达菌株中诱导8 h后,取诱导表达后的蛋白样品,经12% SDS-PAGE电泳鉴定,结果如图 4所示。可以看出,该融合蛋白在25℃和不同IPTG浓度(0.1、0.2、0.4、0.6、0.8和1.0 mmol·L-1)诱导后均出现了明显的目的蛋白条带,其大小约为38.2 kDa,与预测融合蛋白大小一致。在不同IPTG诱导剂浓度下表达量差别不大,但浓度为1.0 mmol·L-1时表达量更高。故选择该蛋白在25℃条件下,IPTG浓度为1.0 mmol·L-1时为最佳诱导浓度。
-
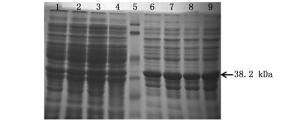
通过以上对诱导条件的筛选,在最适诱导温度25℃,最适IPTG诱导浓度1.0 mmol·L-1条件下,诱导不同时间(4、6、8和12 h)后,重组质粒在Rosetta(DE3)表达菌株中表达的蛋白经12% SDS-PAGE电泳检测,其结果如图 5所示。在25℃、1.0 mmol·L-1 IPTG浓度下诱导4、6、8和12 h均呈现出明显的目标蛋白表达,但在表达量上并没有表现出明显区别。故通过改变诱导时间的长短并不会明显提高融合蛋白的表达产量。
-
超声破碎后收集的菌体上清及菌体沉淀经12 % SDS-PAGE电泳分析结果如图 6。可以看出,在菌体沉淀中有明显的目的蛋白条带,且条带位置与融合蛋白位置相一致,大小为38.2 kDa,而上清中目的条带较浅。因此可以判断ORF72蛋白大多以包涵体蛋白形式存在。
-
在Rosetta菌株中,25℃条件下,IPTG浓度为1.0 mmol·L-1,诱导8 h后取样。样品经变性、复性处理后经NGC Quest 10蛋白纯化系统仪上GST柱分析(柱体积为5 mL),缓冲液B以1 mL·min-1流速洗脱目的蛋白,在12个柱体积处得到单一峰值(图 7)。收集起峰处的样品,经12% SDS-PAGE电泳检测,结果见图 8。
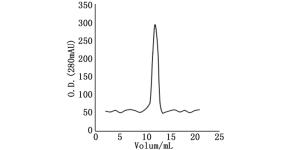
图 7 ORF72融合蛋白的纯化色谱图
Figure 7. ORF72 fusion protein was purified by GST-tag affinity chromatography column
图 8中显示,ORF72融合蛋白在25℃,1.0 mmol·L-1 IPTG浓度,诱导8 h条件下能够大量表达。通过对阴性对照和诱导后蛋白的纯化可以看出,融合蛋白纯化后得到单一目的条带,该蛋白与大量表达后的融合蛋白位置一致,大小均为38.2 kDa,而阴性对照纯化后无条带,即认为该蛋白为分离纯化后的融合蛋白。
-
pGEX-4T-1是一种可以高效表达插入的外源基因的融合蛋白表达载体, 带有tac启动子,具amp抗性, 能够克服转录和转录后水平对外源基因的表达可能造成的不利影响[24]。本研究中ORF72蛋白大小仅为12.2 kDa,而该载体所表达的蛋白产物在N端含有GST序列, 当加入融合标签GST后,重组蛋白的大小增加26 kDa,使蛋白能够正确折叠, 并以融合形式表达,表达的融合蛋白分子量为38.2 kDa。同时,pGEX-4T-1在BL21(DE3)和Rosetta(DE3)表达菌株中都能高效表达,所以本实验选择pGEX-4T-1为表达载体。成功构建原核表达载体后,经IPTG诱导,在BL21和Rosetta菌株中均有明显目的条带,且蛋白大小为38.2 kDa,由此可以证明ORF72蛋白在两种菌株中都得到了高效表达,因其在Rosetta菌株中表达量更高,所以在后续诱导条件的优化中选择Rosetta菌株为表达菌株。而表达效率除了受到所选表达载体[25]以及表达菌株的影响[26],还受其他表达条件的影响,如培养条件和诱导条件等等,所以需要通过改变诱导温度和诱导浓度对蛋白的表达做进一步的优化。首先,选择1.0 mmol·L-1作为诱导浓度,分别在16℃、25℃、30℃和37℃下进行诱导表达,结果表明,ORF72蛋白在16℃诱导时表达量最低,25℃诱导时表达量最高,30℃诱导时表达量又出现下降趋势。由此可以看出,诱导温度对于融合蛋白的表达影响也很大,一般低温培养表达外源蛋白的大肠杆菌,能一定程度上抑制包涵体的形成[27]。在16℃诱导时,也可以延长其诱导表达时间,检测目标蛋白是否能够正确折叠,并以可溶性蛋白的形式存在。在相同温度(25℃)条件下,用不同浓度(0.1、0.2、0.4、0.6、0.8和1.0 mmol·L-1 IPTG)来诱导该蛋白,分析结果发现,随着诱导浓度的增加,蛋白表达量并没有体现出明显的增加或减少,但在浓度为1.0 mmol·L-1时表达量较高。确定菌株、温度、浓度等诱导条件后发现,改变诱导时间的长短并不会明显提高融合蛋白的表达量,说明IPTG浓度过高, 作用时间过长, 并不会提高融合蛋白的产量[28]。
为了进一步纯化该蛋白,在最佳诱导条件下对该蛋白进行大量诱导表达,分析该融合蛋白的存在形式,发现该蛋白以包涵体形式大量存在于沉淀中,而上清中存在的较浅的目的条带,猜想可能是由于上清中混入了少量的沉淀悬浮液所造成。
-
本研究成功构建了pGEX-4T-1-ORF72原核表达载体, 确定出ORF72融合蛋白最佳诱导表达条件。即:在诱导温度为25℃,IPTG浓度为1.0 mmol·L-1,时间为4 h时,该融合蛋白在Rosetta菌株中能够以包涵体的形式大量表达。此外,本研究利用GST亲和层析柱分离纯化出ORF72融合蛋白,为深入研究该蛋白的生物学活性奠定基础。
美国白蛾核型多角体病毒ORF72原核表达载体的构建、表达及纯化
Construction, Expression and Purification of Prokaryotic Expression Vector of Hyphantria cunea Nuclear Polyhedrosis Virus ORF72
-
摘要:
目的 根据Ikdea对HycuNPV全基因组序列的分析,筛选出功能还未被研究的、保守性高的ORF72基因。 方法 将ORF72基因构建到原核表达载体pGEX-4T-1上,对其进行诱导表达,优化表达的条件,并通过GST亲和层析色谱柱纯化融合蛋白。 结果 重组质粒pGEX-4T-1-ORF72的酶切检测以及测序结果均正确,证明重组质粒载体构建成功。通过SDS-PAGE凝胶电泳显示,ORF72蛋白能够与pGEX-4T-1载体上的GST标签蛋白进行融合表达,诱导表达后的融合蛋白大小约为38.2 kDa。优化后的表达条件为:异丙基硫代β-D-半乳糖苷(IPTG)诱导浓度为1.0 mmol·L-1,最佳诱导温度为25℃,最佳诱导时间为4 h,并且该蛋白在大肠杆菌BL21和Rosetta表达菌株中均能很好的表达,但在Rosetta菌株中表达量更高。 结论 成功构建了pGEX-4T-1-ORF72原核表达载体,确定出ORF72融合蛋白最佳诱导表达条件,诱导表达并纯化出ORF72融合蛋白,为进一步研究其生物功能奠定基础。 -
关键词:
- 美国白蛾核型多角体病毒
- / ORF72
- / 载体构建
- / 诱导表达
- / 纯化
Abstract:Objective The ORF72 gene of Hyphantria cunea nuclear polyhedrosis virus belongs to the GIY-YIG endonuclease family, it has a high conservative sequence and is closely related to the viral DNA replication. Method An ORF72 gene was sub-cloned into the pGEX-4T-1 vector. The protein was over-expressed under different induced conditions and purified by GST-tag affinity chromatography column. Result It was proved that the recombinant vector was constructed successfully by the restriction map and DNA sequencing. SDS-PAGE gel electrophoresis detection showed that ORF72 protein could be integrated with GST-tag protein on the pGEX-4T-1 and the size of the expressed fusion protein was about 38.2 kDa. The induced conditions in over-expression of the recombinant proteins were optimized. The major recombinant protein was obtained by a feasible condition at 25℃ with 1.0 mmol·L-1 IPTG for 4 h. Moreover, the recombinant protein was expressed to high levels in the two strains of Escherichia coli BL21 and Rosetta, while the expression in the Rosetta strain was higher than BL21. Conclusion The recombinant ORF72 was purified using GST-affinity chromatography. -
表 1 引物序列
Table 1. The primer sequences
引物 序列 酶切位点 pGEX-4T-1-72-F ACCAGAATTCATGAG TTTGTATCGAAACA EcoR I pGEX-4T-1-72-R AAACCTCGAGTCGCA GCGGCTTGTCGG Xho I 表 2 PCR反应体系
Table 2. The reaction system of PCR
组成 体积/μL ddH2O 22 HycuNPV DNA(243.2 ng·μL-1) 1 pGEX-4T-1-72-F(20 μmol·L-1) 1 pGEX-4T-1-72-R(20 μmol·L-1) 1 2×Taq MasterMix 25 Total Volume 50 表 3 双酶切反应体系
Table 3. Double restriction-enzyme digestion
组成 体积/μL ddH2O 11 10× H Buffer 2 DNA回收片段(272.6 ng·μL-1) 5 EcoR I(15 U·μL-1) 1 Xho I(15 U·μL-1) 1 Total Volume 20 表 4 T4连接反应体系
Table 4. T4 ligase reaction system
组成 体积/μL ddH2O 4 T4 ligase buffer 1 ORF72(272.6 ng·μL-1) 3 pGEX-4T-1(100 ng·μL-1) 1 T4 ligase(350 U·μL-1) 1 Total Volume 10 -
[1] 季荣, 谢宝瑜, 李欣海, 等.外来入侵种——美国白蛾的研究进展[J].昆虫知识, 2003(1):13-18. doi: 10.3969/j.issn.0452-8255.2003.01.004 [2] 李红静, 王西南, 武海卫, 等.应用美国白蛾核型多角体病毒防治美国白蛾效果评价[J].山东林业科技, 2013, 43(2):80-81, 83. doi: 10.3969/j.issn.1002-2724.2013.02.025 [3] 赵海燕, 王艳士, 修玉义, 等.美国白蛾核型多角体病毒林间药效试验[J].中国森林病虫, 2012, 31(1):38-39. doi: 10.3969/j.issn.1671-0886.2012.01.012 [4] 王艳士, 耿以龙, 赵海燕, 等.应用纯病毒制剂防治美国白蛾试验初探[J].山东林业科技, 2010, 40(6):58-59. doi: 10.3969/j.issn.1002-2724.2010.06.021 [5] 樊美珍, 郭超.美国白蛾核型多角体病毒观察初报[J].陕西农业科学, 1986(4):30, 49. [6] 闫家河, 刘芹, 王文亮, 等.美国白蛾发生与防治研究综述[J].山东林业科技, 2015, 45(2):93-106. doi: 10.3969/j.issn.1002-2724.2015.02.027 [7] 刘岱岳, 居蜀生, 张恒德, 等.美国白蛾病毒的繁殖与飞机喷施[J].生物防治通报, 1986(2):74. [8] 段彦丽.美国白蛾NPV与Bt混合致病机理及其对寄主种群持续控制作用[D].北京, 中国林业科学研究院, 2008. [9] 罗辑, 周国英, 朱积余.核型多角体病毒基因组学研究进展[J].林业科学研究, 2014, 27(4):551-556. [10] 张永安, 曲良建, 王玉珠.利用昆虫病毒恢复和构建稳定森林生态系统的理论与实践[J].中国农业科技导报, 2007, 9(5):45-52. doi: 10.3969/j.issn.1008-0864.2007.05.008 [11] 燕长安.美国白蛾NPV大面积应用试验[J].森林病虫通讯, 1987(2):8-10. [12] Ikeda M, Shikata M, Shirata N, et al. Gene organization and complete sequence of the Hyphantria cunea nucleopolyhedrovirus genome[J]. Journal of General Virology, 2006, 87(9):2549-2562. doi: 10.1099/vir.0.81930-0 [13] 陈莉, 李长友, 郑桂玲, 等.昆虫杆状病毒表达载体系统的研究进展[J].东北农业大学学报, 2006, 37(5):679-683. doi: 10.3969/j.issn.1005-9369.2006.05.022 [14] Xu Y P, Gu L Z, Lou Y H, et al. A baculovirus isolated from wild silkworm encompasses the host ranges of Bombyx mori nucleopolyhedrosis virus and Autographa californica multiple nucleopolyhedrovirus in cultured cells[J]. Journal of General Virology, 2012, 93(11):2480-2489. [15] Mikhailov V S, Okano K, Rohrmann G F.Specificity of the Endonuclease Activity of the Baculovirus Alkaline Nuclease for Single-stranded DNA[J].J Biol Chem, 2004, 279(15):14734-14745. doi: 10.1074/jbc.M311658200 [16] 兰丽盼, 吴小锋.昆虫杆状病毒研究和应用新进展[J].农业生物技术学报, 2008, 16(6):1056-1060. doi: 10.3969/j.issn.1674-7968.2008.06.025 [17] 刘永平, 王方海, 苏志坚, 等.昆虫杆状病毒表达载体系统的研究及应用[J].昆虫知识, 2006, 43(1):1-5. doi: 10.3969/j.issn.0452-8255.2006.01.001 [18] Chang J H, Choi J Y, Jin B R, et al. An improved baculovirus insecticide producing occlusion bodies that contain Bacillus thuringiensis insect toxin[J]. J Invertebr Pathol, 2003, 84(1):30-37. doi: 10.1016/S0022-2011(03)00121-6 [19] Hughes P R, Wood H A, Breen J P, et al. Enhanced bioactivity of recombinant baculoviruses expressing insect-specific spider toxins in lepidopteran crop pests[J]. J Invertebr Pathol, 1997, 69(2):112-118. doi: 10.1006/jipa.1996.4643 [20] 谢伟民.拟南芥IAA1的原核表达载体构建及蛋白质表达与纯化[D].长沙: 湖南农业大学, 2015. [21] 唐琦.可用作生物杀虫剂的家蚕核型多角体病毒orf65、orf91的基因功能分析[D].镇江: 江苏大学, 2013. [22] 杨苗苗.思茅松毛虫核型多角体病毒及全基因组分析[D].杨凌: 西北农林科技大学, 2012. [23] Murillo R, Muǹoz D, Lipa J J, et al. Biochemical characterization of three nuclepolyhedrovirus isolates of Spodoptera exigua and Mamestra brassicae[J]. Journal of Applied Entomology, 2001, 125:267-270. doi: 10.1046/j.1439-0418.2001.00533.x [24] 朱靖, 周颖, 王青元, 等. GRIM-19原核表达载体的构建及GST-GRIM-19的诱导表达与纯化[J].安徽医科大学学报, 2011, 46(5):493-496. doi: 10.3969/j.issn.1000-1492.2011.05.027 [25] Liang R, Liu J, Liu X, et.al.A T7-expression system under temperature control could create temperature-sensitive phenotype of target gene in Escherichia coli[J]. Microbiological Methods, 2007, 68(3):497-506. doi: 10.1016/j.mimet.2006.10.016 [26] 江伟华, 刘益丽, 江明锋.大肠杆菌外源蛋白表达载体稳定性的研究进展[J].生物技术通报, 2015, 31(5):25-31. [27] Derbyshire V, Astatke M, Joyce C M. Re engineering the polymerase domain of K lenow fragment and evaluation of overproduction and purification strategies[J]. Nucleic Acids Res, 1993, 21(23):5439-5448. doi: 10.1093/nar/21.23.5439 [28] Yu J, Zhang L. The transcriptional targets of p53 in apoptosis control[J]. Biochem Biophys ResCommo, 2005, 331(3):851-858. doi: 10.1016/j.bbrc.2005.03.189 -




 下载:
下载: