-
南酸枣(Choerospondias axillaris (Roxb.) B. L. Burtt & A. W. Hill)系无患子目(Sapindales)、漆树科(Anacardiaceae)、南酸枣属(Choerospondias)植物,该属仅有原变种南酸枣和变种毛脉南酸枣(C. axillaris var. pubinervis)两个种或变种[1]。南酸枣为落叶乔木,雌雄异株;3—4月开花,5月坐果,种子常具5个萌发孔[1],分布于江西、福建、湖南、浙江、四川、贵州、广东、广西、云南等地[2]。南酸枣是我国重要的果材两用型经济树种,果实既可食用又可入药,材质好、抗性强,果实的可食率约为60%,总黄酮含量可达34 mg·g−1 [3],果皮中有机酸含量达8.13%,富含18种氨基酸[4],果皮中酚类物质和黄酮类物质含量高于果肉[5];果肉可制成各类风味食品,营养价值高[6];果实中的甲醇提取物具抗炎作用,可减轻类风湿关节炎性炎症[7];果核可作活性炭原料,树皮可用作鞣革和单宁提取物的原料[8],开发和研究价值巨大。
漆树科植物的利用价值高,开发前景较大,漆树科下的腰果(Anacardium occidentale Linn.)、阿月浑子(Pistacia vera Linn.)、扁桃(Mangifera persiciforma C. Y. Wu & T. L. Ming)、杧果(Mangifera indica Linn.)及南酸枣等树种的果实均可食用,具有较高的经济价值[9]。然而,对漆树科各树种生殖发育特性的研究还不够深入,研究多集中在果树的花果特性、花粉培养等[10]。目前,对南酸枣的研究主要集中在无性繁殖[11]、群落生态学[12]、药用价值[7]等方面,但与南酸枣繁殖和育种密切相关的大小孢子发生及雌雄配子体发育过程仍不清楚。
果树雌雄配子的发育过程是果树繁殖的重要生理阶段,揭示雌雄配子发育过程和方式,可为经济林果树的优良品种选育、高效增产栽培技术等提供重要的生殖生物学基础。已有研究证实,不同品种枣(Ziziphus jujuba Mill.)的花粉质量差别较大,枣去雄困难,选育出的无花粉品种‘Zaocuiwang’的小孢子在四分体阶段发生败育,是一个十分理想的雄性不育种质[13]。梨(Pyrus ussuriensis Maxim)人工授粉的成功率与花粉状态、人工授粉时间紧密相关[14]。低温会减缓杧果小孢子母细胞减数分裂过程从而影响花粉的正常发育[10]。软枣猕猴桃(Actindia arguta Planch.)的小孢子处于单核晚期时,花药愈伤组织诱导率高于其他时期[15],切片观察可以为花粉培养提供较精准的数据资料,为育种工作提供帮助。黄连木(Pistacia chinensis Bunge)、阿月浑子[16-17]中出现的胚珠退化现象可能是造成其结实率低的原因。漆树(Toxicodendron vernicifluum (Stokes) F.A.Barkl)具有败育花粉会导致授粉受精不良[18]对南酸枣开花结实及其雌雄配子发育机理的研究是开展育种工作的重要基础。本研究利用常规石蜡切片技术[19]探究南酸枣的大小孢子和雌雄配子体的发育过程,揭示南酸枣雌雄配子的发育特性,观察雌雄蕊败育发生的情况,丰富南酸枣的生殖生物学理论,并为进一步开展品种选育提供理论指导。
-
试验材料栽培在江西省南昌市江西农业大学南酸枣实验基地内。基地位于江西省中北部, 115°27' E~116°35' E、28°10' N~29°11' N之间,海拔为49.5 m,属亚热带湿润季风气候。供试材料为2012年嫁接、长势良好、处于盛年期的南酸枣。
-
南酸枣雌雄异株,雄花芽先于雌花芽萌发。选择雌、雄株各3株,于2021年3月10日至4月15日采集雄花,3月20日至4月25日采集雌花,每隔3 d采一次。一部分鲜样置于日产SMZ1270i显微镜下观察,一部分鲜样立即投入50%的FAA固定液中固定24 h。材料固定后经乙醇各梯度溶液逐级脱水,后经二甲苯透明,浸蜡6 h以上;采用德国SLEE半自动石蜡切片机切片;番红单染或番红固绿对染,番红染色16 h以上,固绿染色30 s,95%酒精洗固绿60 s,树胶封片[19]。每时期制作石蜡切片20片,在日产尼康ECLIPSE Ci-L显微镜下观察,并用NIS-Elements软件进行拍照,Photoshop CC进行图片整理。
-
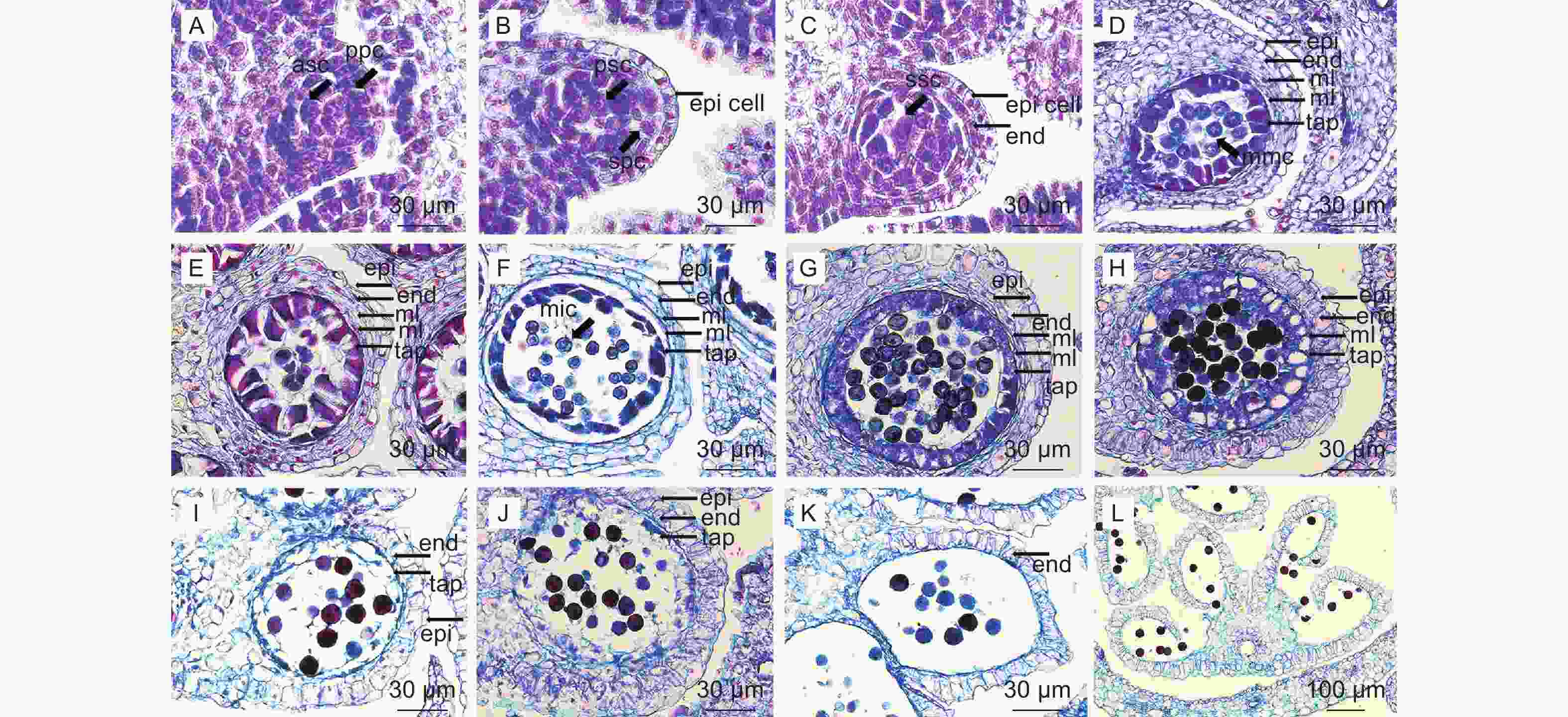
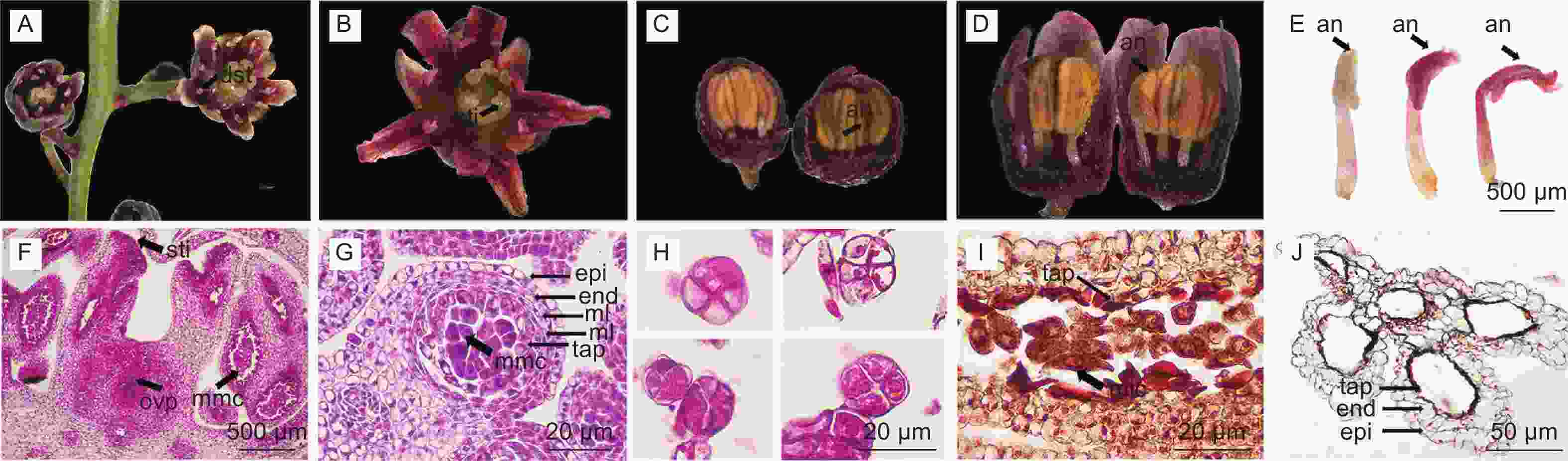
观察发现,南酸枣每花具雄蕊10~12枚,花药具4个蝶型小孢子囊(图1,L)。孢原细胞平周分裂产生初生周缘细胞(图1,A),初生周缘细胞分裂形成2层次生周缘细胞(图1,B-C),由外至内分化形成1层药室内壁、2层中层及1层绒毡层,即成熟花药壁结构(图1,D),花药壁形成方式属基本型[20]。表皮细胞初期排列整齐(图1,B-D),二细胞花粉期表皮细胞波状不规则排列(图1,H),之后逐渐萎缩退化,花粉成熟时消失(图1,I-L)。中层细胞具2层结构,小孢子单核靠边期向内一层消失(图1,H),向内一层被挤压(图1,I-J),成熟花粉期中层消失(图1,K-L)。小孢子发育期药室内壁细胞体积增大(纵向增大)(图1,G-H),后期细胞壁发生带状加厚(图1,J-L),成熟花药的花药壁剩下纤维层(药室内壁),花粉成熟后药室内壁无带状加厚的外切向壁破裂释放花粉粒(图1,L)。绒毡层在小孢子母细胞期质浓、碎裂式多核的情况与漆树[18]类似(图1,D)。小孢子四分体期,绒毡层细胞可见明显细胞壁(图1,E)。四分体释放小孢子后绒毡层处于皱缩的状态,多核,胞质浓(图1,F-G),小孢子单核靠边期至二细胞花粉期的绒毡层细胞逐渐囊泡化,绒毡层细胞具大液泡,绒毡层内切向壁开始溶解(图1,H)。生殖细胞分裂时,绒毡层细胞胞质逐渐释放到药室中(图1,I-J)。花粉成熟时,绒毡层细胞胞质完全释放,外切向壁溶解消失,最后绒毡层完全溶解(图1,K-L),小孢子发育阶段对应着花药壁发育阶段(详见表1)。
雄配子发育阶段
The development stage of male gamete花药壁发育情况
The development of anther wall孢原细胞期
Archesporial cell stage1层表皮细胞期
1 epidermis layer stage小孢子母细胞期
Microspore mother cell stage5层花药壁完整结构
5 layers of anther wall单核花粉期
Mononuclear pollen stage中层开始分解
The middle layers begin to disintegrate二细胞花粉期
Bicellular pollen stage表皮细胞波状不规则排列、药室内壁细胞囊泡化、绒毡层内切向壁溶解
The epidermal cells were irregularly arranged in waves, the endothecium
cells have vesicles, and the tangential wall of the tapetum was dissolved成熟花粉期
Mature pollen stage表皮、中层消失;纤维层存留,绒毡层逐渐解体直至消失
The epidermis, tapetum and middle layer disappeared; The fibrous layer remainedTable 1. The development of anther wall at different stages of male gamete development
-
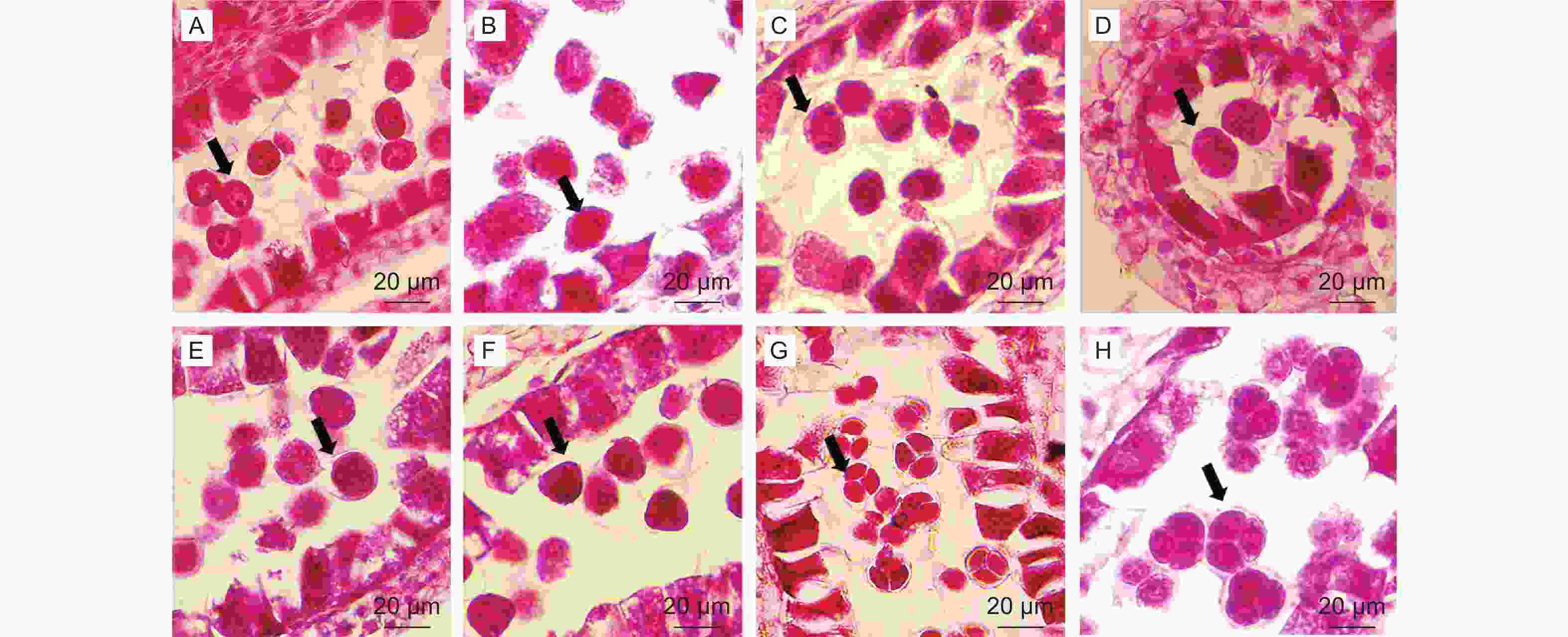
小孢子囊中央的造孢细胞(孢原细胞)平周分裂产生初生造孢细胞(图1,A-B),再经分裂形成小孢子母细胞(图1,C-D)。小孢子母细胞核大,细胞器多、分布密集,细胞结构正常(图2,A)。每个小孢子母细胞经过减数分裂形成四分体,这四个单倍体细胞释放后就是小孢子,小孢子继续发育成为雄配子体。小孢子母细胞开始减数分裂,纺锤丝将一对同源染色体拉向两极(图2,B),二分体移至两极后,不形成细胞板(图2,C);核膜重建后,形成两个子细胞,至此完成第一次分裂,形成一个双核细胞(图2,D)。两个核同时进行第二次分裂(图2,E-F),分裂完成后四个核之间产生壁,同时分隔成四个细胞,在切面上表现为等边三角形排列状,四个细胞被胼胝质包围,形成四面体型四分体(图2,G-H)。最后胼胝质壁溶解,小孢子最后从四分体中被释放 (图3,A)。
-
小孢子从四分体释放后(图3,A),体积增大,此时细胞核大且位于细胞中央(图3,B)。随后,细胞质液泡化,形成中央大液泡并将细胞核挤向一边(即雄配子体发育的单核靠边期)(图3,C),同一花药内小孢子分裂并不一致(图3,D-F)。单核靠边期小孢子经过一次不均等的胞质分裂和有丝分裂,形成了透镜型的生殖细胞和圆形的营养细胞(图3,D-E),此时,两个细胞的核明显,营养细胞体积更大。生殖细胞逐渐与壁脱离游离在营养细胞中,此时胞质少(图3,F)。营养细胞靠近萌发孔,生殖细胞在远离萌发孔的一端(图3,G)。成熟花粉可见3个萌发孔,细胞壁厚,胞质浓(图3,G-H)。
-
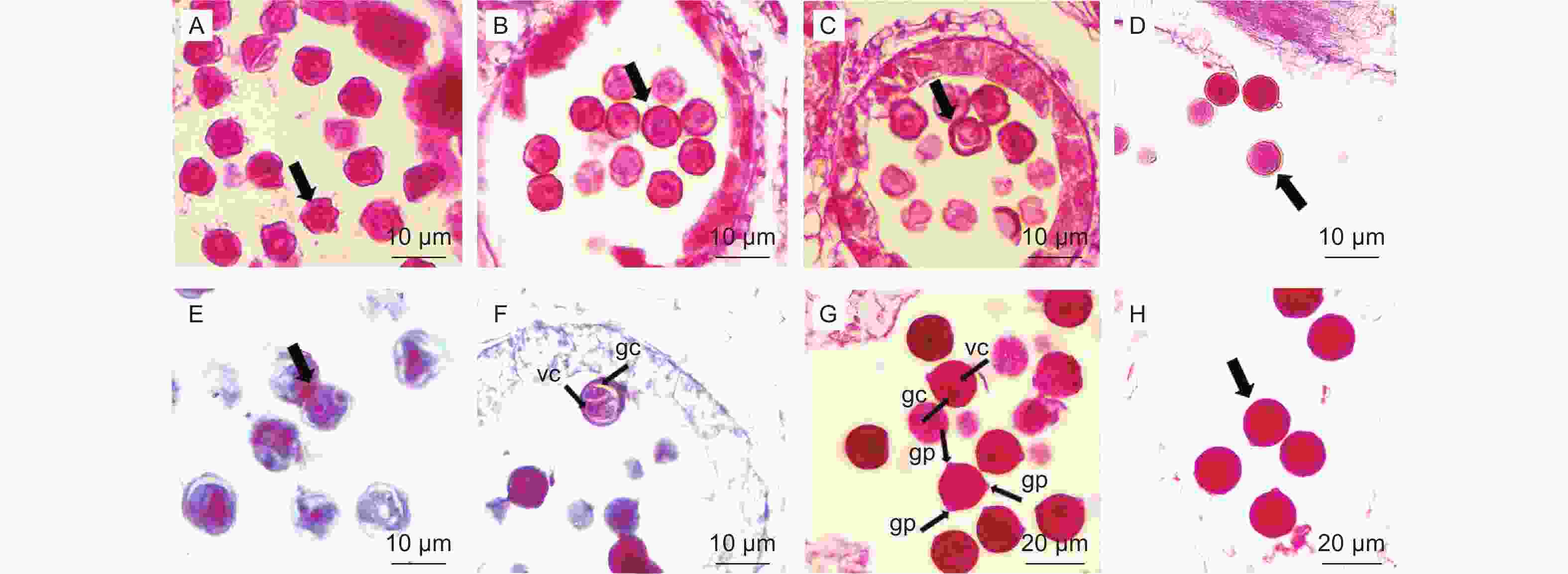
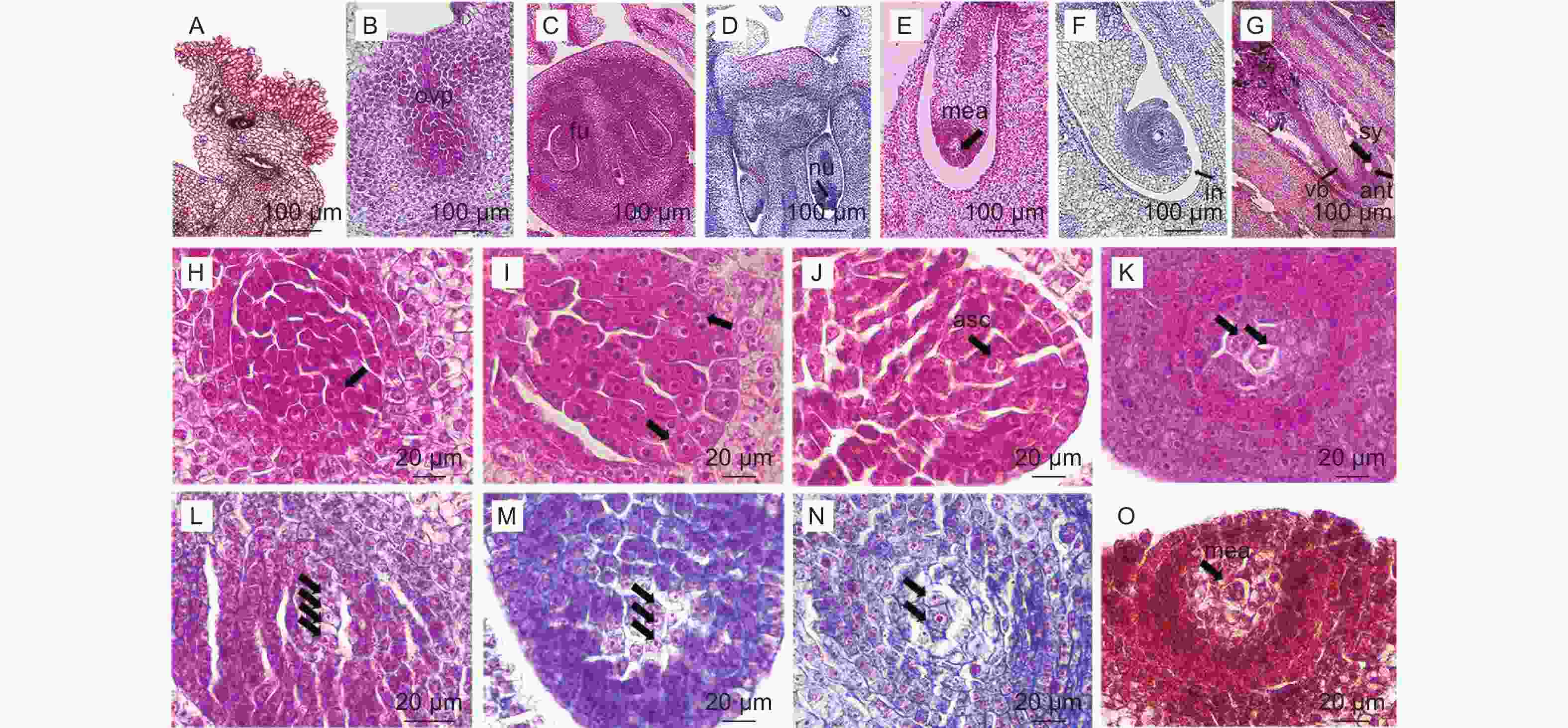
南酸枣子房多5室,柱头具乳突(图4,A),每室一个胚珠,各自独立发育,发育不同步(图4,C)。子房壁内表皮下的细胞进行平周分裂产生胚珠原基(图4,B),胚珠原基的底部发育成为珠心,与胎座着生的位置成为珠柄(图4,C-D)。南酸枣胚珠具两层珠被,分别为内珠被和外珠被。外珠被生成后,细胞大,略为方形,排列有序,开始平周分裂和垂周分裂(图版4,I)。珠心深处珠孔端逐渐分化出孢原细胞(图4,H-J),孢原细胞发育,经平周分裂产生一个周缘细胞和一个造孢细胞(图4,K)。造孢细胞分裂两次形成排列为线形大孢子四分体(图4,L),近珠孔端的3个周缘细胞逐渐退化消失(图4,M-N),剩下的合点端的一个孢原细胞行使大孢子母细胞的功能,继续发育形成单核胚囊(图4,O)。
-
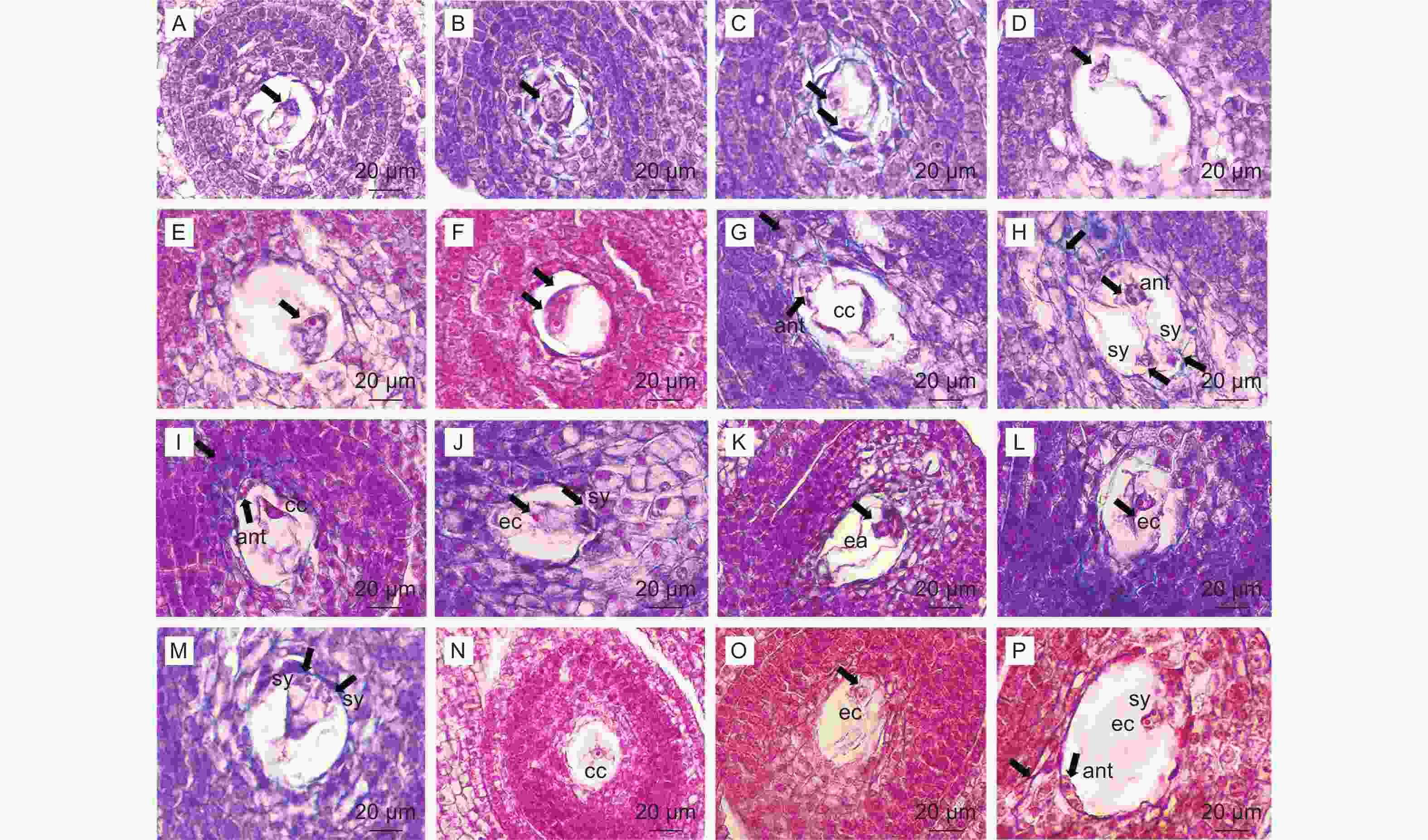
大孢子第一次分裂形成的两个核分别向合点端和珠孔端移动建立极性(图5,A-E),两端的核继续分裂一次形成4核胚囊(图5,F),再经过第三次分裂形成8核胚囊,珠孔端的3个核组成卵器,卵器包括一个卵细胞,内含2个助细胞核(图5,H-M),另一个核成为上极核。合点端的3个核形成反足细胞,呈品字形排列(图5,G-I),1个核成为下极核;下极核移至上极核旁边一起组成具有双核的中央细胞(图5,I),即次生核(带2个细胞核的极核),胚珠开始发生倒转(图5,J)。至此,形成7细胞8核的成熟胚囊(图5,N-P),故南酸枣胚囊发育模式为蓼型。
-
雌花的退化雄蕊短且空囊,花丝长于花药,花药逐渐萎缩(图6,E),短于雌蕊(图6,A-B);雄花的正常雄蕊饱满呈橙黄色(图6,C-D)。雌花胚珠原基出现时,雄蕊开始发育(图6,F),小孢子母细胞多可发育为左右对称型四分体(图6,H);小孢子发育不良(图6,I),最后花药空囊(图6,J)。大孢子母细胞期绒毡层多核,具1层表皮、1层药室内壁、2层中层、1层绒毡层,大孢子母细胞核大,表现正常(图6,G);从四分体释放的小孢子核明显且居中,绒毡层开始溶解,小孢子开始溶解(图6,I);小孢子退化后,表皮逐渐退化波浪状排列,药室内壁的细胞壁发生纤维状加厚,绒毡层最后只见残留痕迹(图6,J)。花药空囊,雄蕊败育(图6,J)。
-
南酸枣为单性花,聚伞圆锥花序[1],和漆树科的阿月浑子类似,雄蕊发育较雌蕊早 [17]。2021年的3月10日左右雌雄花芽开始萌发,南酸枣雄花进入花粉成熟期时,雌花的胚囊还处于二核胚囊期至四核胚囊期,花序上的花多处于不同的发育状态。由表2可知,南酸枣雄花从现蕾到散粉约28 d时间,雌花从现蕾到胚囊成熟约35 d时间,雄花纵长大于3.0 mm时,花药成熟,子房纵长达3.5 mm时,胚囊成熟。南酸枣雌、雄蕊发育与外部形态的相关性具体内容见表2。
时间
time雄花形态特征
Morphological features of male flower雌花形态特征
Morphological features of
female flower雄蕊发育阶段
Developmental
stage of stamen雌蕊发育阶段
Developmental
stage of pistil退化雄蕊发育阶段
Developmental stage of degenerated stamen3/10—3/12 颜色嫩绿,花圆球形,纵长约0.5~0.8 mm 颜色嫩绿,圆球形,苞片包被,横长0.5~1.0 mm 孢原细胞分裂 柱头雏形形成 孢原细胞分裂 3/13—3/15 颜色略带紫红,圆球形,纵长约0.8~1.0 mm 颜色嫩绿,圆球形,苞片展开,横长约1.0~1.5 mm 小孢子母细胞 胚珠原基初期 小孢子母细胞 3/16—3/18 颜色紫红色,圆球形,纵长约1.0~1.5 mm 颜色紫红,圆球形,苞片脱落,横长约1.5~2.0 mm 小孢子母细胞减数分裂 胚珠原基发育期 小孢子母细胞减数分裂 3/19—3/20 颜色紫红色,圆球形,纵长约1.5~2.0 mm 颜色紫红,圆球形,柱头露出,横长约2.0~2.5 mm 小孢子四分体时期 珠被开始生长 四分体时期 3/21—3/23 花序伸长,颜色紫红色,纵长约2.0-2.5 mm 紫紫红色,顶部花始开,子房纵长约1.0~1.5 mm 单核小孢子居中期 大孢子母细胞形成 单核小孢子期 3/24—3/27 侧花序伸长,颜色紫红色,椭球形,纵长约2.5-3.0 mm 花序伸长,中下部花始开,子房纵长约1.5~2.0 mm 单核小孢子靠边期 四分体时期 小孢子退化 3/28—4/1 花序伸长,颜色紫红色,纵长约2.0~2.5 mm 紫红色,顶部花始开,子房纵长约1.0~1.5 mm 单核小孢子居中期 大孢子母细胞形成 单核小孢子期 4/2—4/3 侧花序伸长,颜色紫红色,椭球形,纵长约2.5~3.0 mm 花序伸长,中下部花始开,子房纵长约1.5~2.0 mm 单核小孢子靠边期 四分体时期 小孢子退化 4/4—4/5 花药露出呈橙黄色,椭球形,纵长约3.0~3.5 m 花瓣外卷,花盛开,子房纵长约2.0~2.5 mm 2–细胞花粉发育期 单核胚囊 — 4/6—4/7 花开放,花瓣外卷,开始
散粉柱头略具粘液,子房纵长约2.5~3.0 mm 成熟2–细胞花粉 二核胚囊 — 4/8—4/9 小花全部开放,散粉盛期 柱头具少量粘液,子房纵长约3.0-3.5 mm — 四核胚囊 — 4/10—4/11 大部分花已落,花粉散尽 柱头具大量粘液,子房纵长约3.0~4.0 mm — 八核成熟胚囊 — Table 2. The relationship between the development stage of pistil and stamen and external morphology of Choerospondias axillaris
-
漆树科中的漆树[18]、黄连木[16]及阿月浑子[17] 均具有厚珠心、倒转胚珠、大孢子四分体直线型排列、胚囊蓼型发育、同时型胞质分裂、腺质型绒毡层、2-细胞花粉等特征,腰果(Anacardium occidentale Linn.)[21]和杧果[10]都具双核花粉,南酸枣雌雄配子发育模式与上述漆树科多数种特征相同。
漆树成熟胚囊具有承珠盘结构,合点端的承珠盘具喇叭状结构连接胚囊中的维管束[18]。在观察南酸枣胚囊发育的过程中,在八核胚囊期可观察到反足细胞端有一群体积较大、条形喇叭状的不规则细胞(图5H),且细胞壁被固绿染色较深(图5,I、L),细胞壁厚,胚囊成熟时,可以观察到合点端至胚囊底部有一群明显的细胞群相连,其中分布着维管束(图4,G;图5,P),因此,认为南酸枣也具有和漆树类似的承珠盘结构,起物质运输的作用。南酸枣在小孢子单核靠边期绒毡层相对完整(图1,G),二细胞花粉发育初期绒毡层始见壁溶解(图1,H),黄连木、阿月浑子、漆树的正常花药绒毡层大多在小孢子母细胞减数分裂期开始解体[16-18],这与南酸枣有所不同。
-
南酸枣雌雄异株,雄花未见结实现象的研究报道,而雌花的退化雄蕊无花粉粒,故将南酸枣的花称作“单性花”。雄花只有雄蕊,雄蕊发育正常,但雌蕊原基可能很早就已退化,而雌花具无花粉的退化雄蕊。南酸枣中未见胚珠退化现象,是否存在胚珠退化还有待进一步观察。大部分植物雄蕊退化发生在小孢子四分体时期前后[18],如柿子(Diospyros kaki Thunberg)单性花的形成很可能与细胞程序性死亡有关,采用TUNEL(TdT-mediated dUTP Nick-End Labeling)染色法可观察到有大量细胞在雄蕊原基退化时期死亡,可预以佐证[22]。漆树[18]、黄连木[16]及南酸枣的绒毡层不正常溶解,从而导致雄蕊发育异常,这可能与基因调控下程序性死亡的发生有关。南酸枣正常雄蕊小孢子四分体和退化雄蕊小孢子四分体类型不同,前者为四面体形,后者为左右对称形;漆树[18]和黄连木[16]中存在少量的左右对称型四分体,但是都出现在雄花中且表现正常。南酸枣退化雄蕊中具核大、细胞器多的正常小孢子母细胞(图6F-G),四分体期开始才发育异常(图6H-I),而漆树的退化雄蕊中小孢子母细胞期开始发育异常[18],两者存在差异。胞质分裂的形式常常在同一类植物中是固定的[20],两种胞质分裂形式与细胞板的形成机制相关,胞质分裂异常会导致花粉败育[23],南酸枣退化雄蕊出现连续型胞质分裂,即左右对称型小孢子四分体的情况,因此,推测南酸枣退化雄蕊花粉败育除了和绒毡层提前溶解有关之外,还与胞质分裂过程中细胞板的形成异常有关。
-
综上所述,南酸枣雌雄配子的发育与漆树科胚胎学的特征基本一致;退化雄蕊中的小孢子四分体发育异常,小孢子溶解,花药空囊,从而导致雌花的雄蕊无育性,雄花中无雌蕊,这可能是因为雌蕊原基的退化或缺失,该问题还有待进一步观察。本文在研究中发现,南酸枣同一子房内存在胚囊发育不同步的情况,由此会影响果实的发育进程。关于南酸枣胚珠的生长发育情况还有待进一步研究,从而为深入了解南酸枣雌花的发育特性和开展品种选育提供理论基础。
Megaspogenesis, Microsporogenesis and Development of Female and Male Gametophyte of Choerospondias axillaris
- Received Date: 2022-06-12
- Accepted Date: 2022-09-08
- Available Online: 2023-06-20
Abstract:





 DownLoad:
DownLoad:




