-
皂荚(Gleditsia sinensis)又名皂荚树, 为豆科皂荚属植物, 为我国重要的乡土树种, 皂荚原产于我国长江流域, 在我国大部分地区均有分布, 多生于山坡林地、山谷及路旁。皂荚适应性强[1]、耐干旱, 也具有很高的工业价值和药用价值, 是优良的中药材[2]和工业原料[3], 可用作经济林、用材林、防护林及园林绿化。尽管皂荚分布区域广, 但是近年来, 由于人为的砍伐和自然环境的恶化, 导致我国皂荚天然种群呈片段化分布, 多数的群体以单株形式存在, 皂荚野生种的数量逐渐减少, 处于濒危状态, 遗传多样性是物种的重要特征, 也是研究物种多样性的核心问题, 它反映了物种对环境的适应能力。通过对物种遗传多样性的研究, 对于揭示物种对环境演替的适应规律, 对物种的保护和合理利用有着重要意义。扩增片段长度多态性AFLP分子标记具多态性丰富、可重复性强和稳定性高、标记覆盖密度高、引物组合通用等优点, 主要应用于品种鉴定[4]、遗传多样性评价[5]、分子标记连锁图谱构建[6]、数量性状位点定位[7]以及亲缘关系分析[8]。相比于测序技术, AFLP在分析精度上与测序方法存在明显的差距, 但是群体遗传学研究通常需要通过多群体大样本采样分析, 因此, 基于成本、效率以及数据分析等因素的限制, 测序技术在林木群体遗传学研究领域的成功应用未见相关报道, AFLP技术在对于一些没有参考基因组序列的植物, 非常有用[9], 仍是进行植物遗传多样性研究的有力手段。
目前, 国内外对皂荚开展了引种栽培[10]、抗逆性[1]、种实、刺特性与成分[2]等方面的研究, 对皂荚的遗传学研究主要集中在北方群体[14], 顾万春等[11]对中国北方6个省市的皂荚进行了种源试验, 并构建了北方产区的核心种质; 兰彦平等[12]对北方自然分布区的皂荚表型多样性进行了分析, 研究发现, 皂荚不同群体间绝大多数种子表型指标都存在极显著差异; 李伟等[13]对南方皂荚表型多样性研究发现, 皂荚果实、种子等性状在群体间和群体内存在丰富的变异, 群体内的变异是皂荚的主要变异来源。因此, 为有效保护南方皂荚的遗传资源, 在6个省(市)采集10个皂荚天然群体, 采用AFLP分子标记研究南方皂荚群体遗传多样性, 揭示我国南方地区皂荚群体的遗传多样性和遗传结构的现状, 为制定有效的保护策略和科学的育种策略提供理论依据。
HTML
-
在勘查的基础上, 2011年11月采样, 选择皂荚分布相对集中、具有代表性的10个群体, 共计215个个体, 具体地理位置详见表 1。株间距大于100 m, 样本采集尽量选择生长正常, 无病虫害, 在群体内选定的每个植株树冠中部向南的位置采集嫩叶片, 用硅胶干燥保存, 带回实验室后保存在-80℃冰箱, 备用。
群体
Population经度(E)
Longitude纬度(N)
Latitude海拔
Elevation/ m年均气温
AMT/C年均降水量
AMP/mm个体数
individual number/个湖北京山HBJ 113°01' 31°02' 30 16.3 1 179 16 湖北宜昌HBY 110°15' 30°17' 114 15.7 1 167 31 贵州麻江GZM 107°58' 26°05' 950 15.1 1 350 23 贵州兴义ZGX 101°58' 25°43' 1 253 15.2 1 315 24 湖南城步HNC 110°30' 26°30' 500 16.1 1 218 22 重庆秀山CQX 108°58' 28°45' 477 16.5 1 334 12 湖北恩施HBE 109°47' 30°03' 1 000 15.6 1 370 18 四川成都SCC 104°06' 30°67' 500 16.2 918 200 29 四川万源SCW 108°03' 32°07' 1 200 14.7 1 246 19 广西桂林GXG 110°28' 25°27' 150 18.9 1 949 21 Table 1. Collecting data and samples size of G. sinensis
-
皂荚叶片DNA提取采用CTAB法, 利用紫外分光光度计(NanoDrop8000, Thermo, American)检测DNA质量以及浓度, DNA浓度稀释到50 ng·μL-1, -20 ℃保存备用。
-
AFLP实验步骤参考黄平[14]的方法, 仅对PCR反应体系和程序进行优化。接头序列和预扩增引物序列由北京天根生物科技有限公司合成, 选择性扩增引物5’端添加Cy5荧光标记。
-
PCR产物检测参照黄平[14]的方法, 原始数据分析使用系统自带软件。
-
利用软件NTSYS-pc2.1和Popgene3.2对皂荚群体进行遗传多样性和遗传相似性分析, 包括多态位点百分比(PPB)、Nei’s多样性指数、Shannon’s信息指数I、遗传距离(D)和遗传一致度, 对各群体进行UPGMA聚类分析和分子方差分析(AMOVA)。
1.1. 材料
1.2. 试验方法
1.2.1. DNA的提取
1.2.2. AFLP分析
1.2.3. PCR产物检测
1.2.4. 数据处理
-
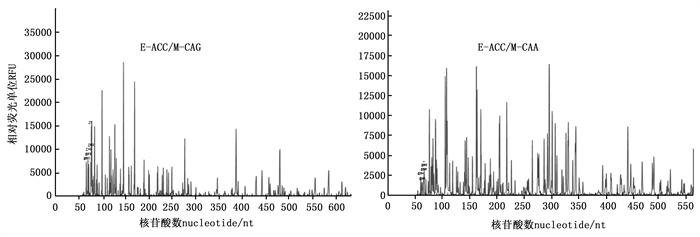
从64个组合中选出14对多态性好、分辨力高的AFLP引物组合(表 2), 用于供试材料的分析, 酶切电泳、预扩增电泳图和毛细管电泳图见图 1~3。共统计到1 782条带, 其中, 多态性条带有1 389条, 平均每对引物的扩增条带为127条, 扩增条带的数量变化范围为113~141, 平均每对引物的多态性条带有99条, 变化范围为81~117;14个引物组合PCR扩增产物多态性比率变化范围为68.80%~87.97%。引物E-ACA/M-CAG组合的PCR扩增产物多态性比率最高, 平均为87.97%, 引物E-ACG/M-CAG组合的PCR扩增产物多态性比率最低, 平均为68.80%;引物组合E-ACC/M-CAG扩增片段数量最多为141条, 而引物组合E-ACA/M-CTC扩增片段数量最少为113条。
引物组合
Primer combination总片段数量
No. total fragment/个多态性片段数量
No. polymorphic fragment/个多态性比率
PPB/%E-ACC/M-CAT 131 99 75.57 E-AGG/M-CAG 128 100 78.13 E-ACG/M-CAG 125 86 68.80 E-ACG/M-CTC 125 97 77.60 E-ACA/M-CTC 113 81 71.68 E-ACT/M-CTG 116 93 80.17 E-ACC/M-CAG 141 116 82.27 E-AGG/M-CAA 119 93 78.15 E-ACG/M-CTA 130 103 79.23 E-ACA/M-CAG 133 117 87.97 E-ACT/M-CAT 114 89 78.07 E-AAG/M-CTA 128 101 78.91 E-AAG/M-CTT 140 108 77.14 E-ACC/M-CAA 139 106 76.26 总数Total 1 782 1 389 77.94 均值Mean 127 99 Table 2. AFLP primers and their amplification results
-
Shannon’s信息指数和Nei’s多样性指数是衡量遗传多样性水平的常用指标。由表 3可以看出: 在群体水平上, Shannon’s信息指数I的平均值为0.256, Nei’s多样性指数为0.168。2个指数的变化趋势基本一致, 说明这2个指数所揭示的皂荚群体遗传变异规律是一致的, 均表现为贵州兴义群体的最高(I=0.292, h=0.191), 广西桂林群体的最低(I=0.197 h=0.125), 10个南方皂荚群体的I为0.197~0.292, h为0.125~0.191。
群体
populationsNei’s多样性指数(h)
Nei’s IndexShannon’s信息指数(I)
Shannon's Index湖北京山HBJ 0.184 0.280 湖北宜昌HBY 0. 175 0.248 贵州麻江GZM 0.184 0.280 贵州兴义ZGX 0.191 0.292 湖南城步HNC 0.19 0.273 重庆秀山CQX 0.165 0.262 湖北恩施HBE 0. 8 0.276 四川成都SCC 0. 46 0.202 四川万源SCW 0. 53 0.240 广西桂林GXG 0. 25 0.197 均值Average 0.168 0.256 Table 3. Genetic diversity of G. sinensis
本研究表明: 皂荚群体在种水平上的遗传多样性(Ht)为0.126, 群体间的遗传多样性(Hs)占0.032, 群体内的遗传多样性(Dst)为0.095, 群体内的遗传多样性占74.79%, 群体间的遗传多样性占25.21%, 表明皂荚群体的遗传多样性主要存在于群体内部。
基因流(Nm)是表明基因在群体间的交换程度, 根据公式Nm=0.5(1-Gst)/Gst得出皂荚群体种水平上的基因流为1.483, 这说明皂荚群体的基因流处于中等偏下水平, 群体间交流较少。
-
表 4表明: 皂荚不同群体的遗传多样性存在极显著差异(P < 0.01), 说明10个南方皂荚群体间均存在一定程度的遗传分化。在总的遗传变异中, 73.13%的变异发生在群体内, 只有26.87%发生在群体间, 说明皂荚群体在群体内和群体间均存在遗传变异, 而群体内的变异是皂荚群体变异的主要来源(表 4), 说明皂荚遗传变异以群体内为主, AMOVA分析和遗传多样性指数分析结果相同。
变异来源
Variation source自由度
Degree of Freedom平方和
Sum of squares均方
Mean square方差分量
Variance component方差分量百分率
Percentage of variance component/%群体间(Among populations) 9 10 029.37 10 320.78 23.87 26.87 群体内(Within populations) 231 17 392.01 64.97 64.97 73.13 Table 4. Molecular variance analysis (AMOVA) of G. sinensis
-
通过Nei指数计算群体间的遗传距离和遗传一致度(表 5), 皂荚群体遗传一致度为0.843 6~0.998 7, 平均为0.950, 其中, 湖北宜昌群体和湖北恩施群体的遗传相似程度最高(0.998 7), 贵州兴义群体和四川万源群体之间的遗传相似程度最低(0.848 5)。群体间的遗传距离为0.004 2~0.172 0, 平均为0.059, 其中湖北恩施和湖北宜昌群体的遗传距离最小(D=0.004 2), 湖南城步群体和贵州兴义群体的遗传距离最大(D=0.172 0), 研究结果表明皂荚群体间存在着较小的遗传分化。
群体Population 重庆秀山
XS四川万源
WY贵州麻江
MJ贵州兴义
XY湖北宜昌
YC广西桂林
GL湖北恩施
ES湖北京山
JS湖南城步
CB四川成都
CD重庆秀山XS 0.0446 0.0458 0.050 0.035 1 0.0 44 0.0400 0.0204 0.0353 0.0314 四川万源WY 0.959 4 0.118 0 0.670 0.0383 0.0289 0.0606 0.014 0.0278 0.0206 贵州麻江MJ 0.958 9 0.891 8 0.064 1 0.0369 0.0831 0.0234 0.0366 0.0875 0.095 9 贵州兴义XY 0.903 6 0.8485 0.9412 0.0889 0.1 10 0.0910 0.142 0 0.172 0 0.105 0 湖北宜昌YC 0.968 6 0.9649 0.9670 0.917 5 0.013 8 0.0042 0.018 2 0.0269 0.025 1 广西桂林GL 0.949 9 0.9738 0.9232 0.8618 0.9887 0.0248 0.0284 0.015 8 0.0267 湖北恩施ES 0. 964 0 0.9438 0.980 4 0.915 8 0.9987 0.9781 0.015 0 0.0429 0.04 4 湖北京山JS 0.983 1 0.952 6 0.9675 0.8700 0.9848 0.9746 0.9882 0.0264 0.0472 湖南城步CB 0.967 9 0.9745 0.918 8 0.8436 0.975 6 0.9862 0.9602 0.9762 0.0274 四川成都CD 0.971 8 0.9817 0.911 2 0.9027 0.977 0.975 6 0.981 0.9563 0.9746 注: 上三角为遗传距离; 下三角为遗传一致度。
Note: Nei’s genetic identity(above diagonal)and genetic distance(below diagonal).Table 5. Genetic similarity and genetic distance of G.sinensis populations
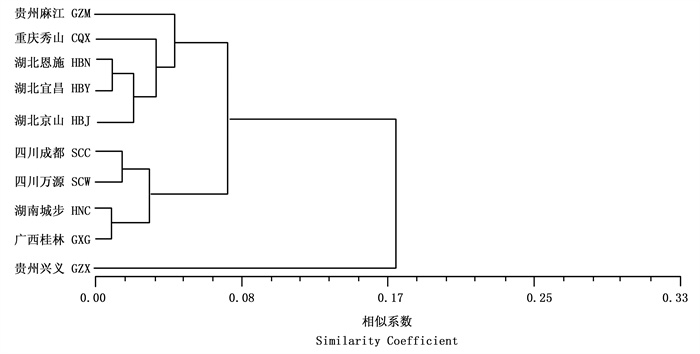
采用NTSYS-pc2.1软件对皂荚群体进行UPGMA聚类分析(图 4), 10个群体的遗传距离均大于0, 这表明供试的10个群体间有相同的遗传背景, 但是各群体间又存在着一定差异, 其中湖北恩施群体、湖北宜昌群体、湖北京山群体、重庆秀山群体这4个群体距离相近, 群体间遗传距离较小, 可以聚为一类; 四川成都群体、四川万源群体、广西桂林群体和湖南城步群体间遗传距离较小, 这4个群体聚为1类, 以上2类基本与其地理分布格局相吻合, 但贵州麻江群体和贵州兴义群体的地理距离较近, 但是并未优先聚在一起, 各自聚为1类, 这说明群体间的地理距离和群体间遗传分化程度并没有显著的相关性。
2.1. AFLP扩增片段多态性
2.2. 遗传多样性分析
2.3. 群体变异的AMOVA分析
2.4. 皂荚群体关系与聚类分析
-
AFLP分子标记技术是对生物基因组进行分析的一种较为理想的方法, 具有分析所需DNA量少、可重复性好、多态性强、分辨率高、样品适用性广等诸多特点, 但是AFLP分析中也存在操作步骤繁琐、银染检测灵敏度低、实验效率低以及数据分析复杂的缺点。本研究通过加入荧光引物和毛细管电泳进行自动分析, 使AFLP分子标记技术在遗传多样性的测定上更方便快捷, 结果也更准确。皂荚是我国特有的乡土树种, 在我国分布广泛, 但是由于人为破坏, 我国皂荚呈片段化分布, 多数的皂荚以单株形式存在, 皂荚野生种的数量逐渐减少。到目前为止, 有关皂荚遗传资源评价工作并不多, 对其遗传背景也不清楚, 这严重影响了皂荚遗传资源的保护和利用。本研究从湖北、四川、重庆、湖南、广西和贵州收集了10个群体, 共计215份皂荚种质资源, 对不同地区的皂荚遗传资源进行遗传多样性评价。AFLP分析表明: 所有14对荧光引物组合对215份样品扩增出1 389条多态性条带, 多态性百分比达77.94%, 平均每对引物的多态性条带有99条。
皂荚群体在种水平上的遗传多样性为0.126, 低于红豆杉(Taxus wallichiana Rehd.) (0.495)、板栗(Castanea mollissima Bl.) (0.153)、蒙古栎(Quercus mongolica Bl.) (0.145)、苦楝(Melia azedarach Linn.) (0.206)、连香树(Cercidiphyllum Japonicum Sieb.) (0.351)等植物[15-17]。皂荚遗传差异的分析结果显示, 10个群体间的遗传距离为0.004 2~0.172 0, 平均为0.059, 这也说明了不同地区皂荚具有一定的遗传多样性, 但较有限。这也许是由于自然状态下皂荚的种子受到荚果(含有胶状物质)和种皮(种皮厚而坚硬, 透水性差)的抑制很难萌发, 多数的皂荚以单株形式存在, 皂荚个体间基因交流有限, 使其多样性流失, 再加上长期以来的人为干扰, 使得皂荚野生资源处于濒危状态, 这也导致了其遗传多样性降低。此外, 基于AFLP分子标记的遗传多样性分析反映的是基因组的一部分信息[18], 这也可能是皂荚遗传多样性偏低的原因之一。
群体的遗传结构受到基因流、交配系统、突变和选择等因素的影响。群体变异的分子方差分析(AMOVA)表明, 10个南方皂荚群体间均存在着一定程度的遗传分化, 皂荚群体在群体内和群体间均存在遗传变异, 而群体内的变异(73.13%)是皂荚群体变异的主要来源。皂荚群体的遗传分化系数(Gst)为25.21%, 低于自交(0.65)和混合交配(0.40)系统植物, 高于异交(0.27)系统植物, 这与皂荚虫媒异花授粉的特征不符, 这可能是由于皂荚群体间的分布距离较远, 使得群体间呈现出一定的遗传分化; 此外, 皂荚群体的遗传分化系数高于栓皮栎(Quercus variabilis Bl.) (4.55%)、银叶树(Heritiera littoralis Dryand.) (23.94%)、秀雅杜鹃(Rhododendron concinnum Hemsl.) (7.26%), 低于连香树(cercidiphyllum Japonicum Sieb.) (50.00%)、鹅掌楸(Liriodendron chinensis Sargent.) (34.34%), 刺槐(Robinia pserdoacacia Linn.) (42.03%), 观光木(Tsoongiodendron odorum Sin.) (34.34%)、白花树(Styrax tonkinensis Craib.) (34.04%)、珙桐(Davidia involucrate Baill.) (26%)、资源冷杉(Abies ziyuanensis L.K.Fu et S.L.Mo) (37.77%), 银杉(Cathaya argyrophylla Chun.) (26.00%)等树种。物种的分布范围会影响到群体间的分化, 群体间如果由于生境破碎化等因素造成生殖隔离, 则该群体间就会产生较大的遗传差异[21]。目前, 皂荚在我国分布呈散生的状态, 成片的天然林基本消失, 人为的破坏严重, 造成生境片段化以及交换种子花粉的几率变小, 从而导致皂荚群体的遗传结构存在着一定的分化。
基因流影响着群体的遗传结构, 基因流的大小反映出群体遗传结构的大小, 通常来说, 基因流越大, 群体间的遗传分化系数越小。基因流 > 1时说明该群体间存在着一定的基因流动[21]。本研究表明, 皂荚群体的基因流(Nm=1.483)处于中等偏下水平, 群体间的交流较少。本研究所用材料分布广泛, 其花粉和种子可以借助风力、昆虫和鸟类进行远距离传播, 因此, 皂荚群体间有一定的基因交流; 但是, 由于皂荚散生分布的特点造成交换种子及花粉的几率小, 因此, 群体间交流也相对较少。
大多数研究表明, 遗传关系和地理距离具有一定的相关性[22], 但也有研究表明, 二者之间并不呈显著的相关性[23]。根据Nei’s遗传距离聚类分析可以看出, 10个群体主要分为4大类, 各类群体按地理空间分布聚在一起, 但是也有例外, 如湖南城步群体, 这可能与湖南群体特定的分布范围(多分布于村边、路边等人流量较大地区)和特定的环境条件(降雨量大)等有关, 也可能是从四川等地引种等多因素造成的。
-
本研究利用AFLP分子标记技术揭示了皂荚群体的遗传多样性, 该结果比较全面的反映了我国南方皂荚群体的遗传信息。(1)AFLP分析表明: 所有14对荧光引物组合对215份样品扩增出1 389条多态性条带, 多态性百分比达77.94%, 平均每对引物的多态性条带有99条。(2)皂荚群体在种水平上的遗传多样性为0.126, 遗传多样性偏低; 皂荚群体间均存在着一定程度的遗传分化, 皂荚群体在群体内和群体间均存在遗传变异, 而群体内的变异是皂荚群体变异的主要来源。(3)根据Nei’s遗传距离聚类分析可以看出, 10个群体主要分为4大类, 各类群体主要按地理空间分布聚在一起。为更好的保护和利用皂荚遗传资源需要广泛的分析全国范围内皂荚的遗传多样性, 从皂荚生态效益、药用价值和分子水平相结合来全面评价其遗传多样性。此外, 对于保护皂荚遗传资源来说, 在开展原地保存和异地保存的同时建立种质资源收集圃进行保存。在进行皂荚的原地保存工作时, 保护一个群体的完整性尤为重要; 在对皂荚进行异地保存时, 保存的个体尽量来自不同的居群, 以保证基因流能在各居群间最广泛的交流。








 DownLoad:
DownLoad: