-
密度是自然界中重要的选择压力[1],能引起植株个体间因生长资源的强制分配而产生相互作用,改变植物所必需的光照、水分和养分等环境资源的可利用水平,而环境与资源水平的变化势必会引起植物形态特征及生长特性的适应性调节[2],进而对个体资源进行重新分配[3]。密度升高导致的生长空间拥挤和邻体效应增加等均会对植物构件表型塑性产生明显的影响[4],也即密度不仅会影响植物的营养状况、叶片对光的截获和光资源的分布特征,而且还会对叶片的功能性状产生明显影响[5]。植物叶片性状特征直接影响到植物的基本行为和功能,其差异体现了植物对环境的适应性和资源利用特征[6],如比叶面积较小的植物叶片含有更多的高能量消耗的厚壁组织和细胞壁成分[7],意味着它们将更多的能量用来构建叶片而非投资到光合器官。叶片功能性状的差异既是植物对环境响应的反映,同时也是其各自相对生长速率差异的体现形式,即异速生长模式。近年来,植物叶片功能性状及其相对生长关系对环境变化的响应特征是植物功能生态学研究的热点之一[8-10]。但有关叶片性状异速生长的研究多集中于大尺度多物种的种间水平上,如Wright等[9]研究了北半球2 548种植物的6个主要叶性因子变化规律,发现其中大多数物种叶性因子均表现出异速生长模式。祝介东等[10]研究发现不同气候带内植物叶片大小与叶柄干重也呈异速生长关系。但种内水平叶片性状的异速生长关系研究涉及较少[11-12],这极大限制了对植物资源利用策略、异质环境下植物形态适应特征的认识。因此,研究植物叶片功能性状及其异速生长模式与环境、竞争和干扰的关系,有助于理解植物对环境的适应机制及对资源的利用和分配过程等[13],具有重要的科学意义。
苦竹(Pleioblastus amarus (Keng) keng f.)隶属禾本科(Gramineae)大明竹属(Pleioblastus Nakai),复轴混生型,是笋材兼用竹种,竹材可制作工艺品、乐器等,竹笋味苦,具清热解毒之功效。近年来,随着经济社会的发展,保健类食品得到了人们的青睐,苦竹笋市场需求量不断增长,福建、浙江、贵州、广东等地对苦竹资源进行了规模化开发利用,但总体而言,多处于粗放经营水平。苦竹的研究也仅局限于生长发育规律[14-15]、生物量模型[16]和器官养分格局[17]及施肥的密度效应[18]等方面,而苦竹叶片性状及其异速生长关系的密度效应研究尚未见报道。为此,本研究以3个密度的苦竹纯林为试材,分析了密度对苦竹主要叶性因子及其相对生长关系的影响,试图探讨:(1)密度会导致林内光资源水平与分布格局发生变化,这是否会引起苦竹主要叶性因子产生形态塑性的适应性调节?如果产生适应性调节,苦竹叶性因子的形态塑性调节对密度变化的敏感性是否存在差异?(2)密度会引起植物生长空间拥挤程度与邻体竞争作用发生变化,这是否会对苦竹叶性因子间的相对生长速率(异速生长关系)产生影响? 通过上述问题的阐释将有助于揭示苦竹叶片形态塑性变化的密度制约性调节作用机制,为苦竹林培育的林分密度构建提供参考。
HTML
-
试验地位于福建省沙县苦竹主要分布区高桥镇(26°26′ N, 117°34′ E),属中亚热带季风气候,年平均气温19.5℃,年平均降水量1 642 mm。土壤类型为红壤,pH值4.5~5.5,土壤厚度100 cm以上。试验区属苦竹中心分布区,苦竹资源丰富,成片分布,面积1 000 hm2以上。为建立地方特色竹产业,促进竹业增效、竹农增收,自20世纪90年代以来对苦竹资源进行了规模化开发利用,目前试验区笋材兼用苦竹林经营面积300 hm2以上,但总体而言经营较为粗放,主要培育措施为季节性伐竹、留笋长竹和劈山除杂,少有施肥和林地垦复,而且由于采笋强度和经营习惯间的差异,使不同林分间的立竹密度差异较大。
-
于2015年7月,在试验区选择立地条件和经营措施基本一致的3种密度的苦竹纯林,分别设置5 m×5 m样地各6个,经样地调查,立竹密度分别为14 430~16 545株·hm-2(低密度,L)、31 590~34 560株·hm-2(中密度,M)、54 120~55 560株·hm-2(高密度,H)。L、M、H密度试验林立竹平均胸径分别为4.12±0.15 cm、3.98±0.19 cm、3.84±0.27 cm,之间无显著差异(P>0.05)。在每块试验林中分别选择1~3年生样竹各6株,在每株样竹竹冠的上部、中部和下部分别采集15片无病虫害的成熟叶片,分别标号,用CI-202便携式激光叶面积仪(美国CID公司)扫描记录叶面积(LA, cm2)、叶长(LL, cm)、叶宽(LW, cm),计算叶形指数(LL/LW)。然后将叶片带回实验室,在烘箱中80 ℃烘干至恒质量,用电子天平(Mettler Toledo, 1/10000)称量叶干质量(LM, g),计算比叶面积(LA/LM, cm2·g-1)。
-
苦竹叶片功能性状简单异速生长模式可以用方程Y=axb来描述,经对数转换后,表达式为logy=log a+b log x,其中x与y代表不同的叶片性状值,b为方程的斜率,即异速生长指数,若b与1.0差异显著,则各性状间为异速生长关系。采用标准主轴回归分析(Standardized Major Axis, SMA)[19]计算异速生长方程的斜率b,并比较斜率之间及各斜率与1.0的差异性。若斜率间无显著差异,则给出共同斜率,并采用Wald方法检验各密度苦竹林沿共同主轴位移差异的显著性,并计算位移量。叶片性状沿共同主轴的位移可表明不同密度苦竹林叶片性状值的差异。
试验数据整理与图表制作由Excel 2003统计软件完成,单因素方差分析由SPSS 14.0统计软件完成。标准主轴回归分析采用R (3.3.0)的Smatr软件包进行。所有统计检验的显著水平均采用α=0.05。试验数据均为平均值±标准差。
1.1. 研究区概况
1.2. 研究方法
1.3. 数据分析
-
由表 1分析可知,随着立竹年龄的增加,相同密度苦竹林的叶长、叶形指数和比叶面积均呈先升高后降低的变化趋势,1年生、3年生立竹叶长并无显著差异(P>0.05),总体上显著低于2年生立竹。不同密度竹林叶形指数2年生、3年生立竹间均无显著差异,均显著高于1年生立竹;中密度、低密度竹林1~2年生立竹比叶面积无显著差异,均显著高于3年生立竹,而高密度竹林1~3年生立竹比叶面积差异显著;叶宽和叶面积随着立竹年龄的增加总体呈降低趋势,低密度竹林叶宽立竹年龄间差异显著,中密度、高密度竹林1年生立竹叶宽显著高于2年生、3年生立竹,而后两者间并无显著差异;低密度、高密度竹林1年生、2年生立竹叶面积无显著差异,显著高于3年生立竹,而中密度竹林叶面积立竹年龄间差异显著(P < 0.05)。
林分密度
Stand density立竹年龄
Bamboo age /a叶长
Leaf length /cm叶宽Leaf
width /cm叶形指数Leaf
shape index叶面积Leaf
area /cm2比叶面积Specific
leaf area /(cm2·g-1)低密度
Low density1 23.32±1.11ab A 3.91±0.12 a A 5.98±0.36 b A 63.06±4.26 a B 179.18±12.31a B 2 24.69±1.23 a B 3.42±0.25 b A 7.21±0.43 a B 60.80±3.23 a B 183.07±15.36 a B 3 22.29±0.98 bc B 3.11±0.24 c B 7.13±0.48 a B 47.31±2.53 b B 168.03±11.02 b B 中密度
Medium
density1 24.56±1.32 b A 4.17±0.31 a A 5.94±0.29 b A 69.94±5.23 a A 191.24±9.68 a A 2 27.74±0.98 a A 3.46±0.26 b A 8.02±0.62 a A 66.41±3.25 b A 197.19±9.45 a A 3 24.87±1.28 b A 3.37±0.19 b A 7.46±0.64 a A 57.31±1.09 c A 176.14±7.58 b A 高密度
High density1 20.90±1.36 b B 3.65±0.16 a B 5.75±0.39 b A 48.38±4.12 a C 168.90±12.04 b C 2 23.26±1.31 a B 3.24±0.17 b B 7.18±0.51 a B 50.19±4.06 a C 176.07±12.36 a C 3 20.55±1.42 b B 3.31±0.21 b A 6.81±0.52 a B 42.89±2.36 b C 161.18±10.69 c C 注:不同小写字母表示相同密度不同年龄立竹间差异显著(P < 0.05),不同大写字母表示不同密度相同年龄立竹间差异显著(P < 0.05)。
Note: Different lowercase letters within a column indicate the significant differences (P < 0. 05) among bamboo ages under same density, then different capital letters indicate the significant differences (P < 0. 05)among stand density with same ages.Table 1. Leaf traits of P. amarus under different stand densities
随着密度的增加,1~3年生苦竹叶长、叶宽、叶形指数、叶面积和比叶面积总体均呈先升高后降低的变化趋势,且以中密度竹林最大。中密度、低密度竹林1年生立竹叶长和1~2年生立竹叶宽无显著差异(P>0.05),均显著高于高密度竹林,而低密度、高密度竹林2~3年生立竹间叶长无显著差异,均显著低于中密度竹林,中密度、高密度竹林3年生立竹叶宽差异不显著,均显著高于低密度竹林3年生立竹;不同密度竹林1年生立竹叶形指数差异不显著,而2~3年生立竹叶形指数低密度、高密度竹林间差异不显著,均显著低于中密度竹林;不同密度竹林1~3年生立竹叶面积和比叶面积均有显著差异(P < 0.05)。
-
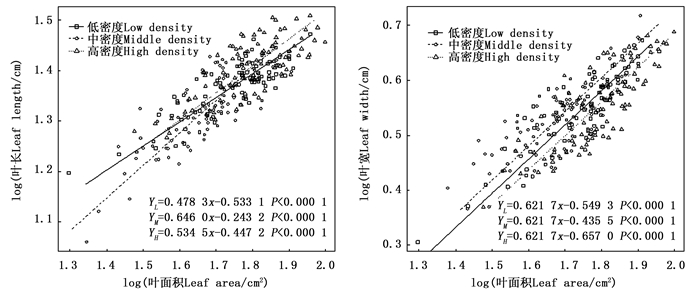
不同密度苦竹林叶长-叶面积(bLL-LA)、叶宽- 叶面积(bLW-LA)异速生长指数分别为0.478 3、0.646 0、0.534 5和0.616 7、0.596 7、0.647 1,均显著小于1.0,呈异速生长模式(图 1),且叶面积的增长速度明显小于叶长和叶宽。随着林分密度的增加,bLL-LA呈先升高后降低的变化趋势,且不同密度竹林间差异显著(P < 0.05),而bLW-LA呈先降低后升高的变化趋势,不同密度竹林间并无显著差异(P=0.201 2)(图 1),其共同斜率为0.621 7,截矩分别为-0.549 3、-0.435 5、-0.657 0,Wald检验表明不同密度竹林截矩差异显著,即说明各密度竹林沿共同主轴发生显著的移动,且以中密度竹林的位移量最大。
-
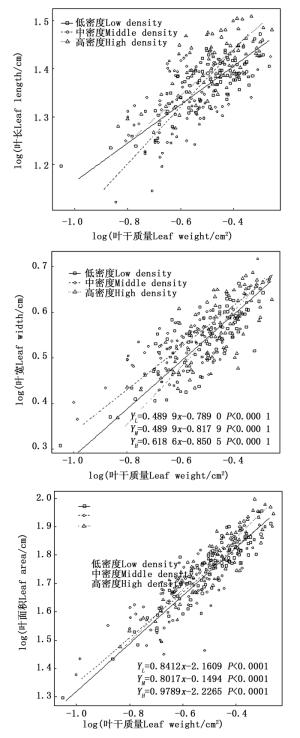
不同密度苦竹林叶长-叶干质量(bLL-LM)、叶宽-叶干质量(bLW-LM)异速生长指数分别为0.402 3、0.595 1、0.490 1和0.518 0、0.460 7、0.618 6,均显著小于1.0,呈异速生长模式(图 2),且叶干质量的增长速度明显小于叶长和叶宽(图 2)。随着密度的增加,bLL-LM呈先升高而后降低的趋势,且不同密度竹林间差异显著(P < 0.05),而bLW-LM的变化规律与bLL-LM相反,高密度竹林显著高于中密度、低密度竹林,而中密度、低密度竹林间无差异显著(P=0.214 9),其共同斜率为0.489 9,截矩分别为0.789 0和0.817 9,Wald检验表明两者截矩差异显著,即中密度竹林沿共同主轴的位移显著大于低密度竹林。不同密度苦竹林立竹叶面积-叶干质量(bLA-LM)异速生长指数分别为0.841 2、0.801 7和0.978 9,随着密度的增加先下降后升高,不同密度竹林间差异显著(P < 0.05)(图 2)。其中,中密度、低密度竹林bLA-LM均显著小于1.0,呈异速生长模式,而高密度竹林bLA-LM接近1.0(P>0.05),呈等速生长模式。
2.1. 苦竹叶片性状的密度效应
2.2. 苦竹叶长、叶宽与叶面积异速生长模式的密度效应
2.3. 苦竹叶性因子与叶干重异速生长模式的密度效应
-
叶片是植物与环境接触面最大的器官,其功能性状与植物生物量、生长策略和资源的获取、利用密切相关,反应了植物适应环境变化的生存对策[20],决定着群落的结构和生态系统的功能[21]。本研究表明,随着立竹年龄的增加,相同密度苦竹林叶长、叶形指数和比叶面积呈先升高后降低趋势,叶宽和叶面积总体呈降低趋势,说明立竹年龄对叶片功能性状影响明显,随着立竹年龄增长总体会使叶片变长、变窄,而单叶面积和比叶面积也总体下降。随着苦竹林密度的增加,相同年龄立竹叶长、叶宽、叶形指数、叶面积和比叶面积总体均呈先升高后降低趋势,而且3个试验密度的苦竹林叶面积和比叶面积差异显著,说明随着密度的增加,苦竹叶片所能接收到的有效光资源趋于减少,苦竹通过增加单叶叶面积来适应不断增强的弱光胁迫,这与顾大形等对四季竹(Oligostachyum lubricum (Wen) Keng f.)的研究结论基本一致[22],但当立竹密度过大时(高密度),立竹间的邻体竞争和空间挤压作用增强,会导致植物构件生长受到抑制[23-25]和生物量积累显下降[26],进而致使叶长、叶宽均下降,叶面积降低,这与刺槐(Robinia pseudoacacia L.)幼苗叶面积随密度增加的变化规律基本一致[27]。比叶面积在一定程度上代表了植物对于所获取到资源的返还能力[28-29],同时也反应了植物对生境的适应性特征[30],比叶面积较高的植物虽然对于所获取的资源保存能力较差,但返还能力较强,故而通常具有较高的生产能力[31]。本研究结果显示,随着密度的增加,苦竹比叶面积先升高后下降,以中密度苦竹林最大,这说明中密度苦竹林养分运转速率最快,生产能力最强,是苦竹林培育的适宜密度。当密度过高时,立竹间遮荫效果明显,林内光线减弱,邻体竞争作用增强,致使苦竹叶片将更多的能量和物质用于合成防御物质以抵抗和适应弱光胁迫和邻体竞争的胁迫生境,因而叶面积和比叶面积均下降。而低密度下,林内光照充足,光资源丰富,苦竹通过降低叶面积的投入来避免高光强引起的光合抑制或强光伤害,同时,低密度苦竹林生长势相对较低,维持种群稳定的光合碳需求不高,也使叶面积降低。
植物叶片功能性状间多呈异速生长关系,且各叶性因子间异速生长关系存在明显差异,并受环境因素、经营措施和干扰等的影响,因而表现出一定的可塑性[8, 10, 26, 32-36]。密度不仅对苦竹叶片性状产生明显影响,而且也对叶片性状间相对生长速率产生明显作用,即不同密度苦竹林叶性因子间异速生长关系发生了变化。异速生长关系的改变,反映了植物资源利用策略、物质与能量投入的差异,是植物对资源可利用水平与竞争胁迫生境的塑性适应[35]。本研究表明,bLL-LA、bLW-LA均显著小于1.0,即叶长、叶宽与叶面积间均呈异速生长关系,这与武瑞鑫等对披针叶黄华(Thermopsis lanceolata R. Br.)的研究结果基本一致[36]。随着密度的增加,bLL-LA先升高后降低,且不同密度苦竹林间差异显著,以中密度苦竹林bLL-LA最大,而较大的bLL-LA则表明在给定叶面积下中密度苦竹林具有更大的叶长;不同密度苦竹林bLW-LA略有差异,但并不显著,具有共同斜率,且以中密度苦竹林沿共同斜率位移最大,这表明在给定叶面积下中密度苦竹林具有更大的叶宽,这与中密度苦竹林立竹叶长、叶宽与叶面积较大的研究结果一致。不同密度下bLL-LA差异显著,而bLW-LA并无显著差异,则说明密度对叶长-叶面积间异速生长关系影响显著,而对叶宽-叶面积间异速生长关系影响较小,也即叶长对密度效应的反应更加敏感,其主要原因可能是由于邻体竞争与生长空间拥挤对叶长的限制作用更强,这同时也说明苦竹主要是通过调节叶长来适应密度变化所引起的光资源异质性和邻体竞争,以增强资源的获取,适应环境胁迫,维持种群的稳定和扩张。
试验苦竹林bLL-FM、bLW-FM均显著小于1.0,说明叶长、叶宽与叶干质量间均呈异速生长关系。随着密度的增加,bLL-LM呈先升高后降低趋势,而bLW-LM则相反,且bLL-LM不同密度竹林间差异显著,而中密度、低密度竹林bLW-LM差异不显著,共同斜率(0.489 8)显著低于高密度竹林(0.618 6),且中密度竹林截矩显著大于低密度竹林,即中密度竹林沿共同主轴位移显著高于低密度竹林,这与中密度竹林具有较大叶干质量和叶宽的事实相符。有研究表明,叶面积与叶干质量间呈正相关关系,且两者相对生长关系符合异速生长模式,其异速生长指数b小于1[35-36]。本研究结果显示,中密度、低密度竹林bLA-LM均显著小于1.0,呈异速生长模式,而高密度竹林bLA-LM接近1.0,呈等速生长模式,且不同密度苦竹林bLA-LM差异显著。分析认为叶面积与叶干质量的这种异速生长变化可能与随叶片的生长干物质投资出现“回报递减”现象有关,较大的叶子为了更多的暴露于阳光下和更有效率的将水分运输到叶肉细胞,将会投资更多的生物量用于微管组织和厚壁组织的建设,从而导致了分配到叶肉细胞的生物量减少,进而导致较低的基于叶干质量的光合速率[37, 38]。当密度增加到一定程度时,叶面积-叶干质量相对生长关系发生转变,由异速生长转变为等速生长,这说明密度变化引起苦竹叶片对光资源获取与抵御胁迫投入的权衡关系发生了改变,密度过大,林内光资源水平明显下降且异质性增强,加之不断增强的邻体竞争作用,苦竹会将叶生物量主要投资于光捕获面积,通过增大叶的物质与能量的投入而获得更高的光合能力,从而利于种群稳定和扩张[7, 21]。
-
密度对苦竹主要叶性因子、相对生长速率及其异速生长关系会产生明显的影响,苦竹能通过叶片性状及其异速生长关系的适应性调节来应对密度变化所引起的光资源限制和邻体竞争,且叶长对密度变化更为敏感。随着苦竹林密度的增加,立竹叶长、叶宽、叶形指数、叶面积和比叶面积总体均呈先升高后降低趋势,中密度(31 590~34 560株·hm-2)苦竹林具有较大的叶长、叶宽、叶形指数、叶面积和比叶面积,具有良好的叶片性状,因而生产潜力较高,是苦竹林培育的适宜密度。




 DownLoad:
DownLoad:
