-
花吊丝竹(Dendrocalamus minor var. amoenus)属于竹亚科(Bambusoideae)牡竹属(Dendrocalamus)吊丝竹(Dendrocalamus minor )变种的丛生竹,其竿有异色条纹,外形美观,可作庭园观赏竹,亦可劈篾编结竹席、箩筐等竹器[1],广泛分布于我国广东、广西、贵州、福建等地。丛生竹林在生物固碳领域也有巨大作用,同等面积下的竹林较树林可多释放出35%的氧气,具有很好的生态效益[2]。由于花吊丝竹具有繁殖生长快、根系发达、蓄水保土、适应性广等特性,在我国南方沿海沙地进行引种,与木麻黄、马尾松进行混交种植形成沿海防护林,可以起到防风固沙效果;同时,ISSR分子标记为花吊丝竹防护林的保护策略提供重要的遗传信息。引种具有较高遗传多样性的花吊丝竹居群可以增加它们各自群体间的基因交流和遗传多样性水平,为种质资源保育提供理论指导。
目前,国内外关于花吊丝竹的研究报道,主要为组织培养、生理生化、栽培技术、蛋白组学的研究[3-9],而利用ISSR分子标记技术对该竹种进行遗传多样性的研究尚未见报道。本研究采用ISSR分子标记技术对引种自福建、广西、广东地区花吊丝竹种质资源的3个居群遗传多样性进行研究,以期为花吊丝竹的种源区域划分、沿海沙地适地种源发掘提供理论基础。
HTML
-
2016年9月于福建省东山国有赤山林场花吊丝竹种源试验样地每株采集幼嫩叶片3~5片,洗净放入自封袋并冰袋保存,其中,供试的花吊丝竹3个居群48个样本,置于-80℃冰箱,以备DNA提取。样品详细信息见表 1。
编号
No.代号
accession采样地点
population采样地点小地名
location纬度 N
Latitude经度 E
Longitude1~3 WL 福建 龙岩武平 25°01′ 116°01′ 4~6 YS 福建 三明永安 25°98′ 117°37′ 7~9 HZ 福建 漳州华安 25°02′ 117°53′ 10~12 DZ 福建 漳州东山 23°07′ 117°43′ 13~15 MH 福建 福州闽侯 26°16′ 119°14′ 16~18 XXN 广西 南宁西乡塘 22°50′ 108°17′ 19~21 LN 广西 南宁良庆 22°45′ 108°19′ 22~24 WN 广西 南宁武鸣 23°17′ 108°27′ 25~27 XN 广西 南宁兴宁 22°48′ 108°22′ 28~30 MN 广西 南宁马山 23°72′ 108°17′ 31~33 PC 广西 崇左凭祥 22°12′ 106°75′ 34~36 CG 广东 广州从化 23°55′ 113°58′ 37~39 LG 广东 广州萝岗 23°11′ 113°28′ 40~42 YQ 广东 清远英德 24°18′ 113°04′ 43~45 NZ 广东 中山南区 22°52′ 113°38′ 46~48 TD 广东 东莞塘厦 22°81′ 114°07′ Table 1. Sampling locations of the 48 Dendrocalamus minor var. amoenus accessions
-
采用博日公司Biospin植物基因组DNA抽提试剂盒提取花吊丝竹叶片的基因组DNA,将提取出的DNA用紫外分光光度计检测其浓度、纯度,再用琼脂糖凝胶电泳检测DNA的完整性及是否有降解现象。将DNA样品浓度稀释到20 ng·μL-1并置于-20℃冷藏备用。
-
利用最佳反应体系和程序,将提取出的花吊丝竹基因组DNA,分别与100条引物(参考哥伦比亚大学公布的100条引物,由上海生工合成)进行ISSR-PCR扩增,按照重现性好、多态性高、条带清晰的原则进行筛选。
ISSR-PCR反应体系:20 μL的反应液中含2.5 mmol·L-1 Mg2+,0.25 mmol·L-1 dNTPs,1.50 U Taq DNA聚合酶,0.5 μmol·L-1引物,80 ng模板DNA,2 μL 10xBuffer,9.5 μL ddH2O。反应扩增程序为:94℃预变性5 min;94℃变性45 s。52.7℃退火30 s,72℃延伸90 s,40个循环;72℃延伸10 min,4℃保存。取9 μL的PCR产物与1.5 μL 6xloading Buffer混匀,上样到加有核酸染料的1.5%琼脂糖凝胶上,电泳1 h,电压设为5 v·cm-1。待电泳时间结束, 到紫外凝胶成像分析仪观察和拍照。
-
经过电泳分离后,凝胶上的同一位置出现的条带属于同一位点,对所得的扩增结果进行记录,以1代表有条带,0代表无条带,建立一个二元0—1矩阵,输入到Excel表格中。借助POPGENE32软件得出种群内和种群间遗传多样性参数,进行遗传多样性分析,再使用SPSS13.0对数据进行处理,根据遗传距离采用UPGMA进行聚类分析,绘制成ISSR树状聚类图。
1.1. 材料
1.2. 试验方法
1.2.1. DNA的提取与检测
1.2.2. ISSR引物的筛选和PCR扩增
1.2.3. 数据处理
-
筛选出的12条高重复性、多态性、稳定性的ISSR引物见表 2,12条引物共扩增出124个清晰位点并且平均每条引物扩增出10.3位点,其中,多态性位点达102个,占总位点的82.26%。DNA片段大小在200~2 200 bp,位点数为7~13个,其中, 引物UBC828,UBC829扩增出的多态性条带最多(88.89%),引物UBC827和UBC836扩增多态性百分比最低(76.92%)。
引物编号
primer序列
Sequence退火温度
Tm/℃总位点数
Number of bands scored多态性位点
Number of polymorphic bands多态条带百分率
PPB/%UBC807 (AG)8T 46.4 13 11 84.62 UBC810 (GA)8T 44.9 12 10 83.33 UBC811 (GA)8C 46.7 11 9 81.82 UBC826 (AC)8C 52.6 10 8 80.00 UBC827 (AC)8G 52.9 13 10 76.92 UBC828 (TG)8A 50.8 9 8 88.89 UBC829 (TG)8C 53.2 9 8 88.89 UBC836 (AG)8YA 48.4 13 10 76.92 UBC840 (GA)8YT 47.0 11 9 81.82 UBC844 (GT)8RC 48.6 7 6 85.71 UBC846 (CA)8RT 51.4 9 7 77.78 UBC847 (CA)8RC 53.1 7 6 85.71 总和Total 124 102 均值Mean 10.3 8.5 82.70 Table 2. ISSR primers used to analyze Dendrocalamus minor var. amoenus accessions
-
利用POPGENE32基因软件对48个花吊丝竹样本扩增结果进行遗传多样性分析, 48个样本平均等位基因数(Na)= 1.822 6,平均有效等位基因(Ne)= 1.344 1,Ne’基因多样性指数(He)为0.220 4,Shannon’s信息指数(I)分别为0.349 4, 多态性百分比(PPB)= 82.26%。
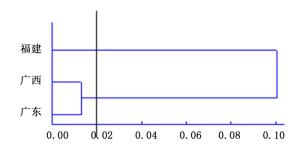
3个居群遗传多样性水平:平均等位基因数(Na)= 1.502 7, 平均有效等位基因(Ne)= 1.365 6,Ne’基因多样性指数(He)为0.206 6,Shannon’s信息指数(I)分别为0.300 5, 多态性百分比(PPB)= 50.27%。福建居群遗传多样性最高, 平均等位基因数(Na)= 1.758 1,平均有效等位基因(Ne)= 1.516 3,Ne’基因多样性指数(He)= 0.298 7,Shannon多样性指数(I)= 0.438 8,多态性百分比(PPB)= 75.81%;最低是在广东居群,平均等位基因数(Na)= 1.346 8,平均有效等位基因(Ne)= 1.269 5,Ne’基因多样性指数(He)= 0.149 3,Shannon多样性指数(I)= 0.215 0,多态性百分比(PPB)= 34.68%(表 3)。
代号
Pop ID居群
population平均等位基因数
Na平均有效等位基因
Ne基因多样性指数
He香农信息指数
I多态条带百分率
PPB/%1 福建 1.758 1 1.516 3 0.298 7 0.438 8 75.81 2 广西 1.403 2 1.310 9 0.171 8 0.247 7 40.32 3 广东 1.346 8 1.269 5 0.149 3 0.215 0 34.68 均值Mean 1.502 7 1.365 6 0.206 6 0.300 5 50.27 Table 3. Genetic diversity between populations of Dendrocala musminor var. amoenus
-
3个居群总的遗传多样性(Ht)= 0.246 9,居群内遗传多样性(Hs)= 0.206 6,根据Nei’s遗传多样性计算出不同居群分化水平(Gst)= 0.163 3,表明16.33%的遗传变异存在于居群间,居群内的遗传变异为83.67%。3个居群的基因流Nm为2.562 1,说明居群间存在较大基因流,很大程度减少居群间遗传差异(表 4)。
居群总遗传多样性
Ht居群内遗传多样性
Hs遗传分化水平
Gst基因流
Nm均值Mean 0.246 9 0.206 6 0.163 3 2.562 1 标准偏差SD 0.032 0 0.027 8 Table 4. Nei's analysis of genetic variation of the three populations
-
遗传距离越小则遗传相似系数越大,亲缘关系越近,竹种间的差异程度越小。利用POPGENE32软件分析,获得了居群间遗传距离和遗传相似系数。
48个花吊丝竹种质中,龙岩武平与南宁武鸣之间以及龙岩武平与中山南区之间遗传距离最大为0.928 5,遗传一致度最小,分化程度最高;而广州从化采样地内的2个种质以及东莞塘厦与广州从化之间遗传距离最小为0,遗传一致度最大,几乎不存在分化现象。最大遗传相似系数为1(东莞塘厦与广州从化之间以及广州从化采样地内的2个种质之间),最小遗传相似系数为0.395 2(龙岩武平与南宁武鸣之间以及龙岩武平与中山南区之间),结果显示:遗传距离和遗传相似系数保持高度一致,说明花吊丝竹种质中东莞塘厦与广州从化之间的亲缘关系最近,龙岩武平与南宁武鸣之间以及龙岩武平与中山南区之间的亲缘关系最远。
居群水平上,广西地区与广东地区花吊丝竹亲缘关系最近,遗传距离为0.012 8,遗传相似系数为0.987 2,亲缘关系最远,遗传距离为0.100 3,遗传相似系数为0.904 6。结果显示:居群间存在一定的遗传变异,但变异程度不会很大,具有较高的遗传相似性。
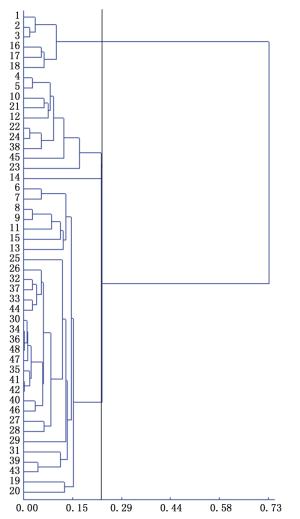
根据遗传距离采用UPGMA方法进行聚类,对扩增结果形成的基因型原始数据矩阵,利用SPSS13.0软件分析各竹种亲缘关系,建立ISSR种质和居群聚类图(图 1、图 2),48个花吊丝竹种质被划分为3组,3个花吊丝竹居群可分为2组。说明3种质间和居群间的遗传距离与地理距离及居群间的遗传分化程度无显著相关性。
2.1. ISSR标记位点多态性分析
2.2. 遗传多样性分析
2.3. 遗传变异分析
2.4. 遗传距离、亲缘关系分析及聚类分析
-
用于本论文的12条引物都能扩增较多的多态性位点,尤其是引物UBC828、UBC829扩增出的多态性位点占总数的88.89%,说明不同种质的花吊丝竹之间存在着丰富的遗传多样性。从遗传学角度看,遗传多样性越大其适应能力越强,进化能力也越强。
-
遗传多样性信息是良种选育过程中重要组成部分。本试验发现,花吊丝竹样本遗传多样性高于居群水平,该结果与Hu等[10]研究的野生唐古特大黄植物种源多态性百分比(PPB)为92.94%,种群PPB为46.51%一致。Na、Ne、He、I和PPB通常用来评价遗传多样性水平,如花吊丝竹样本遗传多样性水平(PPB= 82.26%, He=0.220 4)高于短寿命的多年生植物(PPB=40.00%, He=0.120 0)和复杂交配系统植物(PPB=40.00%, He=0.120 0)[11]。
在居群水平上,He为0.149 3~0.298 7,平均为0.206 6,这一结果稍高于Shah等[12]研究喜马拉雅密叶红豆杉的He值(0.115 6)和多年生植物杏子He平均值(0.173 8±0.193 0)[13]。I为0.215 0~0.438 8,平均为0.300 5,明显低于Alam等[14]对草本植物马齿苋研究的I值0.515。PPB为34.68%~75.81%,平均为50.27%,这一均值稍低于Nie等[15]研究的多年生草本植物(PPBs=55.67%)。因此,综合分析可知,花吊丝竹居群具有较低的遗传多样性水平。在其它植物中依然可以发现较低的遗传多样性水平,如喜马拉雅密叶红豆杉[16]和永瓣藤[17],它们居群的遗传多样性水平低于个体水平。遗传多样性最高的是福建地区,平均等位基因数(Na)= 1.758 1,平均有效等位基因(Ne)= 1.516 3,Ne’基因多样性指数(He)= 0.298 7,Shannon多样性指数(I)= 0.438 8,多态性百分比(PPB)= 75.81%,为引种福建居群的花吊丝竹至我国南方漳州东山等沿海沙地提供理论基础。
试验结果表明,花吊丝竹不同居群间的遗传多态性水平有较大差异,并且样本的遗传多样性水平高于居群水平。一方面,植物物种复杂的杂交系统被认为是影响遗传多样性水平的最主要因素[18];另一方面,主要地理因子纬度与遗传多样性水平有密切关联,温度越高可以促进种子萌发及植物生长,因此,可以增加物种间的遗传多态性水平;但是,花吊丝竹花期至今未有报道,且仅报道的大部分竹亚科植物花期范围为10~120年,并且此物种主要依靠营养生殖来繁衍后代。因此,本试验中,杂交系统不能成为决定遗传多样性水平的影响因子。
因此推断,影响试验结果有三个主要影响因素:第一,花吊丝竹是多年生植物,花期较长,在长期进化过程中可能会引起该物种的遗传多样性;第二,比起小范围分布区物种,广大分布范围物种具有更高的遗传多样性水平和变异程度[19],本试验研究的花吊丝竹生长地域集中在福建省、广西省和广东省,表明居群的大小与花吊丝竹遗传多样性水平的高低呈正相关;第三,尽管花吊丝竹属于无性繁殖植物,在长期的进化过程中,经过人工选择、相互引种后,遗传结构发生了能区别与其他居群的变异。
-
影响植物遗传结构的主要因素包括悠久的进化历程、广泛的地域分布和种群间的基因流动[20]。一方面,花吊丝竹居群间的遗传分化水平(Gst = 0.163 3)与草本植物肿柄菊的遗传分化水平[21](Gst=0.184 5)和多年生小乔木皂荚的遗传分化水平[25](Gst=0.252 1)相似,但稍高于李莹莹等[22]研究的毛茛科菏泽牡丹遗传分化系数(Gst = 0.125 2),表明花吊丝竹居群间存在中等程度的遗传变异。另一方面,花吊丝竹遗传变异主要发生在居群内(83.67%),16.33%存在于居群间,。因此可推断,地理位置分布对居群间遗传变异程度具有重要影响,且居群内遗传变异程度高于居群间遗传变异程度。此外,复杂的地域地形如距离、孤立的山头,会导致居群间的基因流受到限制,因此,促进居群分化水平[23]。Nm ≥ 1,则能发挥匀质化作用,在一定程度上抵制因遗传漂变而产生的居群遗传分化; Nm < 1,则表明基因流受限,遗传漂变可能是导致居群间明显遗传分化的主要原因[24]。本试验获得花吊丝竹居群间基因流Nm为2.526 1,表明花吊丝竹居群间存在较大基因流,很大程度减少居群间遗传差异,导致花吊丝竹居群遗传基础渐渐变窄且居群间遗传分化程度、遗传多样性水平低于居群内。
-
遗传距离和遗传相似系数是用来比较群体间或个体间相似程度的重要参数。48份花吊丝竹种质间遗传距离D为0~0.928 5,说明不同种质间花吊丝竹具有丰富遗传多样性,这也与上述的居群内遗传变异程度高于居群间水平相一致。遗传相似系数为0.395 2~1,可以看出,不同居群间的亲缘关系均较近。
不同居群的广东和广西聚为一类,它们间没有明显地理遗传背景,但花吊丝竹种质资源居群遗传结构具有一定的相似性,从研究整体结果看,花吊丝竹居群间亲缘关系与地理距离无明显相关性。分析其原因,可能是由于南方地形地貌复杂以及空间上大尺度隔离,会引起居群间基因流受阻,导致居群间遗传分化。再者,居群在各自封闭、独立的生长空间,可能会导致居群间遗传多样性与地理距离之间相关性不显著。
3.1. ISSR标记多态性分析
3.2. 遗传多样性分析
3.3. 遗传变异分析
3.4. 遗传距离、亲缘关系分析及聚类分析
-
本研究利用ISSR分子标记技术揭示了花吊丝竹居群的遗传多样性,该结果反映了花吊丝竹居群较高的遗传多样性水平。(1)ISSR分析表明:12条引物对48份样品扩增出124个位点,多态性位点为102个,多态位点百分比(PPB)为82.26%。(2)种质和居群水平Ne’基因多样性指数(He)分别为0.220 4和0.206 6,Shannon’s信息指数(I)分别为0.349 4和0.300 5,表明花吊丝竹居群间存在中等水平的遗传变异。(3)花吊丝竹不同居群间分化水平(Gst)= 0.163 3,表明16.33%的遗传变异存在于居群间,居群内的遗传变异为83.67%。(4)花吊丝竹居群间的基因流Nm为2.562 1,表明花吊丝竹居群间存在较大基因流,很大程度减少居群间遗传差异。(5)根据遗传距离的UPGMA聚类结果表明,48份种质可分为3组,3个居群可分为2组,居群间地理距离与亲缘关系无显著相关性。本研究为花吊丝竹防护林的保护策略提供重要的遗传信息。考虑到居群较低遗传多样性水平,引种更多群体的花吊丝竹可以增加它们各自群体间的基因交流和遗传多样性水平。因此,第一步要做的就是防止引种植物受到破坏;第二,优先引种具有较高遗传多样性的花吊丝竹。例如,福建地区的花吊丝竹具有最高的遗传多样性水平,因此,其应该优先引种至沿海沙地,因其具有更强的适应环境能力。



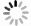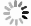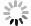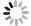
 DownLoad:
DownLoad: