-
南方红豆杉(Taxus chinensis var. mairer)又称紫杉,为红豆杉科(Taxaceae)红豆杉属(Taxus Linn.)植物,主要分布于中国南方地区,是红豆杉属中分布最广、生长最快的一群植物,为国家一级保护树种[1]。其本身含有的紫杉醇是红豆杉属植物的次生代谢产物,属四环二萜酰胺类化合物,不仅是一种对治疗肺癌、卵巢癌等有特效的抗癌药物,更是当前公认的广谱、活性强的一线抗肿瘤药物[2-4]。由于红豆杉生长较缓慢,资源贫乏,天然植物体内紫杉醇的量又非常低,要提供临床应用需要砍伐大量红豆杉林,危及生态平衡,使红豆杉植物面临灭绝[5]。目前,一种能提供抗肿瘤化合物的途径就是利用植物细胞组织培养法大规模培养生产紫杉醇[6]。
细胞培养具有原料丰富、大规模反应较易实现等优点,因此,成为工业化生产紫杉醇的最佳途径[7]。本研究以南方红豆杉愈伤组织为材料,通过单因素试验和正交试验,对南方红豆杉细胞悬浮培养体系进行优化,并对悬浮培养过程进行动力学分析,研究细胞生长、基质消耗及产物合成的动态变化,建立动力学模型,旨在为大规模培养红豆杉细胞、扩大紫杉醇生产奠定理论和实践基础。
HTML
-
南方红豆杉愈伤组织:南方红豆杉材料采自江西省奉新县澡溪乡杨坪村(28.7° N,115.38° E),该地区属中亚热带湿润气候,年平均气温为17.3℃;全年平均降水量为1 612 mm,年相对湿度平均为79%,无霜期年平均为260 d左右,年日照时数达1 803 h。以1年生枝条为外植体经诱导后获得愈伤组织,继代培养至5代以上[8];紫杉醇标准品(色谱纯):源叶生物科技有限公司;B5培养基:青岛海博生物;甲醇、乙腈(色谱纯):西陇科学。其他试剂均为国产分析纯。
-
Waters 2695高效液相色谱仪;KW-1000DC恒温水浴锅:江苏金坛市中大仪器厂;JW-3022HR高速冷冻离心机:安徽嘉文仪器装备有限公司;SW-CJ-1CU洁净工作台:苏净集团苏州安泰空气技术有限公司;LDZX-50KBS立式压力蒸气灭菌锅:上海申安医疗器械厂;UV765紫外-可见光分光光度计:上海精科仪器有限公司;1702分析天平:SARTORIUS GMBH GOTTINGEN;LRH-250-Gb光照培养箱:韶关市泰宏医疗器械有限公司;GZX-9023电热鼓风干燥箱:上海博迅实业有限公司医疗设备厂;KQ-500E型超声波清洗器:昆山市超声仪器有限公司;PHS-2型精密酸度计:上海雷磁仪表厂。
-
以B5为基本培养基,且含1.0 mg·L-1 6-KT、0.8 mg·L-1 NAA、0.6 mg·L-1 2, 4-D、30 g·L-1蔗糖,培养基初始pH5.8。愈伤组织接种量分别设置为0.03、0.06、0.09、0.12、0.15 g·mL-1。
-
以B5为基本培养基,且含1.0 mg·L-1 6-KT、0.8 mg·L-1 NAA、0.6 mg·L-1 2, 4-D、30 g·L-1蔗糖,愈伤组织接种量为0.09 g·mL-1。培养基初始pH值分别设置为2、4、5、6、7、8、10。
-
选择NAA、2, 4-D、6-KT 3种植物激素进行单因素试验,试验水平设计为:NAA(0、0.5、1.0、1.5、2.0 mg·L-1);2, 4-D(0、0.1、0.3、0.5、0.7 mg·L-1);6-KT(0、0.5、1.0、1.5、2.0 mg·L-1)。根据单因素实验结果,选择NAA、2, 4-D、6-KT为因素,进行L9(34)正交试验,根据细胞生长指数确定最佳植物激素配比。
以上培养条件均为装液量30 mL/250 mL三角瓶,(24±1)℃,120 r·min-1,每个处理3个重复,培养至第15天时收获,测定细胞鲜质量和细胞活力。
-
以1.3.1 1.3.3试验所得最佳悬浮培养体系培养细胞,装液量30 mL/250 mL三角瓶,(24±1)℃,120 r·min-1下培养,每3 d取样1次,每次3个重复,测定细胞活力、生物量和基质中营养物质。
-
细胞活力的测定采用TTC法[9],以485 nm下吸光值表示细胞活力。
-
残糖采用蒽酮法测定[10],还原糖含量用DNS法测定[11],硝态氮含量测定采用硫酸-水杨酸法测定[12],铵态氮含量采用苯酚-次氯酸盐法测定[13],磷酸根含量采用钼蓝比色法测定[14]。
-
愈伤组织于45℃烘干,粉碎过60目筛,精确称取愈伤组织干粉0.200 0 g,加入8 mL甲醇后55℃下超声提取30 min,5 000 r·min-1离心10 min,重复提取3次,合并上清液于45 ℃烘干;浸膏加入4 mL双蒸水后用4 mL二氯甲烷萃取2次,合并二氯甲烷,45℃烘干,加入1 mL甲醇复溶,过0.22 μm滤膜后使用Waters 2695高效液相色谱仪检测紫杉醇含量。色谱柱:依利特Hypersil ODS2柱(250 mm×4.6 mm),柱温30℃;流动相:甲醇-乙腈-水(36.5:27:36.5);流速:1.0 mL·min-1;进样量:15 μL;检测波长:227 nm。
-
采用Logistic方程来描述反应南方红豆杉细胞生长速率,紫杉醇合成动力学模型采用Leudeking-Piret表示,底物消耗可用Luedeking-Piret修正模型表示,分别参照薛文娇等[15]、朱晓媛等[16]、张阳阳等[17]的方法进行拟合。
-
数据采用DPS数据处理系统进行数据统计,误差分析采用Duncan新复极差法;作图及曲线拟合采用Origin 8.5.1软件。
1.1. 材料与试剂
1.2. 仪器与设备
1.3. 方法
1.3.1. 愈伤组织最佳接种量的筛选
1.3.2. 培养基最佳初始pH值的筛选
1.3.3. 植物激素正交试验设计
1.3.4. 悬浮细胞动态生长曲线的绘制
1.4. 测定指标及方法
1.4.1. 悬浮培养细胞生长指数的测定
1.4.2. 悬浮培养细胞活力的测定
1.4.3. 基质中营养物质的测定
1.4.4. 紫杉醇的提取与含量测定
1.4.5. 南方红豆杉悬浮细胞动力学模型拟合
1.4.6. 数据处理与统计分析
-
由图 1可知:愈伤组织接种量低于0.06 g·mL-1,悬浮细胞增长缓慢,随着接种量的增加,细胞生长指数逐渐增大,当接种量为0.09 g·mL-1时,细胞生长指数达到峰值,为132.80%;继续增加接种量时,细胞生长指数逐渐下降,随着接种量的增加,细胞活力也逐渐下降。
偏酸性条件下更有利于悬浮培养细胞的生长,细胞活力也处于一个较高水平;而过酸环境下,细胞活力较低。当培养基初始pH值为5.0和6.0时,细胞生长指数分别达156.48%和109.83%(图 1),根据相关研究,pH值为5.8时,有利于红豆杉细胞的生长,所以后续试验中的培养基初始pH值调整为5.8。
-
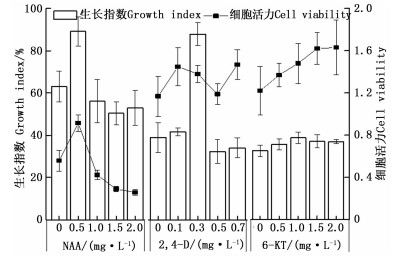
由图 2可知:单因素实验中,NAA、2, 4-D、6-KT的最适宜质量浓度分别为0.5、0.3、1.0 mg·L-1,且均表现为随着浓度的增加,细胞生长指数呈先增加后降低的趋势。以3种植物激素的单因素试验结果为基础进行正交试验,从表 1可知:3种植物激素的最佳配比为A1B3C3,即0.3 mg·L-1 NAA,0.4 mg·L-1 2, 4-D,1.2 mg·L-1 6-KT,3种植物激素对细胞生长指数影响的大小为6-KT>NAA>2, 4-D。
植物激素/(mg·L-1)
Phytohormones生长指数/%
Growth index细胞活力
Cell viabilityNAA 2, 4-D 6-KT 1 0.3 0.2 0.8 32.86±3.89 0.512±0.110 2 0.3 0.3 1.0 34.53±3.45 0.684±0.093 3 0.3 0.4 1.2 154.37±11.47 0.713±0.036 4 0.5 0.2 1.0 52.90±2.21 0.735±0.105 5 0.5 0.3 1.2 119.66±11.62 0.751±0.103 6 0.5 0.4 0.8 46.11±1.86 0.691±0.077 7 0.7 0.2 1.2 55.37±5.63 0.660±0.088 8 0.7 0.3 0.8 30.72±0.35 0.803±0.071 9 0.7 0.4 1.0 29.49±5.46 0.579±0.062 K1 73.92 69.56 36.64 K2 45.94 61.64 72.55 K3 33.23 38.19 108.69 R 37.28 26.61 75.46 Table 1. Results and analysis of orthogonal experiment
-
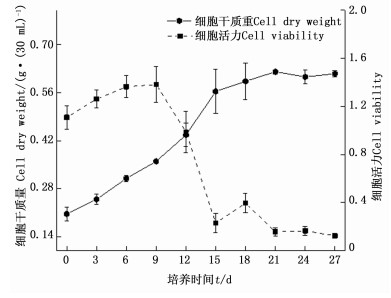
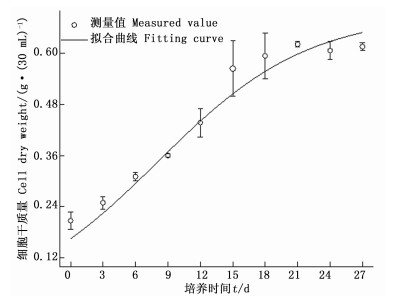
以B5+NAA 0.3 mg·L-1+2, 4-D 0.4 mg· L-1+6-KT 1.2 mg·L-1+蔗糖30 g·L-1为培养基,愈伤组织接种量为0.09 g·mL-1,初始pH5.8的悬浮培养体系培养南方红豆杉细胞,细胞生长曲线基本符合“S”型曲线,在培养前9天为延滞期,细胞干质量变化不明显;第9天至第18天为指数生长期,细胞迅速生长;18至21天为稳定期,第21天时细胞干质量达到峰值,为0.620 8 g·(30 mL)-1;其后细胞干质量逐渐下降,细胞进入衰亡期。细胞在培养的前几天活力逐渐增加,到第9天时达到最大值,细胞活力为1.383,而后一直呈现下降趋势(图 3)。
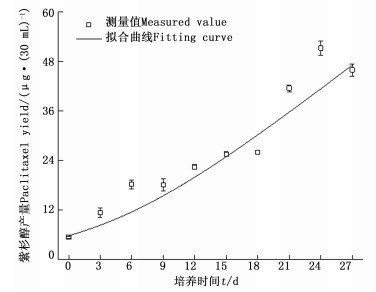
由图 4可知:在培养的第06天,细胞紫杉醇含量逐渐增加;第918天,紫杉醇含量略有下降;第1824天,紫杉醇含量迅速增加,第24天时到达峰值,紫杉醇含量为84.46 μg·g-1;2427天含量出现下降。紫杉醇的产量整体呈先上升后下降的趋势。第018天,紫杉醇产量增加缓慢;第1824天,产量迅速增加,第24天时到达峰值,紫杉醇产量为51.18 μg·(30 mL)-1;第2427天,紫杉醇产量开始下降。
-
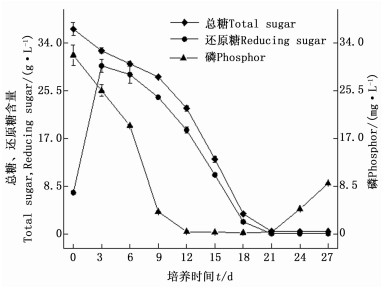
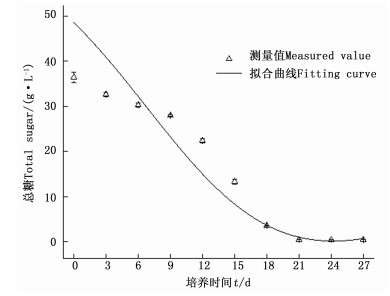
由图 5可知:糖作为培养基中的碳源,在整个培养周期中随时间进程下降。总糖浓度在第09天变化缓慢,在第921天消耗迅速,第18天时,糖浓度仅为3.63 g·L-1,消耗率达90.04%;第2124天,总糖基本消耗完全。还原糖作为直接碳源,其变化趋势与总糖变化趋势大致一致,其含量在培养的第03天迅速上升,在第3天时含量达到峰值,为29.94 g·L-1,第39天时缓慢下降,随后迅速消耗,在第21 d后基本消耗完全。磷酸盐的浓度在整个培养周期中随时间进程下降,其浓度在09天变化迅速,在912天浓度下降缓慢,第1221天时含量基本为0,到第21天,培养基中磷元素含量又缓慢升高。
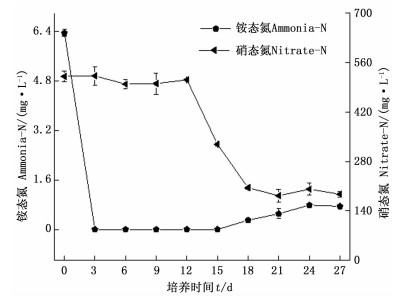
在细胞生长过程中,氮源的消耗速度较快,但铵态氮与硝态氮的吸收没有保持完全同步(图 6)。培养的第3天,铵态氮基本消耗完全,在培养的第18天以后,铵态氮含量缓慢上升;而硝态氮在第012天的消耗速率较小,消耗率仅为1.83%,第12天以后硝态氮才被迅速消耗,18天以后硝态氮含量基本保持不变。
-
本研究采用Logistic方程和Luedeking-piret方程描述了南方红豆杉细胞悬浮培养过程,建立了细胞生长、紫杉醇合成和基质消耗的动力学模型,运用Origin 8.5.1软件对数据进行非线性曲线拟合。
-
经拟合,得X0、Xmax和μmax3个参数分别为0.164 95 g·(30 mL)-1、0.690 98 g·(30 mL)-1、0.143 65 d-1;X0为细胞初始质量浓度,Xmax为可能的最大细胞质量浓度,μmax为最大比生长速率。模型R2=0.974 52, 得公式(1),拟合曲线见图 7。
-
经拟合,得m、n和P0 3个参数分别为14.755 34、2.827 75和5.818 58 μg·(30 mL)-1;m为生长偶联系数,n非生长偶联系数,P0为初始紫杉醇产量。模型R2=0.935 51得公式(2),拟合曲线见图 8;m≠0,n≠0,说明悬浮细胞生长与紫杉醇积累属于部分生长偶联型。
-
经拟合,得α、β和S0 3个参数分别为145.970 49、-1.885 4和48.541 42 g·L-1;α为碳源用于菌体生长得率常数,β为碳源用于产物积累得率常数,S0为初始碳源浓度。模型R2=0.880 16,得公式(3),拟合曲线见图 9。
2.1. 愈伤组织接种量、培养基初始pH对南方红豆杉悬浮培养细胞的影响
2.2. 植物激素类型及配比对南方红豆杉悬浮培养细胞生长的影响
2.3. 南方红豆杉细胞干质量、细胞活力、细胞紫杉醇含量和产量动态变化
2.4. 南方红豆杉细胞培养过程中基质消耗动态变化
2.5. 南方红豆杉细胞悬浮培养动力学模型及其参数估计
2.5.1. 细胞生长动力学模型
2.5.2. 紫杉醇生成动力学模型
2.5.3. 基质消耗动力学模型
-
建立红豆杉细胞悬浮体系是为了通过培养细胞生产紫杉醇,解决紫杉醇药源问题[18]。本试验通过对南方红豆杉悬浮培养条件的研究,建立了南方红豆杉细胞悬浮培养体系。
研究发现,接种量对悬浮细胞的生长有较大影响,植物细胞需在一定密度下才能启动生长,其内源代谢物质必须达到一定的阀值才能维持细胞的分裂和生长,在有高密度细胞群和营养丰富的情况下,易于达到这种阀值[19]。如果接种量太低,则细胞间距过大,使细胞间的物质交换不充分,不利于细胞的生长;细胞浓度过高,密度太大,培养基营养易快速消耗而使细胞死亡[20]。接种量越大,细胞活力越低,可能是细胞大量增殖分裂,营养消耗快,部分细胞出现了衰败,细胞活力因而降低。适宜的接种量不仅能较好启动细胞的生长,且对营养物质的消耗适宜[21]。本研究中,当细胞接种量为0.09 g·L-1时有利于悬浮细胞的生长,过低或过高均不利于细胞生长和细胞活性。
pH值对植物细胞会产生诸多影响,包括引起质膜通透性变化,影响植物细胞对物质的吸收和代谢等,进而影响外植体的脱分化增殖器官形成以及细胞次生代谢产物的含量[22]。盛长忠等[23]研究发现,培养基pH值在5.56.0是最有利于红豆杉愈伤组织生长。陈继光等[24]研究结果显示,青钱柳细胞适合在酸性条件下生长,当pH大于6时,细胞增长量降低,同时细胞活力也降低。本试验中,培养基初始pH值为5.8,适合南方红豆杉细胞生长。
植物细胞在离体悬浮培养过程中,必须通过添加外源激素来促进细胞的生长[25]。植物激素能够促进植物细胞的生长和繁殖,但是较高浓度激素反而会对细胞生长起抑制作用,植物激素类型和配比是悬浮体系建立成功与否的关键,合适的植物激素种类和浓度,可以使细胞快速增殖,同时保持较高的细胞活力[26]。本试验表明,0.3 mg·L-1NAA+0.4 mg·L-12, 4-D+1.2 mg·L-16-KT的激素配比适合南方红豆杉细胞的生长,对细胞生长指数影响的大小为6-KT>NAA>2, 4-D。
蔗糖作为碳源,为细胞的生命活动及其增殖提供必要的物质,植物细胞中没有吸收和转运蔗糖的系统,培养液中的蔗糖必须先经转化酶分解成葡萄糖和果糖等还原糖,才被细胞吸收利用,所以培养液中的还原糖含量在培养初期迅速增加。氮和磷主要用于合成细胞生长所需的结构蛋白和次生代谢途径中的一些酶[27]。NH4+和NO3-是培养基的主要氮源,主要用于合成细胞生长所需的结构蛋白[28]。指数生长期,细胞开始合成次生代谢物,代谢途径中酶的合成需要消耗氮源。在培养的前期,铵态氮比硝态氮的吸收速度快,其原因可能是细胞生长所需的蛋白质的合成与铵态氮密切相关,而紫杉醇等次生代谢产物合成可能与硝态氮有关。细胞生长初期磷元素开始就迅速下降,直至完全消耗,培养后期磷元素含量又逐渐上升,可能是细胞在培养初期就快速吸收磷用于合成核酸和生物膜,当细胞培养进入稳定期后部分细胞开始凋亡,细胞中的磷进入培养液中而使磷含量上升。
动力学研究可深入了解细胞培养系统的动态变化以及生物体与周围环境的相互作用,基于动态了解,测定重要的动力学参数,有助于优化与放大过程[29]。经过拟合后得到南方红豆杉悬浮细胞生长动力学模型、紫杉醇合成动力学模型、底物消耗动力学模型,各模型拟合的相关系数分别为0.974 52、0.935 51、0.880 16,拟合结果良好,证明所建模型可以较好地反映出南方红豆杉悬浮细胞生长、紫杉醇合成、底物消耗的变化规律。
-
本研究优化了培养条件,系统地建立了南方红豆杉细胞悬浮培养体系。取继代培养5代以上的疏松愈伤组织进行悬浮培养生产紫杉醇,通过模型的回归拟合,获得了反映南方红豆杉细胞培养的动力学参数,试验所构建的发酵动力学模型在一定程度上揭示了南方红豆杉细胞产紫杉醇代谢过程的特征,这对于培养过程优化、代谢产物的调控和扩大培养起着重要作用,对工业化生产紫杉醇也将产生促进作用,具有重要的理论和实践意义。














 DownLoad:
DownLoad: