-
麻疯树(Jatropha curcas L.)为大戟科灌木或小乔木,其种子含油量高(可达60%),且所含的油适合做工业用油,在发展生物柴油产业方面具有巨大潜力[1-2],因此,麻疯树被看作是一种优良的能源植物。麻疯树为雌雄同株异花植物,雌雄花比例的悬殊(1:10~1:30)导致了挂果率低,种子产量低下是限制这种优良能源植物开发的重要因子之一。从分子生物学层次研究麻疯树雌雄花比例低的现象,有助于人们对这一问题有更深刻的认识,从而为提高麻疯树种子产量,加快麻疯树产业化的进度提供有价值的线索。为此,笔者建立了麻疯树大小孢子和雌雄配子体发育过程的基因表达谱,并从差异表达的基因中筛选到了一个富亮氨酸重复序列类受体激酶(LRR-RLKs)家族成员油菜素内酯受体BRI1的同源基因(命名为JcBRI1)。
植物LRR-RLKs是一类含跨膜结构的类受体激酶,参与植物激素信号传递途径[3]以及外源微生物免疫应答[4],通过引起一系列的磷酸化及去磷酸化作用[5],将胞外信号传递到胞内使相应的基因作出反应从而调控植物的生长发育。作为一个典型的LRR-RLK,BRI1含有一个跨膜结构,在胞外的25个LxxLxLxxN/CxL保守序列的LRR串联中第21~22个LRR之间含有一段由70个氨基酸组成的BRs结合结构域,胞内为丝氨酸/苏氨酸活性位点结构域[6]。BRs信号转导起始于BRI1-BL-BAK1三元复合物的形成,BAK1也是一个LRR-RLK,研究表明,BAK1也参与了众多植物激素类受体激酶的磷酸化过程[7],这就暗示了BR信号通路可以通过BAK1作为共同受体使其与其它的信号通路的相互联系与协调成为可能。最近的研究还发现,BRI1和BAK1能够与G蛋白相互作用,参与调节糖响应的植物生长和发育过程[8]。
前人的许多研究都表明,BR信号途径在花的发育过程中扮演着重要角色,Singh等在拟南芥中异源过表达了小麦油菜素内酯受体基因TaBRI1,结果导致了拟南芥转植株早花现象[9];Huang等研究了外源油菜素内酯对非洲菊花发育的影响,结果表明,外源BR能显著促进花瓣的伸长[10];Nie等在番茄中过表达了SlBRI1基因,结果增加了花的大小[11]。尽管先前的研究表明BR在花发育有着重要作用,但是对于其在调控雌雄配子体的形成却鲜有报道,而BRI1作为BR的受体,其在BR信号途径中的重要性是毋庸置疑的。
本研究利用RT-PCR克隆了JcBRI1基因的CDS,构建了其原核表达载体,利用LC-MS/MS技术对该基因的原核表达产物进行了鉴定,并且采用生物信息学手段对该蛋白的结构和功能进行了分析;利用实时荧光定量PCR分析了JcBRI1在麻疯树花发育不同时期的花蕾中的表达水平,为揭示麻疯树雌雄花形成机理提供一些理论依据。
HTML
-
供试材料麻疯树花蕾采集自贵州省黔西南贞丰县种植的麻疯树,置于非冻型组织RNA保存液中,平衡48 h。实验室前期利用电镜与石蜡切片技术确定了麻疯树花蕾各个关键发育时期的参数(表 1),按照该标准对不同时期的花器官进行分类,随后保存于-80℃冰箱中备用。
发育时期Developmental stages 参数Parameter 未分化时期Undifferentiation stage 花蕾大小0.15 mm Bud size 0.15 mm ♀大孢子母细胞时期Megasporocyte stage 子房大小约0.80 mm Ovary size 0.80 mm ♀大孢子母细胞分裂期The meiosis of megasporocyte 子房大小约1.20 mm Ovary size 1.20 mm ♀单核胚囊期Embryo sac stage 子房大小约1.50 mm Ovary size 1.50 mm ♀胚囊成熟期Mature embryo stag 子房大小约3.20 mm Ovary size 3.20 mm ♂小孢子母细胞时期Microsporocyte stage 花蕾大小约0.52 mm Bud size 0.52 mm ♂四分体时期Microspore tetrad stage 花蕾大小约1.10 mm Bud size 1.10 mm ♂单核花粉粒时期Single nucleus pollen stage 花蕾大小约2.00 mm Bud size 2.00 mm ♂花粉粒成熟期Pollen maturation stage 花蕾大小约3.00 mm Bud size 3.00 mm Table 1. Parameters of key developmental stages of Jatropha curcas buds
-
取任一发育时期的花蕾,使用Bio-Tek公司的OMEGA Plant RNA Mini Kit进行总RNA的提取,提取方法参照说明书。使用Thermo ND2000超微量核酸蛋白测定仪对提取的总RNA进行质量及浓度检测,采用RevertAid First Strand cDNA Synthesis Kit(Thermo)合成cDNA第一链,具体方法见试剂盒说明书。
-
根据从转录组数据差异基因中筛选到的BRI1基因片段的序列,利用在线工具CDS Finder获得该基因完整的编码框序列,使用Primer Premier 6设计引物JcBRI1-F/JcBRI1-R,引物序列见表 2。使用延伸性及保真度较高的GXL酶(TaKaRa)进行扩增,PCR反应体系为:1 μL TaKaRa GXL酶、10 μL 5× GXL Buffer、4 μL dNTP Mixture、1 μL cDNA、上下游引物JcBRI1-F/JcBRI1-R各1 μL,灭菌水补足至50 μL。PCR反应程序:98℃ 10 s, 55℃15 s, 68℃40s,30个循环。PCR产物经琼脂糖凝胶电泳检测后使用TaKaRa Mini Best Agarose Gel DNA Extraction Kit Ver.4.0进行回收纯化,加A处理后与pMD19-T于16℃连接过夜,转化至大肠杆菌DH5α,挑取阳性菌落送至上海生工生物工程股份有限公司进行测序验证。
引物名称
Primer name核苷酸序列(5′→3′)
Primer Sequence(5′→3′)用途
UsesJcBRI1-F ATGAAAACCCATTTCTCTCTTTTGC CDS克隆 JcBRI1-R CTACTGCTTGCCTGGTTCAGGGT CT CDS克隆 QJcBRI1-F TGTGGAGCAGGATCAGGTTCAA qRT-PCR QJcBRI1-R GCTTCCGCAATGGCTTCTCAA qRT-PCR JcActin-F TGTGAAGTCCAGCGTGTGCGATA qRT-PCR(内参) JcActin-R GCGACGGAACATGGCTGTGAATT qRT-PCR(内参) JcTubulin-F CTCTGCAACTATGAGTGGTGTAACG qRT-PCR(内参) JcTubulin-R CACGAGAAGTAAGTGGGGCAAA qRT-PCR(内参) JcBRI1yb-F CGCCATATGTCACCATTATCGCCACCTTTTATCT 原核表达载体构建 JcBRI1yb-R CCCAAGCTTGCCTGAATTGTTGGCAAAACTAGAA 原核表达载体构建 Table 2. Primers sequences and ways of use in this study
-
生物信息学分析表明:JcBRI1蛋白N末端存在信号肽序列,并且含有一段跨膜区,在真核细胞体内,信号肽会随着蛋白质的成熟而被切除,信号肽的存在会使蛋白没有活性,所以在原核重组表达设计上会把信号肽序列切除;强疏水的跨膜区,会嵌合在膜内,胞外受体功能与之关联较小,跨膜区不形成抗原决定簇,会减弱蛋白整体的免疫原性,并且强疏水肽段和原核代谢原件相互作用,导致蛋白不表达,因此实验设计上只表达JcBRI1蛋白胞外区域,共计2 223个碱基,预计编码741个氨基酸。选择pET-30a(+)质粒为框架,构建重组原核表达载体。使用Oligo7软件对JcBRI1基因CDS与pET-30a(+)的限制性酶切位点进行分析,并设计引物(表 2)。使用GXL高保真酶(Takara)扩增JcBRI1胞外部分的DNA序列片段,回收纯化后与pET-30a(+)一同使用限制性内切酶Nde Ⅰ和Hind Ⅲ进行消化,使用T4 DNA连接酶于16℃连接过夜,随后转化至大肠杆菌DH5α,挑取阳性菌落送至上海生工生物工程股份有限公司进行测序验证。取测序验证正确的菌株进行质粒提取,将提取出来的重组载体pET-30a/JcBRI1分别转化大肠杆菌BL21(DE3)和Rosetta(DE3)感受态细胞,挑取单菌落于含50 μg·mL-1硫酸卡那霉素的LB培养基中37℃ 200 rpm过夜培养,对于Rosetta(DE3)还需加入20 μg·mL-1的氯霉素。以1:100的接种量将过夜培养物于37℃培养至OD600=0.5~0.8,加入终浓度为0.1 mmol·L-1的IPTG,之后分别置于15℃和37℃诱导培养20 h,随后进行SDS-PAGE分析。
-
将含有目的条带的SDS-PAGE胶条切下,脱水脱色后使用胰蛋白酶进行胶内酶解后再抽提出肽段制成冻干粉。将干粉重新溶解于5 μL含0.1%TFA的溶液中,随后以1:1的比例与含50%ACN和1%TFA的α-氰基-4-羟基肉桂酸饱和溶液混合制成上样液。取1 μL上样液进行质谱点靶鉴定,仪器为ABI 4800 MALDI-TOF/TOF串联质谱仪(ABI),将一级和二级质谱数据整合并使用GPS 3.6(Applied Biosystems)和Mascot2.3(Matrix Science)对质谱数据进行分析和蛋白鉴定。
-
使用在线工具SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对麻疯树JcBRI1蛋白是否存在信号肽进行预测分析;利用在线工具NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)对麻疯树JcBRI1蛋白磷酸化位点进行分析;使用GOR4在线工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)对麻疯树JcBRI1蛋白的二级结构进行预测分析;使用TMHMM Server V.2.0在线工具(hwz ttp://www.cbs.dtu.dk/services/TMHMM-2.0/ opennewwindow)对JcBRI1蛋白的跨膜结构进行预测。对JcBRI1的氨基酸序列进行分析,与拟南芥等模式植物已发表报道的BRI1进行多重序列比对,并Blast与其结构域同源性较高的蛋白序列,运用Clustal X 2.1软件进行多重序列比对,然后采用MEGA 6.0软件选择Neighbor-joining方法,Bootstrap分析重复数为1 000,构建系统发育树。蛋白质三级结构预测则采用Phyre2工具(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行,并对模型进行评估。
-
提取麻疯树花蕾9个关键发育时期的总RNA,定性及定量分析检测后反转录合成cDNA第一链。利用Primer Premier 6设计荧光定量PCR引物(表 2),内参基因为β-Actin和Tubulin,以FX96TMreal-time system作为荧光定量PCR反应平台,反应体系为:SYBRⓇ Select Master Mix (Thermo) 10 μL、cDNA模板1 μL、上下游引物各1 μL, 灭菌水补足至20 μL。设置反应程序为95℃预变性2 min,95℃变性15 s,58℃退火15 s,72℃延伸1 min,40个循环;每个循环结束后进行荧光信号采集,所有循环结束后进行熔解曲线分析(65~95℃)。每个样品设置3个技术重复与3个生物重复,以麻疯树花蕾未分化时期为对照组,采用2-ΔΔCT法计算基因的相对表达量(2个内参基因的Ct值取几何平均数),使用SPSS 19.0软件进行单因素方差分析(One-way ANOVA)。
1.1. 植物材料及处理
1.2. 总RNA提取及cDNA第一链的合成
1.3. 麻疯树JcBRI1基因CDS的克隆
1.4. 原核表达载体构建及诱导表达
1.5. 蛋白质酶解及质谱鉴定
1.6. 蛋白质结构分析
1.7. JcBRI1基因时空表达分析
-
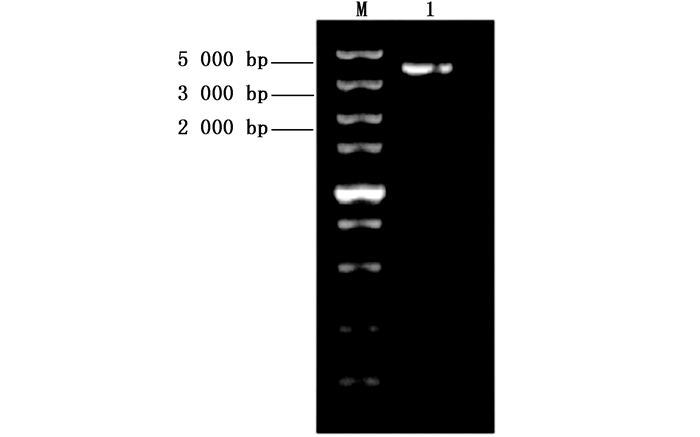
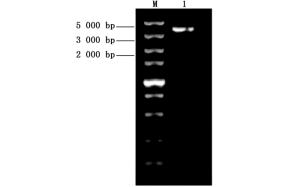
利用RT-PCR扩增麻疯树JcBRI1基因的CDS,经琼脂糖凝胶电泳检测后如图 2所示,目的条带大小与预期一致,测序结果表明:JcBRI1基因CDS长度为3 591 bp,预计编码1 196个氨基酸,理论蛋白分子量约为130.5 kDa,理论等电点为6.63。
-
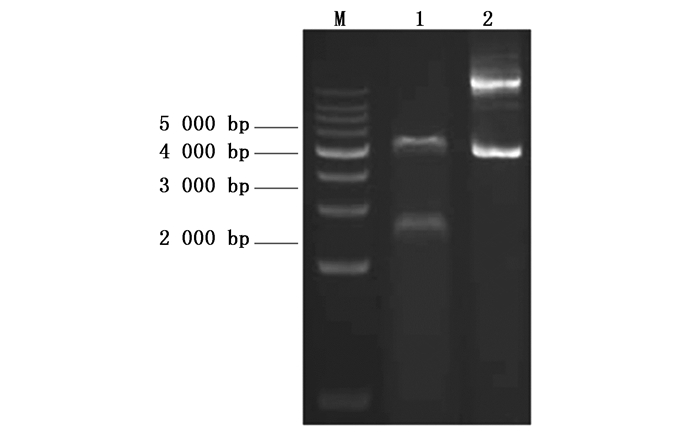
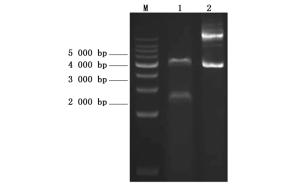
取测序验证正确的菌株进行质粒提取,使用限制性内切酶Nde Ⅰ和Hind Ⅲ进行酶切再验证,随后用琼脂糖凝胶电泳检测。结果如图 3所示。
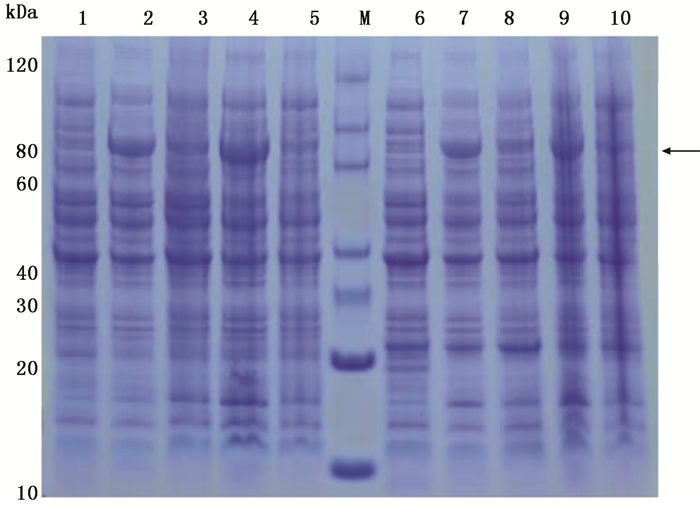
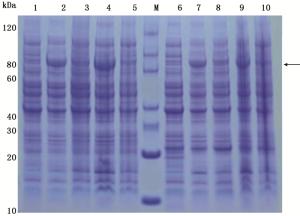
以pET-30a(+)质粒为框架,构建重组原核表达载体pET-30a/JcBRI1,将pET-30a/JcBRI1转化至大肠杆菌BL21(DE3)和Rosetta(DE3)感受态细胞中,15℃与37℃诱导20 h后收集菌体进行SDS-PAGE分析。结果如图 4所示,在80 kDa左右位置的条带就是JcBRI1的原核表达产物;JcBRI1基因在大肠杆菌BL21(DE3)和Rosetta(DE3)中均能表达,但在低温条件时表达量相对更高一些。
-
将SDS-PAGE胶中的目的条带切下,胶内酶解后进行质谱检测与蛋白鉴定,并将数据上传至Mascot2.3软件分析鉴定。结果表明:共有27条特异的肽段与JcBRI1蛋白(A0A067KGQ9)氨基酸序列匹配上,蛋白得分为615,这表明JcBRI1在原核表达系统得到表达,表达产物就是JcBRI1蛋白(表 3)。
编号NO. 启始序列Start Seq 终止序列End Seq 序列Sequence 1 54 59 CQETNR 2 621 627 HPCNFTR 3 359 366 SLDFSFNK 4 541 549 IPPELGDCR 5 204 212 GDLDFSNCK 6 532 540 LSNNSFYGR 7 586 593 YVYLKNMK 8 513 523 LTGEIPASIGK 9 20 28 DTQNLINFK 10 367 377 LIGGLPNSLSK 11 503 512 LNWISLSNNR 12 701 711 LEGQIPQSMTK 13 202 212 VRGDLDFSNCK 14 572 584 QSGNIAVNFFPGK 15 94 108 SSNISGLISFPSGSK 16 162 174 LTNLESFDLSFNK 17 572 585 QSGNIAVNFFPGKR 18 141 154 SLNLSFNSLDFSLK 19 594 610 SEWCHGEGNLLEFAGIR 20 157 174 SSGLKLTNLESFDLSFNK 21 175 193 IIGTNVVPFILTGGCNELR 22 534 549 LSNNSFYGRIPPELGDCR 23 2 19 HHHHHHSPLSPPFISTNR 24 1 19 MHHHHHHSPLSPPFISTNR 25 591 610 NMKSEWCHGEGNLLEFAGIR 26 378 408 LTNLESLDLSSNNLSGSIPTGLCQDPSNNLK 27 628 659 VYGGHTQPTFNDNGSMIFLDLSYNMLSGSIPK Table 3. JcBRI1 protein mass spectrometry identification results
-
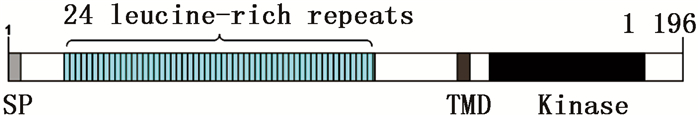
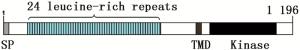
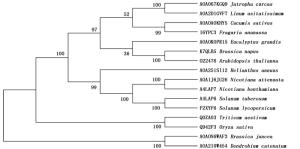
利用GOR4在线工具分析JcBRI1蛋白的二级结构,结果表明:379个氨基酸参与了α螺旋的形成,所占比例为31.69%;155个氨基酸参与形成延伸链,比例为12.96%;662个氨基酸形成了无规则卷曲,占总比例的55.35%。磷酸化位点结果分析表明:JcBRI1蛋白含有88个丝氨酸(Ser)活性位点、34个苏氨酸(Thr)活性位点以及7个酪氨酸(Tyr)活性位点。信号肽及跨膜结构预测结果表明:JcBRI1蛋白N末端第1位氨基酸至第23位氨基酸为信号肽序列。对JcBRI1蛋白的跨膜结构分析结果表明:该蛋白存在跨膜区域,第1~795位氨基酸形成胞外结构;第796~818位氨基酸位于细胞膜上,构成跨膜结构;第819~1 196位氨基酸位于胞内,形成该蛋白的功能域,在这个区域内有丝氨酸/苏氨酸活性结构域。Uniport数据库检索麻疯树JcBRI1蛋白(A0A067KGQ9),结果表明:JcBRI1蛋白为丝氨酸/苏氨酸活性位点蛋白激酶家族成员,结构域位于853~1 128位氨基酸之间。对其氨基酸序列进行分析,结果显示:JcBRI1蛋白胞外区域含有24个富含亮氨酸重复序列(LRR),并且具有保守重复序列:LxxLxLxxN/CxL(图 5)。将JcBRI1与拟南芥等模式植物的BRI1进行氨基酸多重序列比对,结果(图 6)显示:麻疯树JcBRI1蛋白与拟南芥等模式植物的BRI1蛋白具有较高的同源性,进化树结果(图 7)显示了麻疯树JcBRI1蛋白与亚麻BRI1蛋白归为一支,表明二者在进化历程中的亲缘关系较近。
-
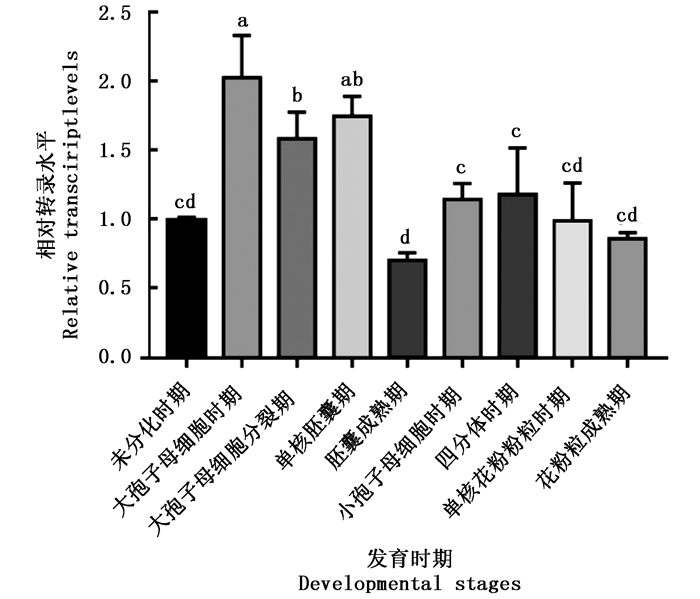
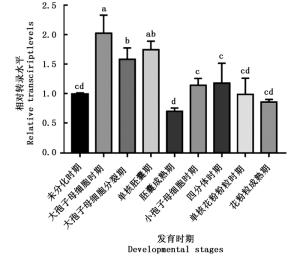
以麻疯树花蕾未分化时期为对照组,利用qRT-PCR检测JcBRI1基因在雌雄花不同发育时期的转录水平。结果(图 8)表明:JcBRI1基因在雌花中的转录水平在大孢子母细胞时期有显著的提高,在随后几个时期的转录水平便持续下降,总体上其在雌花发育过程的转录水平是提高的。相较于雌花,JcBRI1在雄花各个发育时期的转录水平并无特别明显的变化。对比JcBRI1基因在雌花和雄花中转录水平变化的差异,暗示了麻疯树JcBRI1介导的内源油菜素内酯途径可能在雌花发育过程中起到一定的促进作用,尽管其中的调控机制还是未知的。
2.1. 不同发育时期的麻疯树花蕾
2.2. 麻疯树JcBRI1基因CDS的克隆
2.3. 原核表达载体鉴定及表达分析
2.4. 蛋白质质谱鉴定结果
2.5. 蛋白质结构分析
2.6. JcBRI1基因时空表达分析结果
-
麻疯树为雌雄同株异花植物,雌花发育需经历雌雄同体的两性状态,在3个心皮融合成子房后,雄蕊停止发育,并最终退化;而雄花发育不需经历一个两性时期,在其发育历程中自始至终没有雌性性器官原基的发生[12]。目前,关于麻疯树花性别分化的研究已经有了报道,而麻疯树大小孢子发生和雌雄配子体发育机制方面的研究鲜有报道。
BR广泛分布于植物体内,参与细胞伸长与分裂、维管束分化、叶片形态发生、植物育性等方面的调控[13-16]。在BR信号通路中,BRI1主要负责结合BR传递信号;BRI1与BR的结合诱导自身磷酸化后,与BAK1结合形成BRI1LRR-BR-BAK1LRR三元复合物[17],接着通过中间途径的激酶和磷酸酶的顺序作用, 并将BR信号继续传递下去激活了转录因子BES1和BZR1,随后BES1和BZR1进入细胞核调控相应靶基因的转录[18-21]。大量研究表明,BRI1介导的BR信号途径在植物花发育过程的作用是至关重要的,作为BR在细胞膜上的受体,BRI1在花发育中的作用也被一些研究所证实。Bouquin等发现,拟南芥bri1突变体不仅表现出晚花表型,而且雄性不育,暗示了BRI1在植物开花时间的调控和雄花发育中的重要性[22]。Domagalska等也发现,拟南芥bri1突变体表现出晚花的特点,通过进一步研究发现,BRI1基因可以通过调控FLC基因的表达从而影响开花时间[23]。Ye等发现,在拟南芥中BR可以通过转录因子BES1来调控SPL/NZZ、TDF1、AMS、MYB103、MS2和MS1的表达来影响花粉和花药的发育,并且在拟南芥spl/nzz突变体中BRI1的表达量比野生型高3倍,暗示了BRI1参与BR反馈调控机制来影响花粉和花药的发育。此外还发现,BR相关突变体的雌性和雄性器官长度的减少可能是导致雄性不育的原因[24]。这些研究表明了油菜素内酯信号途径在雄花发育中的重要性。
本研究从麻疯树花发育的转录组中筛选到一个性别差异表达的LRR-RLKs家族基因BRI1的同源基因——JcBRI1,对其原核表达产物用二级质谱鉴定,结果显示,该蛋白为麻疯树油菜素内酯受体BRI1蛋白,是一个典型的LRR-RLKs类受体激酶,有一个跨膜段,胞外区域含有24个富含亮氨酸重复序列(LRR),胞内区域有丝氨酸/苏氨酸活性结构域。通过对其在麻疯树花发育过程中的表达模式分析表明,JcBRI1很可能参与了麻疯树雌花大孢子母细胞的发育过程。虽然有些研究表明BRI1具有参与调控雄花发育的潜力,但有关于其在雌花发育过程中的作用还不见报道。油菜素内酯可抑制黄瓜雌花的发育,却可增加拟南芥胚珠的数量[25-26],所以,JcBRI1参与了麻疯树雌花的发育也不是不可能。本研究结果还不足以说明JcBRI1基因参与了麻疯树雌花的发育,但本研究的发现很值得进一步深入研究,这将为研究油菜素內酯信号途径在麻疯树花发育中的影响提供了一个有价值的线索。
-
本研究的结果表明:JcBRI1和其介导的BR信号很可能参与了麻疯树雌花大孢子母细胞的发育过程。目前还没有充足的证据表明JcBRI1与麻疯树雌花大孢子母细胞的发育有关,还需要进一步的实验来分析和揭示该基因在麻疯树雌花大孢子母细胞的发育中的具体作用和地位。







 DownLoad:
DownLoad: