-
沙棘(Hippophae rhamnoides L.)是胡颓子科沙棘属的一种雌雄异株的灌木或小乔木,耐旱性和耐寒性良好。沙棘果实具有独特的药用和营养价值,在中国和俄罗斯有上百年的药用历史[1]。沙棘果实富含维生素、有机酸、氨基酸、脂肪酸、抗氧化剂和类黄酮[2-4],在炎症性疾病、肝脏性疾病、动脉粥样硬化等疾病的治疗以及保护心脏等方面具有显著功效[5]。在沙棘种子含有的众多脂肪酸中,α-亚麻酸(α-Linolenic acid,C18:3N3)的含量十分丰富,且α-亚麻酸对大脑发育、心血管健康、炎症治疗等都具有重要作用[6-9],但α-亚麻酸是人体必需脂肪酸,不能在人体内合成,只能通过食物摄取。豆油、花生油等常见植物食用油中的主要脂肪酸为油酸、亚油酸、棕榈酸和硬脂酸[10-11],α-亚麻酸含量极低,而沙棘中高积累20.3%~36.3%的α-亚麻酸[12],并且沙棘作为耐旱木本植物可以在沙地、荒山、盐碱地等边际土地生长,可避免与大田油料作物争夺土地,是理想的α-亚麻酸供给对象。
目前,油料作物脂肪酸合成途径及调控基因的研究较多,在沙棘的相关研究中多围绕脂肪酸组分及脂肪酸测定方法展开,少有针对沙棘中α-亚麻酸合成机制的研究。本研究选取α-亚麻酸含量存在差异的2个沙棘品种种子,对其含量差异及相关基因进行分析,在基因表达水平上研究沙棘中α-亚麻酸合成及代谢规律,为培育高α-亚麻酸含量的沙棘良种奠定理论基础。
HTML
-
沙棘种子采自中国林业科学研究院沙漠林业实验中心(内蒙古磴口县),2个沙棘品种——蒙古大果沙棘向阳(Hippophae rhamnoides ‘Mongolia’)(XY)和中国沙棘丰宁(H. rhamnoides ‘Sinensis’)(FN)的种子分别采自3个不同的发育时期,依次为未成熟期(T1)、半成熟期(T2)和成熟期(T3),在这3个时期沙棘种子的种皮颜色依次呈现为白色、黑白相间斑点色、黑色。因沙棘种皮与果皮的转色期基本一致,为保证时期界定更加精准,同时利用色差计测量沙棘果皮的红绿色指标 a 值和黄蓝指标 b 值,计算色泽比(h=a/b),种皮呈白色且果皮h值介于−0.18~−0.10的界定为T1时期,种皮呈黑白相间斑点色且果皮h值介于0.20~0.28的界定为T2时期,种皮呈黑色且果皮h值介于0.52~0.60的界定为T3时期。沙棘果实采集后快速将种子从果实中剥离,放入液氮中进行速冻,然后转移至−80℃冰箱长久保存,用于下一步分析。
-
将样品冰上解冻,取50 mg样品于2 mL离心管中。加入1 mL的氯仿甲醇(2:1 v/v)溶液,超声30 min。取上清液,加入1%硫酸甲醇溶液2 mL,80℃水浴,甲酯化30 min,随后加入1 mL的正己烷萃取,5 mL的纯水洗涤。吸取上清液500 μL,加入25 μL的水杨酸甲酯(500 mg·L−1)作为内标,混匀加入进样瓶,进样量1 μL,分流比 10∶1,分流进样,进行GC-MS 检测。
-
样品采用 AgilentDB-WAX 毛细管柱(30 m×0.25 mmID×0.25 μm)气相色谱系统进行分离。程序升温:初始温度为 50℃,保持 3 min,随后以10℃·min−1的速度升温至220℃并维持 20 min。载气为氦气,载气流速1.0 mL·min−1。样本队列中每间隔6个实验样本设置1个QC样本,用于检测和评价系统的稳定性及重复性。采用 Agilent7890A/5975C 气-质联用仪进行质谱分析。进样口温度 280℃,离子源温度230℃,传输线温度250℃。电子轰击电离(EI)源,SIM 扫描方式,电子能量70 eV。采用 MSDChemStation 软件提取色谱峰面积及保留时间。绘制标准曲线,计算样品中中长链脂肪酸的含量。
-
按照Qingen(Qingen,DE)试剂盒[13]操作说明对样品中的总RNA进行提取,并去除总RNA中DNA片段的残留。分别使用NanoPhotometer 分光光度仪、Qbuit 2.0 荧光计和Qubit RNA 检测试剂盒以及Agilent 2100和RNA Nano 6000试剂盒检测RNA纯度、RNA浓度以及RNA完整性。RNA检测合格后进行文库制备。使用Illumina HiSeq 2000 对RNA文库进行测序,获得原始测序数据。为了保证测序数据质量,对原始数据进行过滤,从而获得高质量数据(Clean data),用于后续生物信息分析。首先使用DESeq R(1.18.0)[14]进行基因表达量分析,筛选差异表达基因,然后通过GOseq R数据包[15]和KOBAS(2.0)[16]分别对差异表达基因进行GO功能注释和KEGG通路分析。
2.1. 脂肪酸提取
2.2. 色谱-质谱分析
2.3. 转录组测序分析
-
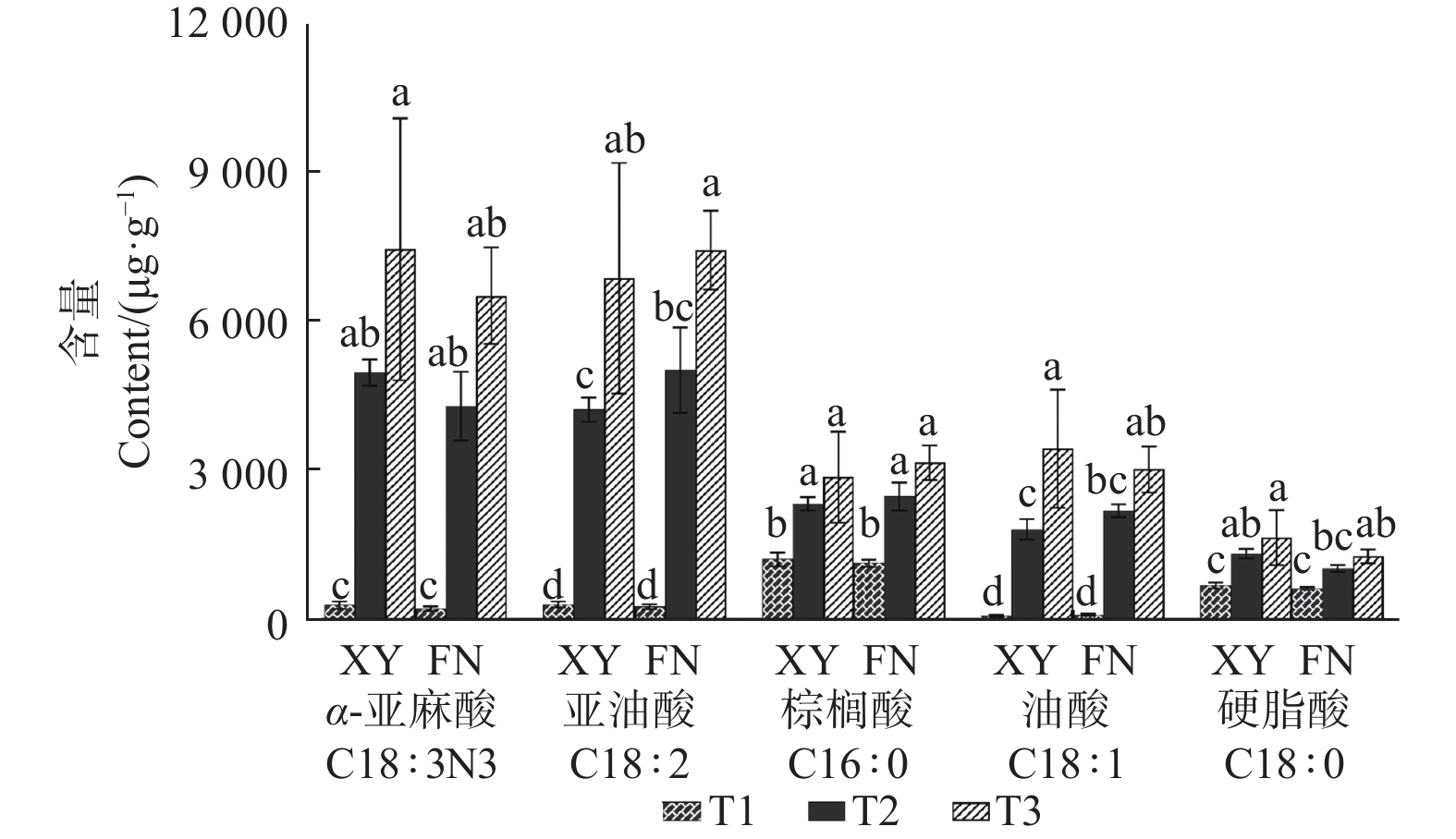
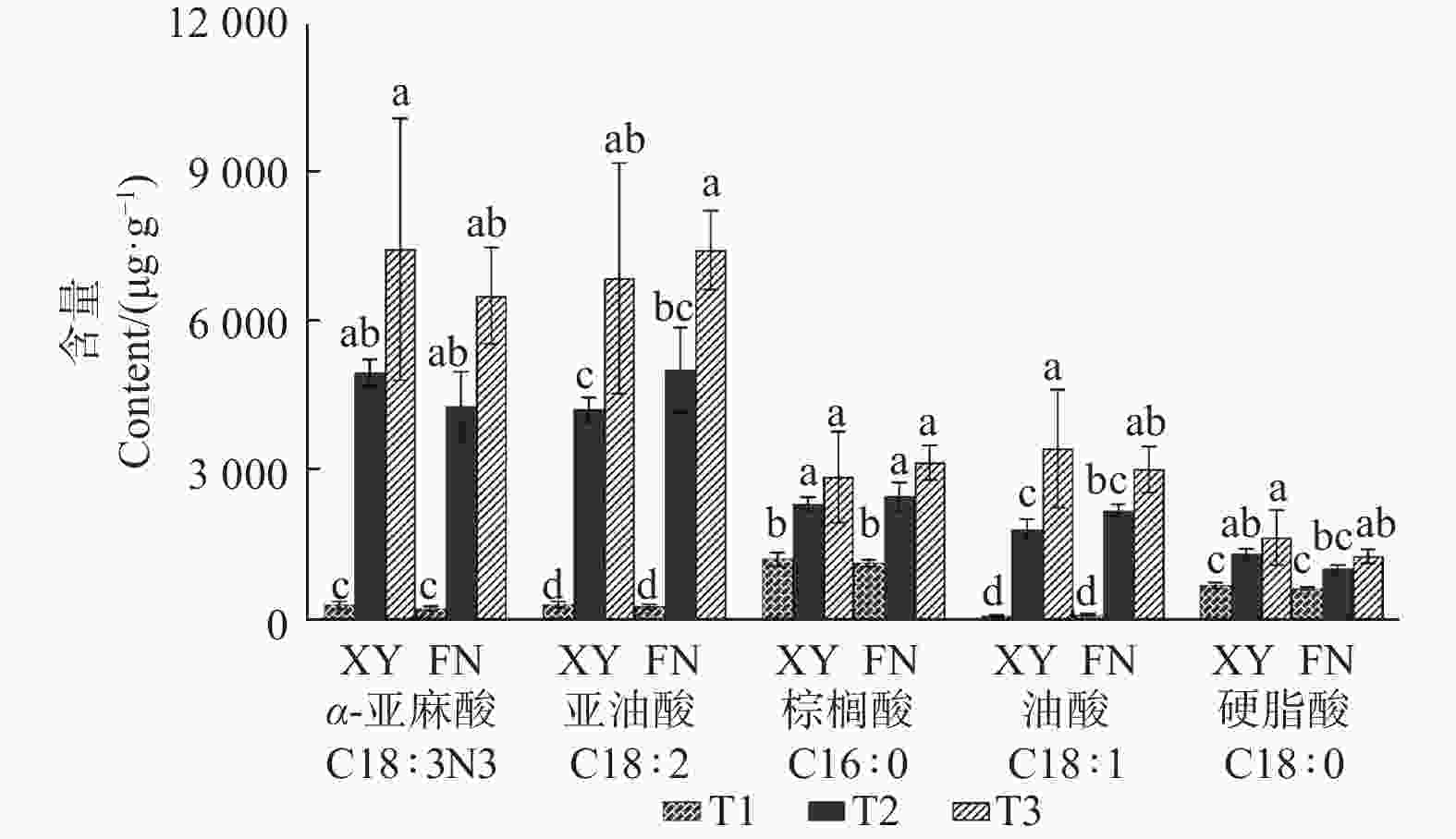
利用气相色谱分析,在2个品种沙棘的种子中共检测到27种脂肪酸(表1),其中,主要脂肪酸为C18:3N3(α-亚麻酸)、C18:2(亚油酸)、C16:0(棕榈酸)、C18:1(油酸)、C18:0(硬脂酸)。随着果实不断成熟,2个品种沙棘种子中,5种主要脂肪酸的含量均逐渐增加,其中,α-亚麻酸和亚油酸含量上升幅度较大。
组分
CompositionsXY FN T1 T2 T3 T1 T2 T3 C10:0 1.04±0.09 b 1.75±0.13 ab 2.43±0.69 a 1.04±0.07 b 1.72±0.20 ab 2.24±0.20 a C12:0 1.11±0.27 a 2.06±0.78 a 5.62±0.32 a 0.34±0.40 a 1.34±0.17 a 2.09±1.25 a C13:0 0.08±0.05 b 0.30±0.08 ab 0.35±0.188 a 0.08±0.02 b 0.31±0.10 ab 0.48±0.10 a C14:0 20.70±2.32 c 40.23±2.638 a 53.98±18.17 a 17.66±1.34 c 40.85±7.66 a 58.91±7.54 a C14:1 136.34±14.20 a 145.86±15.94 a 122.48±14.74 a 121.50±9.22 a 121.08±9.35 a 117.06±7.36 a C15:0 6.20±1.43 c 19.42±1.16 b 28.45±10.91 ab 6.84±0.91 c 24.40±5.20 b 37.00±5.97 a C15:1 16.90±2.09 a 14.37±2.21 ab 8.59±0.85 c 14.65±0.78 ab 12.06±4.19 abc 10.52±1.83 bc C16:0 1 219.70±135.84 b 2 337.41±132.23 a 2 873.02±915.18 a 1 141.08±69.79 b 2 482.63±282.95 a 3 165.25±346.54 a C16:1 38.04±6.73 c 70.55±12.28 bc 112.18±36.82 ab 28.40±4.84 c 86.75±22.13 ab 126.20±25.12 a C17:0 7.89±1.39 b 16.93±1.34 a 19.21±6.58 a 9.02±0.85 b 15.92±1.62 a 21.51±2.86 a C17:1 66.01±7.57 a 51.99±6.67 ab 47.64±2.13 ab 56.48±12.46 ab 44.60±3.13 b 51.85±7.10 ab C18:0 695.59±62.14 c 1 330.90±97.82 ab 1 656.18±553.21 a 634.31±23.71 c 1 035.51±73.38 bc 1 280.61±137.68 ab C18:1 78.99±20.21 d 1 824.10±207.78 c 3 447.79±1 190.81 a 101.66±20.47 d 2 197.36±133.31 bc 3 029.64±464.58 ab C18:2 311.23±62.81 d 4 231.52±246.51 c 6 879.55±2 327.19 ab 265.09±48.17 d 5 028.36±863.33 bc 7 443.04±795.32 a C18:3N3 298.54±76.45 c 4 980.34±261.85 ab 7 463.53±2 636.16 a 223.36±46.56 c 4 307.42±690.29 b 6 526.07±969.49 ab C20:0 19.50±3.83 c 102.61±13.30 b 200.82±74.68 a 16.14±2.06 c 94.96±7.90 b 139.33±19.39 b C20:1 7.42±1.60 c 50.74±4.18 b 90.17±30.25 a 5.87±0.58 c 53.50±4.71 b 83.41±16.89 a C20:2 0.93±0.22 c 8.69±0.52 b 14.62±5.51 ab 0.81±0.13 c 9.72±3.29 b 16.89±3.08 a C21:0 3.85±0.72 b 8.44±0.77 ab 11.93±3.97 a 3.76±0.51 b 8.15±1.48 ab 11.94±2.08 a C20:3N3 1.90±0.21 bc 3.02±0.23 ab 3.86±0.93 a 1.53±0.28 c 2.51±0.55 bc 3.94±0.72 a C20:5N3 0 a 0.15±0.08 a 1.04±0.79 a 0 a 0.33±0.03 a 0.87±0.61 a C22:0 12.20±1.62 c 36.59±4.23 b 57.26±20.45 ab 14.29±2.13 c 44.80±9.54 b 68.61±10.83 a C22:1N9 24.60±3.00 ab 29.29±6.16 a 26.30±5.35 ab 16.34±0.58 b 21.45±3.73 ab 20.85±4.84 ab C23:0 2.00±0.44 c 10.73±1.28 b 18.25±7.01 a 2.41±0.44 c 9.76±2.18 b 15.84±3.27 ab C24:0 4.74±0.60 c 17.42±2.00 b 29.66±10.75 a 5.35±0.46 c 18.09±3.08 b 26.69±4.54 ab C24:1 4.05±3.29 a 11.48±0.91 a 6.68±3.95 a 4.38±3.87 a 3.94±3.01 a 4.47±1.55 a C22:6N3 2.62±0.11 c 3.43±0.05 a 3.25±0.25 ab 2.55±0.08 c 3.07±0.09 b 3.26±0.18.00 ab 注:同行不同字母代表显著差异(P< 0.05)。
Note: Different letters in the same line represent significant differences(P< 0.05)Table 1. Dynamic changes of fatty acid composition in the seeds of XY and FN at different developmental stages
μg·g−1 从图1可以看出:XY与FN的5种主要脂肪酸的含量均在T2时期表现出显著差异。按照脂肪酸含量从大到小排序,在XY中,依次为α-亚麻酸、亚油酸、油酸、棕榈酸、硬脂酸,含量最高的脂肪酸为α-亚麻酸,亚油酸次之;而在FN中,脂肪酸从大到小排序依次为亚油酸、α-亚麻酸、棕榈酸、油酸、硬脂酸,亚油酸大于α-亚麻酸含量(图1)。
在T2时期,2个沙棘品种种子中α-亚麻酸与亚油酸的比值(α-亚麻酸/亚油酸)存在显著差异(P<0.05)。XY中,T2时期3个样本的α-亚麻酸/亚油酸比值分别为1.21、1.17、1.16,而FN分别为0.92、0.75、0.92(表2)。
品种
CultivarC18:3N3/C18:2 T2 T2-1 T2-2 T2-3 XY 1.182a 1.21 1.17 1.16 FN 0.862b 0.92 0.75 0.92 注:不同字母代表显著差异(P<0.05),T2-1、T2-2、T2-3代表T2时期的3个生物学重复样本。
Notes: Different letters in the same column represent significant differences(P<0.05).T2-1、T2-2 and T2-3represent three biological replicates of the T2 period.Table 2. C18:3n3 / C18:2 in XY and FN seeds of sea buckthorn at T2
-
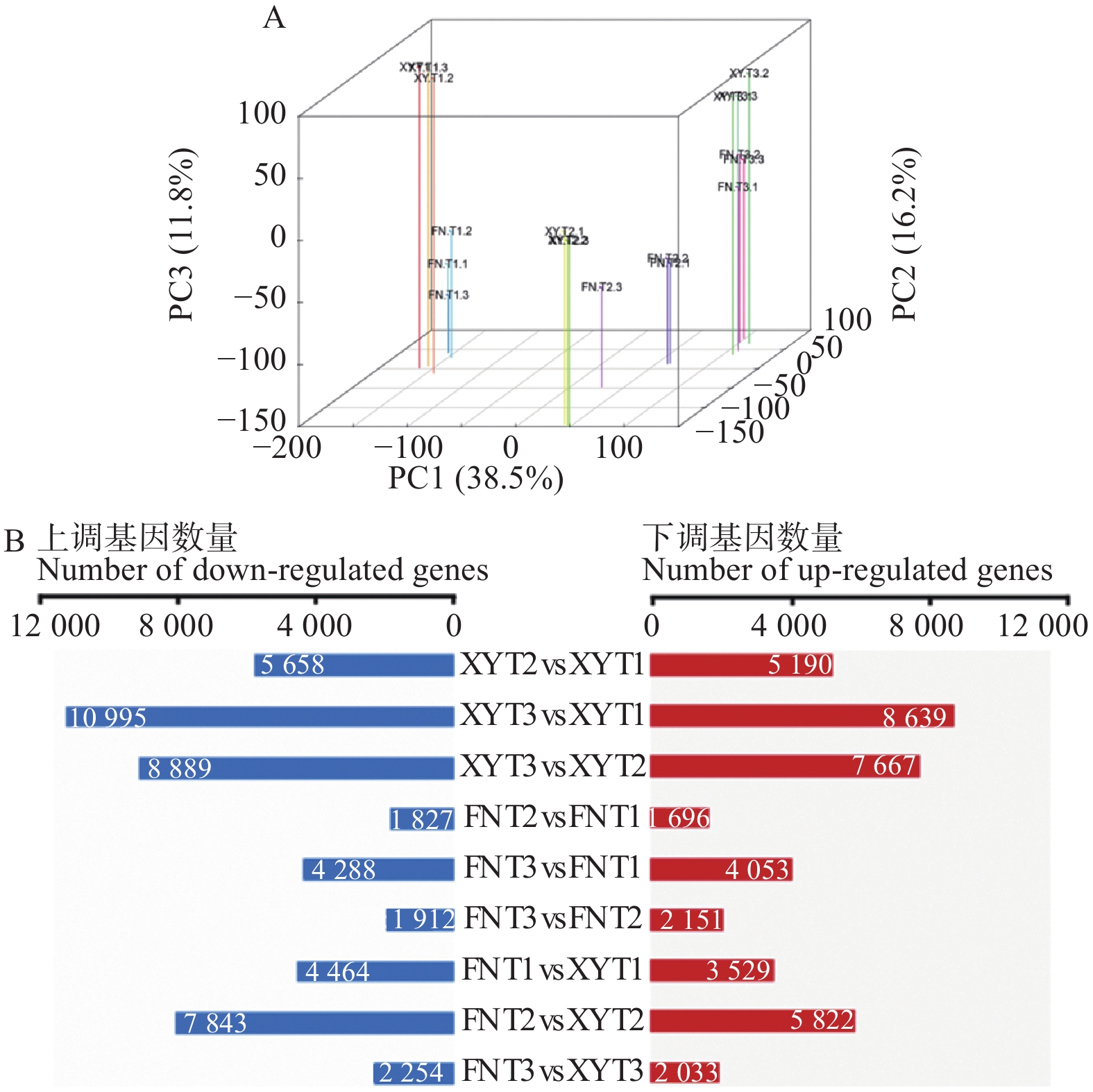
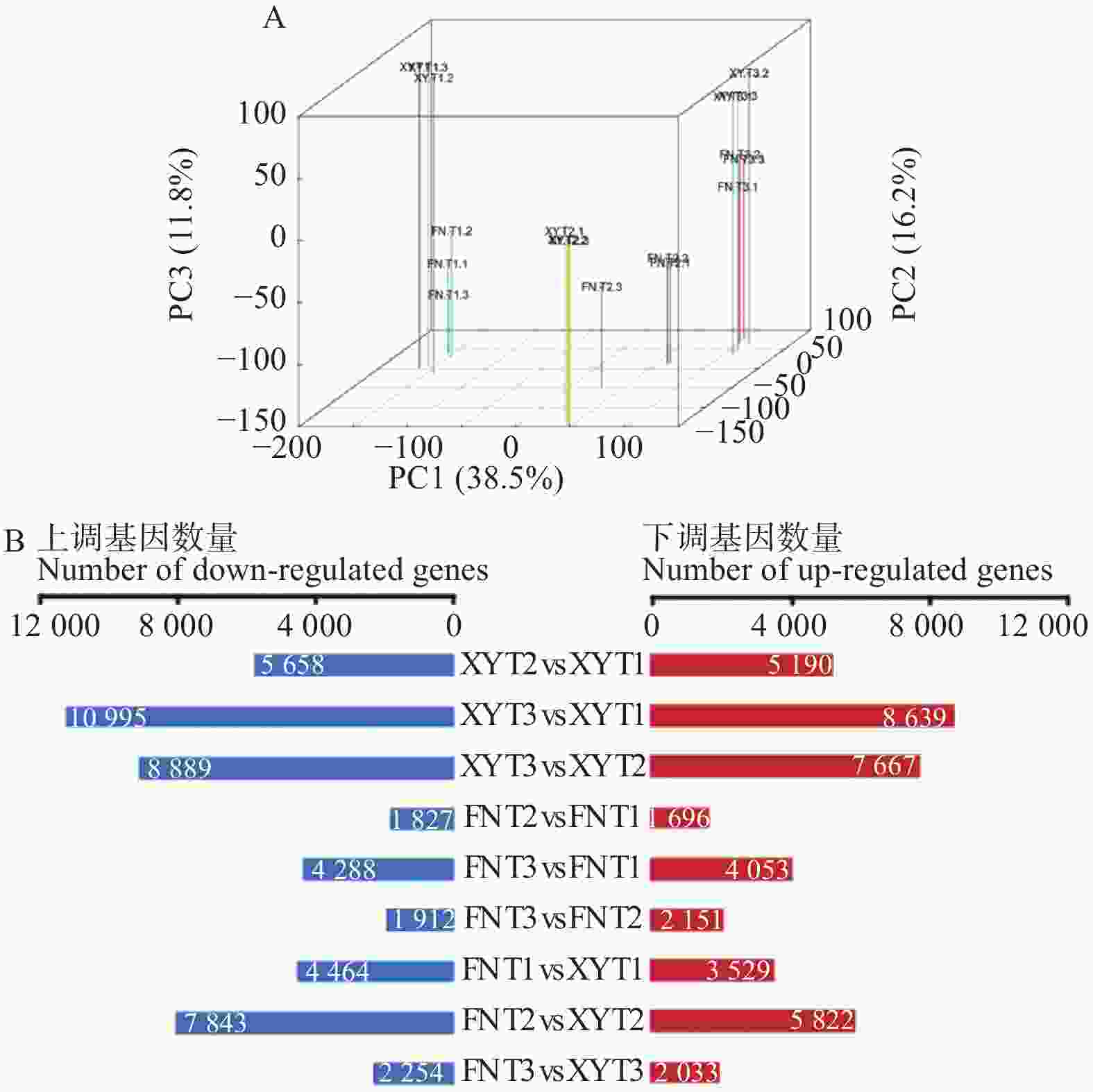
以XY与FN种子的3个发育时期、每个发育时期3个生物学重复的18个样品为材料,通过RNA-seq测序分析共产生140 G clean data,933 483 428条高质量序列(Clean reads)(Q20>97%;Q30>93%),其中,81.5%的序列唯一比对到参考基因组上。对2个品种3个不同发育时期及相同时期不同品种间的表达基因进行差异分析,共鉴定出24 917个差异表达基因(DEGs)。从图2A样本DEGs的主成分分析(PCA)可以看出:2个沙棘品种各个时期生物学重复聚类效果良好,不同时期之间与不同品种之间数据离散效果良好。通过DEGs的分布图(图2B)可以看出:在T1-T3的发育过程中,在T2时期XY与FN之间的DEGs最多。
依据序列同源性将24 917个差异表达基因进行GO功能注释,2 605个基因注释为生物过程(Biological process),554个基因注释为细胞组成(Cellular component),1 354个基因注释为分子功能(Molecular function)。为了进一步了解基因的生物学功能和相互作用,使用KEGG数据库对基因进行通路富集分析。24 917个DEGs注释到122个KEGG通路,其中,有94个DEGs的功能富集于脂肪酸合成(Fatty acid biosynthesis)通路、脂肪酸代谢(Fatty acid metabolism)通路、α-亚麻酸代谢(α-Linolenicacid metabolism)通路和亚油酸代谢(Linoleicacid metabolism)通路。
-
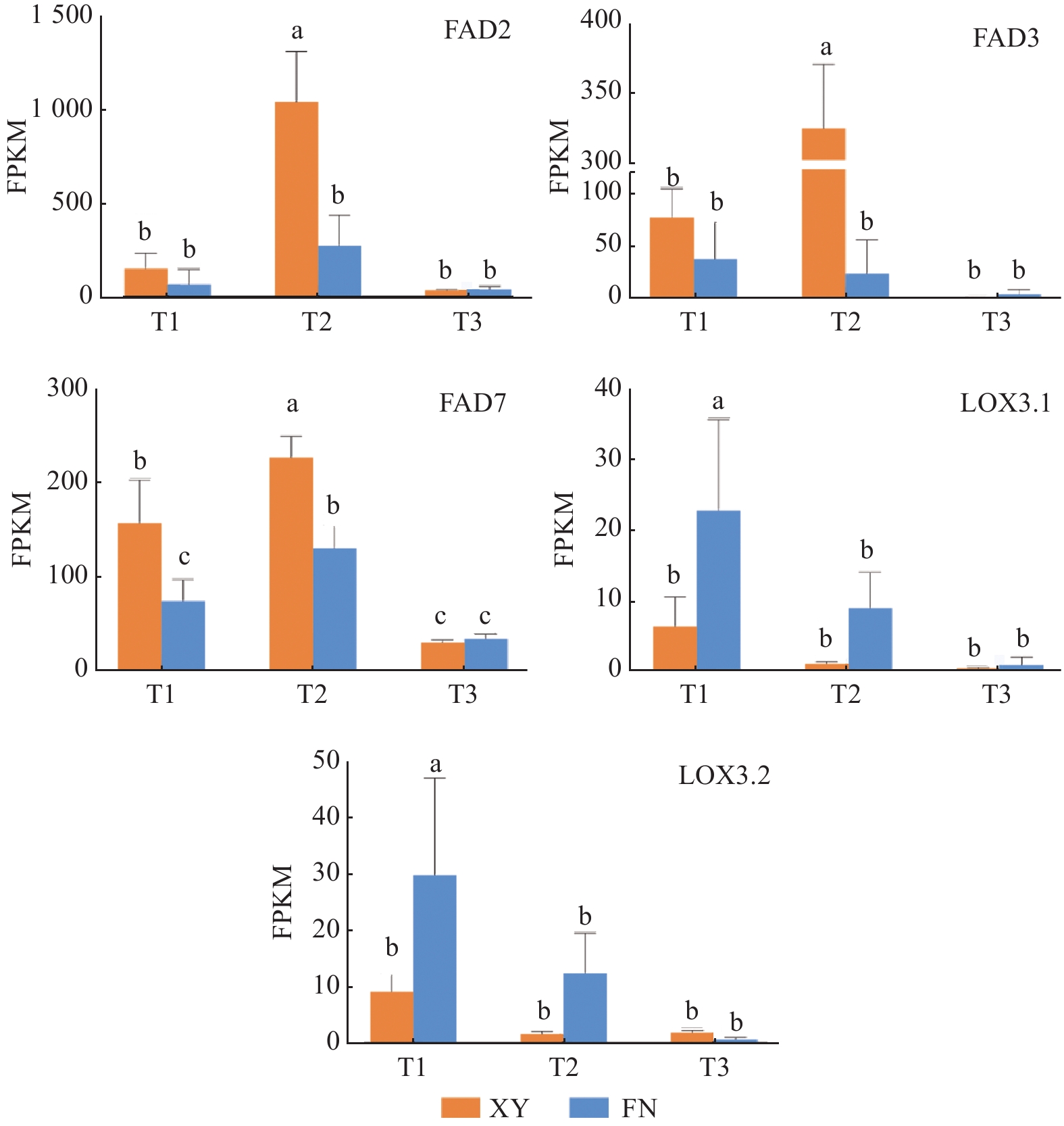
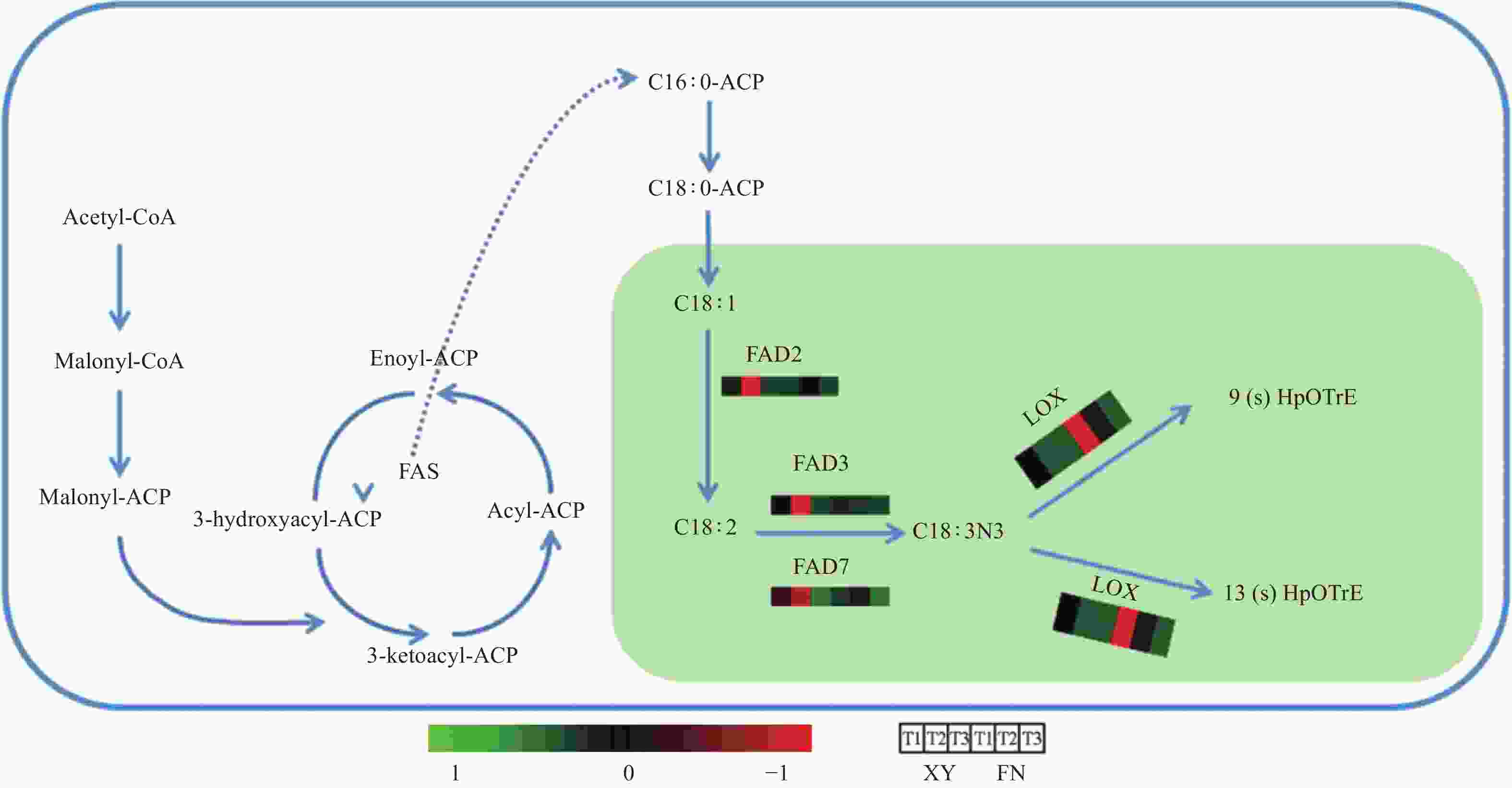
T2时期,基因FAD2在2个沙棘品种中的表达量差异显著(图3),在XY中的表达量显著高于FN,是FN的3.83倍,为α-亚麻酸(C18:3N3)的合成提供充足底物。FAD2基因在XY和FN中表达量均为先上升后下降,在第2时期表达量急剧上升达到峰值,与XY和FN中的亚油酸(C18:2)含量在第二时期显著增加(图1)相一致。
Figure 3. Gene expression profiles of Alpha linolenic acid biosynthetic genes during seed development of sea buckthorn
基因FAD3和基因FAD7调控亚麻酸生成α-亚麻酸(图4),在FN中的整体表达水平远低于XY,与XY中α-亚麻酸含量高于FN(图1)的结果相一致。基因FAD3在FN种子中的表达呈下调趋势,在XY种子中的表达水平先急剧上升,在T2时期达到峰值,后在T3时期表达量下调;T1时期,基因FAD3在XY中的表达量是FN 中的2.02倍,T2时期基因FAD3在XY和FN中的表达差异显著,在XY中的表达量是FN中的13.63倍(图3)。基因FAD7在XY和FN中的表达趋势均为先上升后下降,T1和T2时期在XY中的表达量显著高于在FN中的表达量,T1时期在XY中的表达量是FN 中的2.09倍,T2时期在XY中的表达量是FN 中的1.72倍(图3)。
基因LOX调控α-亚麻酸氧化(图4),生成脂肪酸氢过氧化物,是调控α-亚麻酸转化为其他物质的第一步,基因LOX3.1在XY和FN种子的生长发育过程中表达趋势均为逐渐下降,在FN中的表达量高于XY,T1时期基因LOX3.1在FN中的表达量是XY中的3.58倍,T2时期基因LOX3.1在FN中的表达量是XY中的8.02倍(图3)。基因LOX3.2在FN中的表达量同样高于XY,T1时期在FN中的表达量是XY中的3.24倍,T2时期在FN中的表达量是XY中的7.12倍(图3)。基因LOX的高表达不利于α-亚麻酸的积累,与图1中所显示的XY中α-亚麻酸含量高于FN的结果相一致。
3.1. 两个沙棘品种种子中脂肪酸组分差异分析
3.2. 转录组数据分析探究沙棘种子α-亚麻酸的合成规律
3.3. α-亚麻酸合成与代谢相关基因表达分析
-
沙棘种子中富含不饱和脂肪酸,其中,α-亚麻酸含量一般较高。α-亚麻酸作为人体必需脂肪酸,具有多种有益的生理功能,因此,为了进一步提高沙棘种子中α-亚麻酸含量,培育沙棘新品种和良种,在分子水平上研究沙棘中α-亚麻酸的合成代谢规律至关重要。亚油酸是α-亚麻酸合成的底物,脱饱和生成亚麻酸[17-18]。本研究选取的2个沙棘品种中,α-亚麻酸/亚麻酸的比值存在显著差异,XY种子中α-亚麻酸是含量最高的脂肪酸,亚油酸含量次之,而在FN中正相反,含量最高的脂肪酸是亚油酸,α-亚麻酸含量次之。因此,基于这2个品种存在的差异挖掘沙棘种子中调控亚油酸向α-亚麻酸转化的关键基因以及抑制α-亚麻酸分解的关键基因,探究α-亚麻酸合成代谢规律。
FAD2催化油酸转化为亚油酸[19-21],FAD2基因表达量下降使亚油酸合成受阻,进而影响α-亚麻酸的生成,而FAD2基因的高表达可以为α-亚麻酸的合成提供充足的底物。2个沙棘品种种子中的亚油酸含量在T2时期快速积累,与T2时期基因FAD2的表达水平急剧上升相一致。在XY和FN种子中,T1和T2时期之间的亚油酸含量差异显著。T3时期基因FAD2的表达量降低,亚油酸含量积累速度明显下降。
α-亚麻酸在FAD3和FAD7的催化下由亚油酸脱饱和产生[17-18]。FAD3与FAD7同属于ω-6 型脂肪酸去饱和酶,已有的研究表明,基因FAD3在植物种子α-亚麻酸的合成过程中起到关键作用[22-24]。实验表明,拟南芥的FAD3基因在大豆中异位表达可使大豆中α-亚麻酸含量增加,大豆的FAD3C基因在芝麻中特异性表达同样也可使芝麻中α-亚麻酸的含量显著提高[25]。此外,Wu等将麻风树的JcFAD3基因在拟南芥的种子中特异性表达使拟南芥种子中α-亚麻酸的含量提高了20.50%~24.94%;同时亚油酸的含量相比野生型降低了11.4%~23.5%[26]。在烟草中过表达拟南芥FAD7基因,同样使烟草中α-亚麻酸的含量升高且亚油酸含量下降[23]。
在T1和T2时期,XY中基因FAD3和基因FAD7的表达量远高于FN,尤其在T2时期,基因FAD3在XY和FN中的表达差异显著,在XY中的表达量是FN中的13.63倍,调控大量亚油酸脱饱和生成α-亚麻酸,因此,XY种子中α-亚麻酸的含量大于亚油酸的含量,而FN中亚油酸含量比α-亚麻酸高。这解释了为何基因FAD2在XY种子中的表达量高于FN,但亚油酸含量却是FN种子大于XY种子。
基因LOX是α-亚麻酸代谢过程中的关键基因,是调控α-亚麻酸转化为其他物质的第一步,调控α-亚麻酸氧化,生成脂肪酸氢过氧化物[27-29]。基因LOX3.1和基因LOX3.2在XY和FN发育的T1时期表达量处于3个时期的最大值,抑制α-亚麻酸的积累,协同基因FAD2、FAD3、FAD7在T1时期的低表达水平,导致T1时期α-亚麻酸含量处于低水平,T2时期基因LOX3.1和LOX3.2表达量下调,基因FAD2、FAD3、FAD7表达量急剧上升,因而α-亚麻酸含量在T2时期显著增长。同时,基因LOX3.1和LOX3.2在FN种子中的表达量高于XY种子,抑制FN种子中α-亚麻酸的积累,使FN种子中α-亚麻酸积累量低于XY。
沙棘种子中α-亚麻酸的高积累源于多个基因的协同调控作用,基因FAD2、FAD3、FAD7的高表达协同基因LOX3.1和LOX3.2的低表达使α-亚麻酸的高积累得以实现。
本研究在基因和代谢水平上研究沙棘中α-亚麻酸合成代谢规律,对进一步提高沙棘种子中α-亚麻酸含量、培育沙棘良种具有重要意义。
-
通过对2个不同沙棘品种种子中中长链脂肪酸和转录组数据联合分析得出:沙棘种子中α-亚麻酸的高积累源于多个基因的协同调控作用。基因FAD2调控油酸去饱和生成亚油酸,其高表达为α-亚麻酸的合成提供了充足的底物。α-亚麻酸在基因FAD3和基因FAD7的调控下由亚油酸去饱和产生,基因FAD3和基因FAD7的高表达促进亚油酸向α-亚麻酸转化,使α-亚麻酸积累,同时使亚油酸含量下降。沙棘种子中基因LOX3.1和LOX3.2是α-亚麻酸代谢过程中的关键基因,其表达水平下降有利于种子中α-亚麻酸的积累。




 DownLoad:
DownLoad: