-
桐花树(Aegiceras corniculatum (L.) Blanco)生长在海岸潮间带,其林带生境受潮水的周期性浸淹,有多变的盐度、高温和强紫外等特殊环境因素,由此也创造了丰富的微生物群落。植物内生固氮菌是指定殖于植物体内,不损害植物健康[1],并且能与宿主植物进行联合固氮的一类固氮微生物,属于植物微生态系统的天然组分。植物内生固氮菌于植物体内定殖,生活在植物细胞内、木质部导管、细胞间隙等部位,并进行固氮作用。内生固氮菌在植物体组织内占据着有利于营养供应与微环境适宜的生态位,可有效地拮抗许多病原微生物的生长[2],提高作物抗性,较根际、叶际等附生环境更有利于与植物形成高效的固氮体系,行使其固氮功能为宿主植物提供氮素,进而促进植物的生长和产量的提高,是一类应用前景广泛、尚待开发的微生物资源[3]。
本研究从湛江海滩桐花树根部取材,通过分离纯化固氮菌,分析其固氮能力,初步筛选出固氮能力较好的优良固氮菌,并对其培养条件进行了优化,旨在培育优良红树植物内生固氮菌、研制固氮菌剂,以期应用于红树林育苗造林的生产实践中,为沿海防护林体系建设提供理论依据,对保护红树林生态系统具有重要意义。
HTML
-
于广东省湛江市海滨公园观海长廊红树林滩涂,随机选取桐花树植株5株,采集无病虫害、长势良好的桐花树植株的根部根皮组织,用于分离菌株。
-
根部组织样品用自来水冲洗干净,用吸水纸吸干表面水分后称取5 g,无菌水冲洗3~4次后,用75%乙醇浸泡消毒5~7 min,2%次氯酸钠进行表面消毒10~20 min,无菌水冲洗3~5次,取最后一次的冲洗液0.1 mL,涂布于无菌的牛肉膏蛋白胨培养基平板进行无菌检验。样品加入50 mL无菌水放在无菌研钵中进行研磨,静止10~15 min后,取0.1 mL研磨液涂布于Ashby无氮培养基平板,实验设3次重复,放在28℃恒温培养箱中黑暗培养72 h[4]。根据菌落颜色、形态等挑选单菌落,分别在Ashby无氮培养基平板上再次划线,直到获得纯培养物,最后转接至Ashby无氮培养基斜面保存备用。
将已经纯化的菌株接种到Ashby无氮培养基平板中培养3 d,观察菌落大小、形态、表面和颜色等特征,然后进行革兰氏染色。
-
将各菌株接种到装有100 mL无氮液体培养基的250 mL锥形瓶中,28℃、180 r·min−1条件下振荡培养4 d。量取培养好的菌液样品10 mL、硫酸铜和硫酸钾的混合物(比例为1:6)0.5 g、浓硫酸10 mL和2粒瓷碎片,移入凯氏烧瓶中,在通风橱内,以45°斜于电磁炉上隔石棉网加热,烧至液体变成蓝绿色透明后,取下冷却,转移到25 mL容量瓶,加水定容。
吸取2%硼酸溶液10 mL于锥形瓶中,加2滴溴甲酚绿-甲基红混合指示剂,将冷凝管下端放置于硼酸液面之下。水蒸气发生瓶内装水到2/3容积处,量取消化样品5 mL经小漏斗加入到反应管内,用少量蒸馏水洗下,再加入浓度40%的氢氧化钠10 mL,加上少量水于漏斗密封。酒精灯加热发生瓶蒸馏,至指示剂变绿色后继续蒸馏5 min,冷凝管提离硼酸液面后再蒸馏2 min,用蒸馏水冲洗管壁,取下装有硼酸的锥形瓶,每样品蒸馏重复3次。吸取10 mL空白消化液,按上述样品操作步骤操作,作为空白对照。用0.01 mol·L−1盐酸标准溶液将锥形瓶内的硼酸溶液滴定至终点,变成浅灰红色,记录盐酸的用量,并计算样品含氮量(mg·L−1)。
-
将在28℃、180 r·min−1条件下培养好的菌悬液按2%的接种量接种到试验所用的培养基中。
-
配制pH值为5.0、6.0、7.0、8.0、9.0的LB液体培养基各50 mL备用。无菌条件下,将菌悬液接种于各pH值液体培养基中,摇匀,28℃、180 r·min−1条件下培养24 h后,测定其在OD600下的吸光值,以不接菌的LB培养基为空白对照,实验设3次重复。培养48 h后再测定1次OD600
吸光值[8]。OD600吸光值大,表明菌株生长旺盛,反之亦然。 -
在pH值为7的LB液体培养基中分别加入浓度0%、1%、2%、3%、4%的NaCl,各50 mL装于250 mL锥形瓶中,每浓度设3次重复,灭菌后备用。无菌操作下,将菌悬液接种于不同NaCl浓度的LB液体培养基中,28℃、180 r·min−1条件下培养24、48 h后分别测定OD600吸光值。
-
无菌条件下,将菌悬液接种于pH值为7的LB液体培养基中,分别置于20、24、28、32、36℃下180 r·min−1培养,每温度3次重复,以不接菌的为对照,培养24、48 h后,测定OD600吸光值。
-
配制分别由乳糖、蔗糖、淀粉、葡萄糖、麦芽糖代替LB液体培养基中的碳源(酵母膏)的液体培养基各50 mL,装于锥形瓶中灭菌备用。无菌条件下,菌悬液接种于5个不同碳源的pH值为7的LB液体培养基中,摇匀,32℃、180 r·min−1条件下培养24、48 h后分别测定菌株OD600吸光值。
-
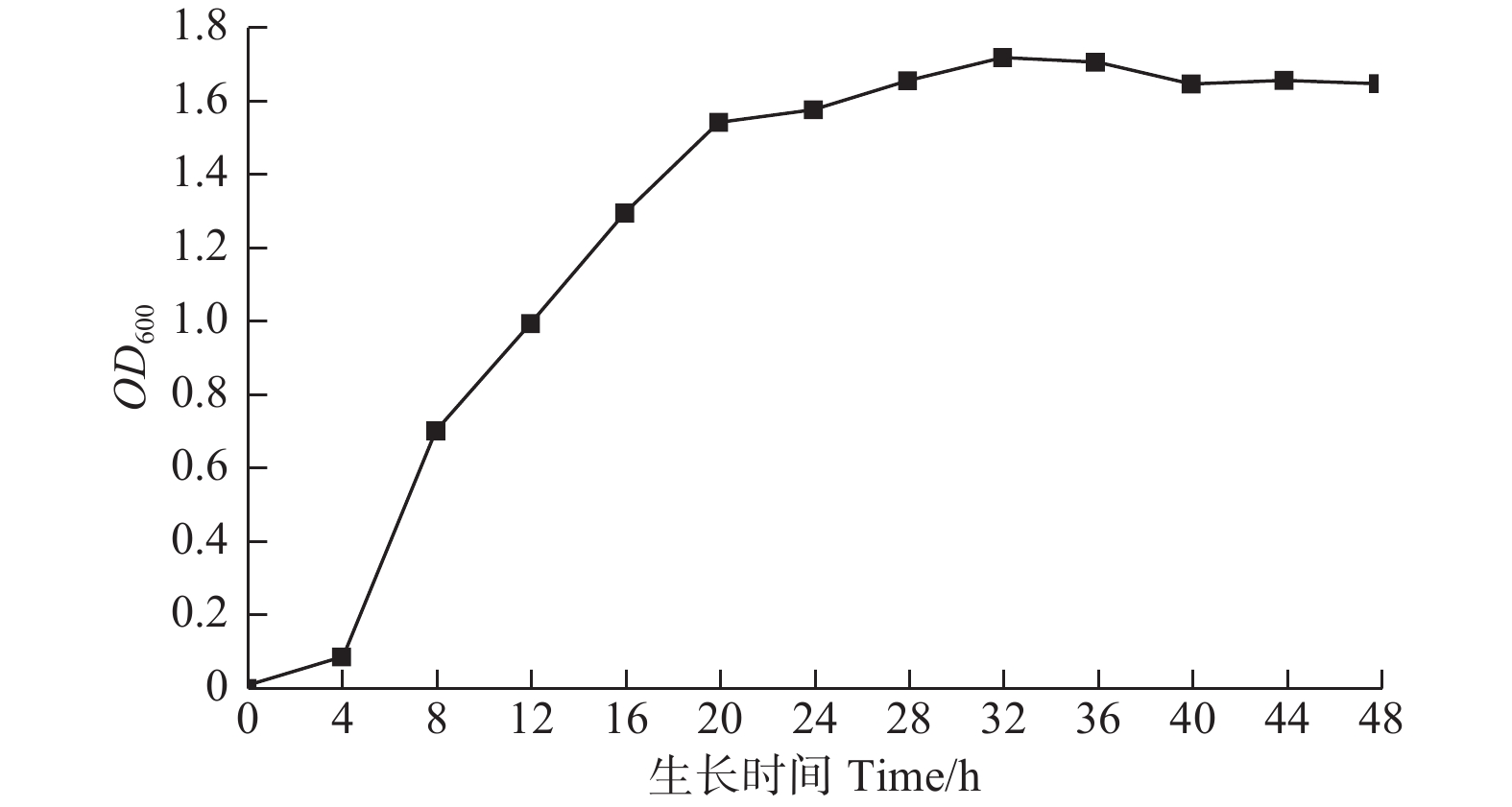
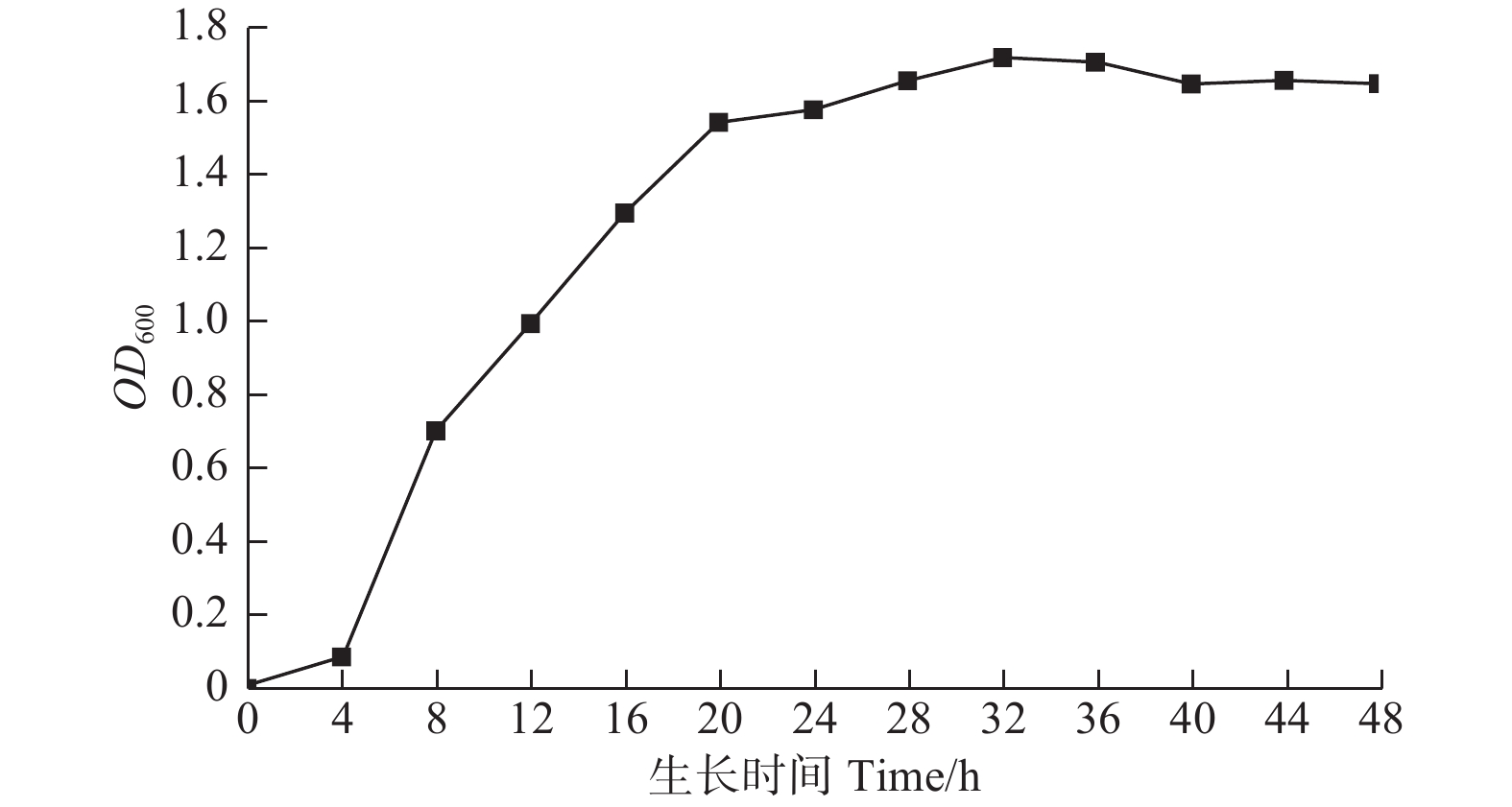
将活化后的菌株接种于装有100 mL的LB液体培养基的250 mL锥形瓶中,培养12 h,作为菌种。将菌种接种于分装有50 mL pH值为7、NaCl 浓度为2%的LB液体培养基的250 mL锥形瓶中,分别标记为0、4、8、12、16、20、24、28、32、36、40、44、48 h,每处理设3次重复,除0 h处理组外,立即将其余的试验瓶放置于32℃培养箱中培养,每隔4 h取出对应编号的锥形瓶菌液,以0 h的处理组作为空白对照,紫外分光光度计在600 nm的波长下测定不同培养时间菌液的OD600吸光值。以测得平均OD600吸光值为纵坐标,对应培养时间为横坐标,绘制菌株的生长曲线。
-
数据使用SPSS Statistics 20.0 (IBM, Chicago, USA)、Excel 2010统计软件进行统计分析,采用单因素方差分析进行均值显著性检验,邓肯多重比较进行显著性差异检验(P < 0.05),使用SigmaPlot13.0进行绘图,所示数据为3次重复的平均值 ± 标准差。
1.1. 材料
1.2. 内生固氮菌的分离和纯化
1.3. 凯氏定氮法检测固氮能力
1.4. 菌株生长培养条件
1.4.1. 接菌量
1.4.2. pH值
1.4.3. NaCl浓度
1.4.4. 温度
1.4.5. 碳源
1.5. 菌株生长曲线的测定
1.6. 数据处理
-
通过Ashby无氮培养基选择分离培养后,从红树植物桐花树根部分离得到3株能在无氮培养基上生长的菌株,分别用A1、B1、C1表示。经过4代的分离纯化后,分别进行革兰氏染色,确定3种菌皆为革兰氏阴性菌(Gram negative bacillus)。通过凯氏定氮法筛选得到高效固氮能力的菌株A1(图1),其形态学特征:球状菌,乳白色,菌落圆形,表面光滑,湿润,边缘整齐。
-
分离得到的菌株通过连续传代培养后,用微量凯氏定氮法测定菌体固氮量。由表1可知:所得菌株都具有一定的固氮能力,其中,菌株A1固定的氮量相对较高,达16.695 mg·L−1,且生长状况比其他2株好。综合评价细菌的固氮量和生长情况,筛选出高效菌株A1。
菌株
Strains平均OD600
Average OD600固氮量
N fixed/(mg.L−1)A1 0.051 ± 0.006 16.695 ± 0.448 B1 0.012 ± 0.003 10.899 ± 0.290 C1 0.015 ± 0.002 4.914 ± 0.236 Table 1. The growth status of the strain (OD600 value) and the amount of nitrogen fixation
-
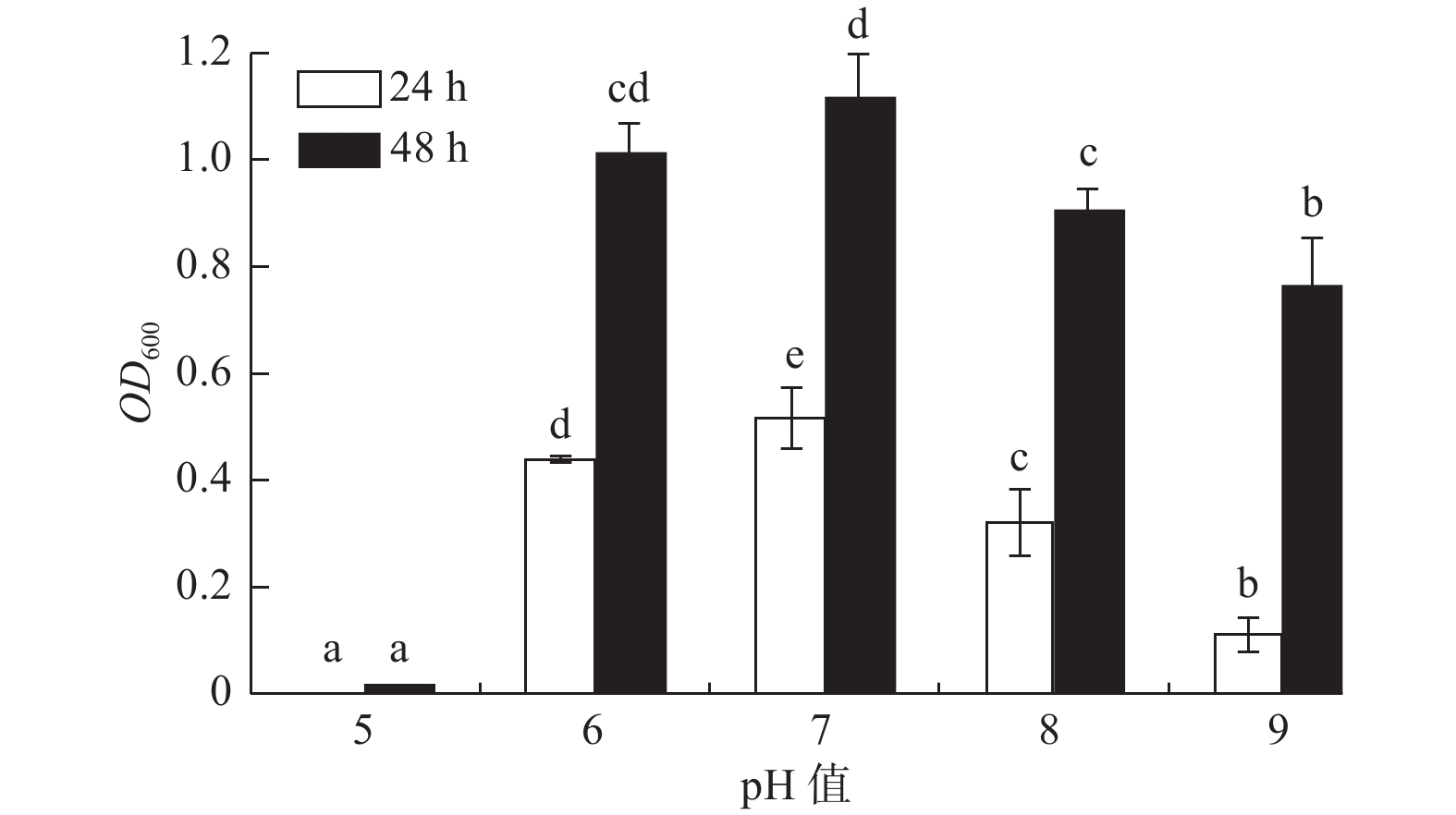
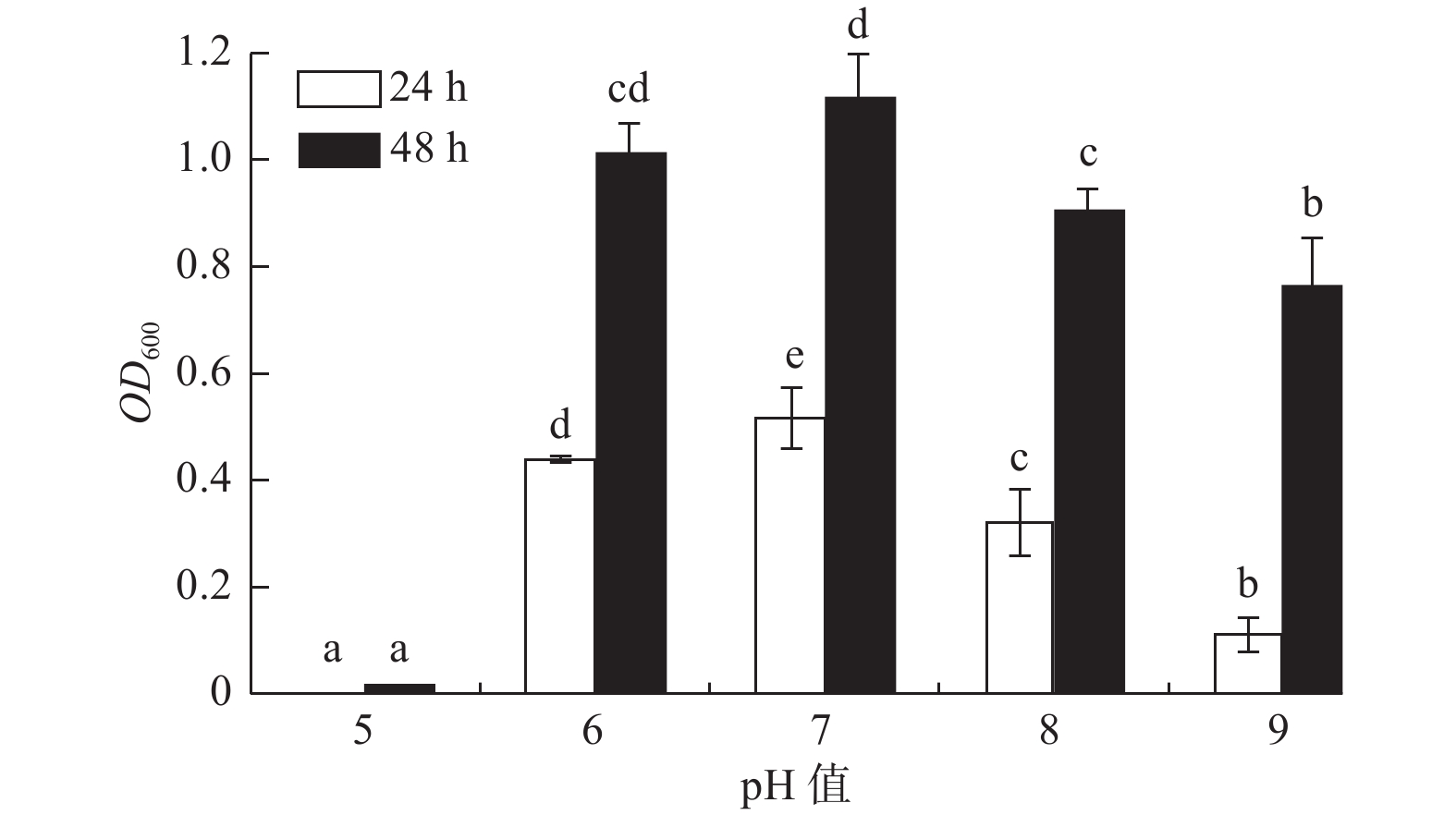
pH值对菌株A1的生长影响显著(P < 0.05)(图2),菌株A1的pH值适应范围较广,在pH值5~9范围内其生长速率随pH值的增大呈先增大后减小的趋势,且培养24 h和48 h时菌株A1液体培养基的OD600吸光值都在pH值为7时达到最大值;在pH值为6~8内生长较好,且在pH值为6时(24 h,OD600吸光值为0.439;48 h,OD600
吸光值为1.012)比pH值为8时(24 h,OD600吸光值为0.320;48 h,OD600 吸光值为0.904)生长状况好,说明菌株A1是中性偏酸菌。 -
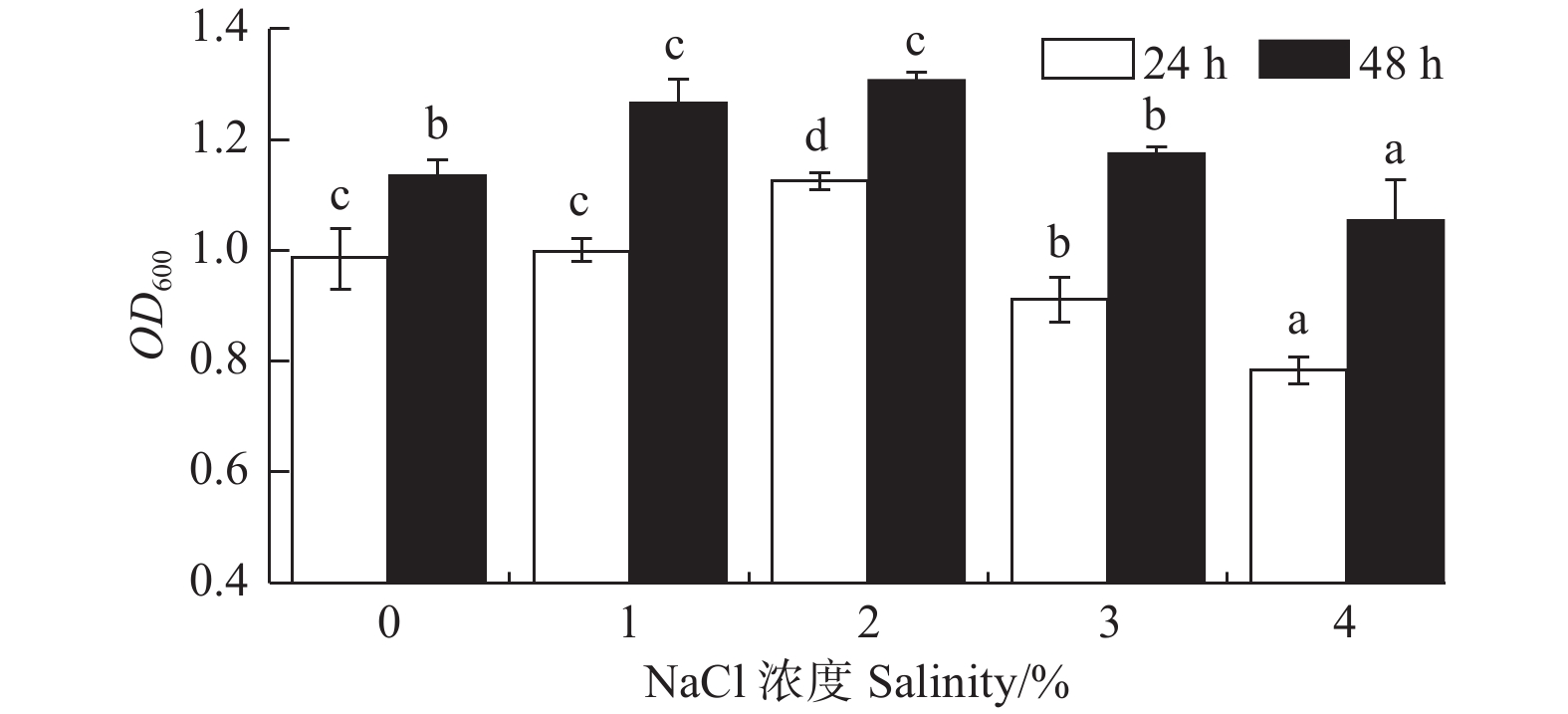
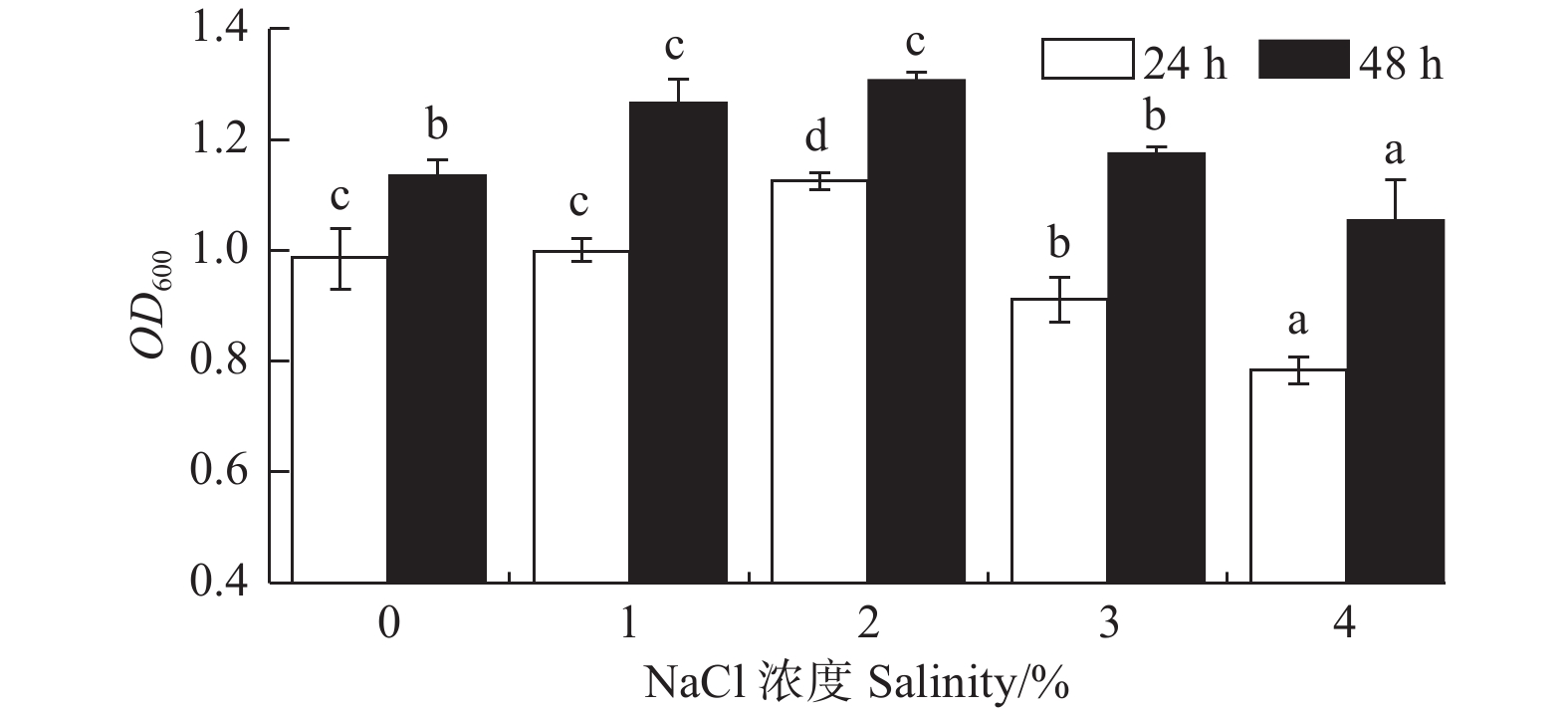
NaCl浓度对菌株A1的生长影响显著(P < 0.05)(图3)。菌株在0%~4%的NaCl浓度下均能生长,说明菌株对NaCl浓度有较广的适应性;在NaCl浓度为1%、2%时,菌株A124 h生长量OD600
吸光值分别为0.997和1.123,菌株A148 h生长量OD600吸光值分别为1.265和1.309。由此可见,该菌株的最佳NaCl浓度为2%,较为适宜的NaCl浓度为1%~2%。 -
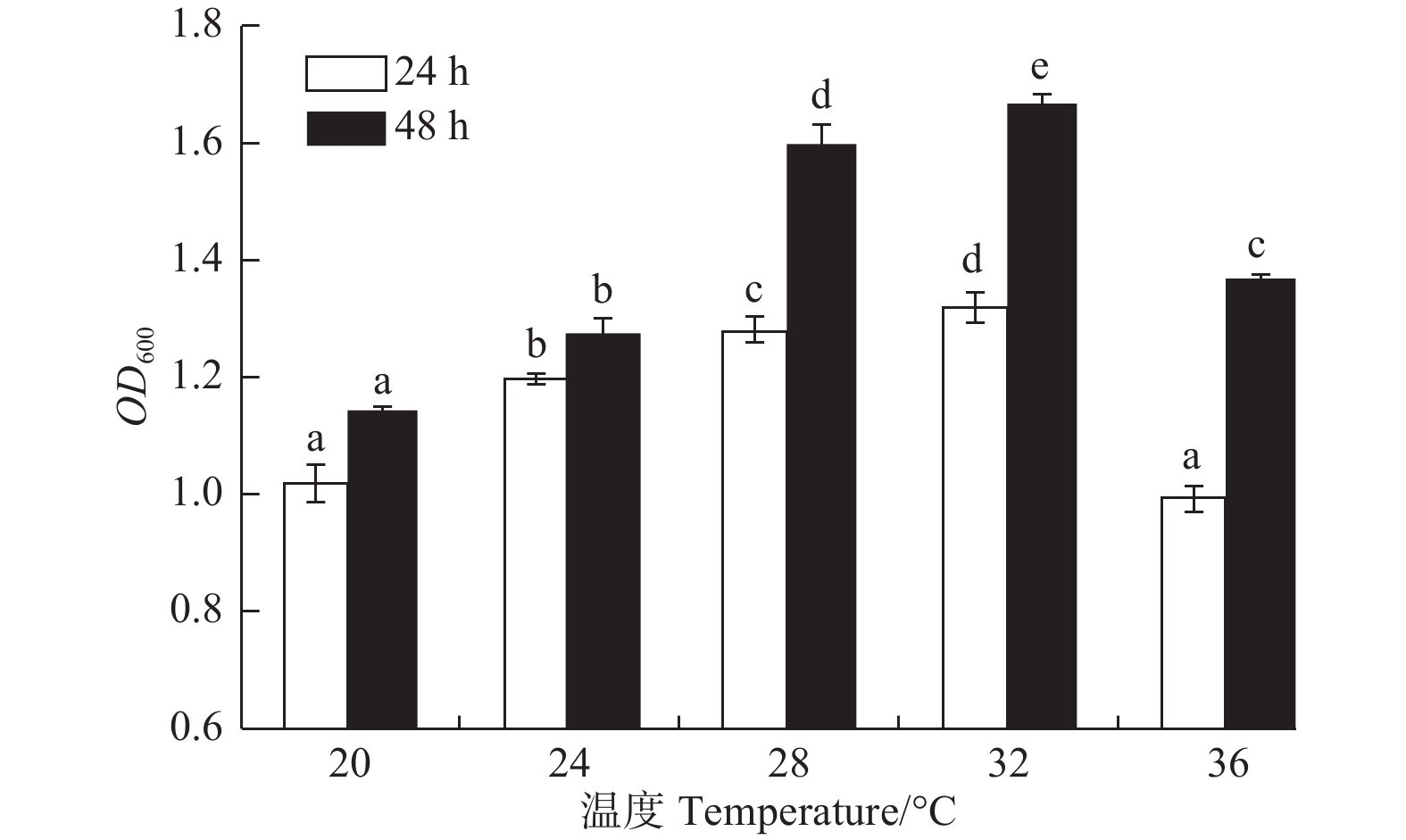
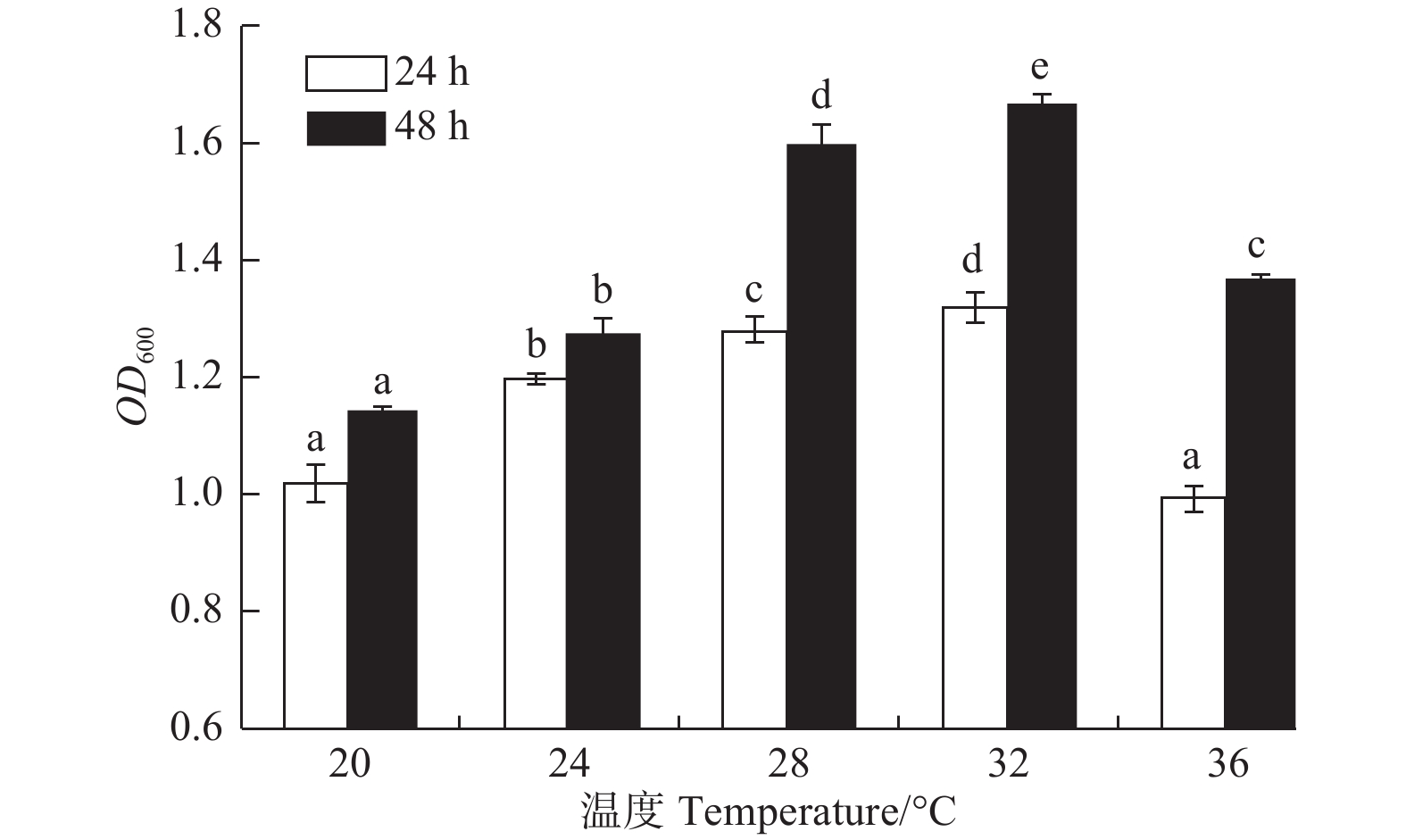
温度对菌株A1生长的影响显著(图4,P<0.05)。菌株A1在20~36℃均可生长;在20~32℃时,随温度升高,菌株生长量逐渐增加;在32℃时,菌株A1生长量达到最大(24 h,OD600吸光值为1.318;48 h,OD600吸光值为1.666);在32℃之后,生长量开始下降。32℃为该菌的最佳生长温度,而它的最适温度为28~32℃。
-
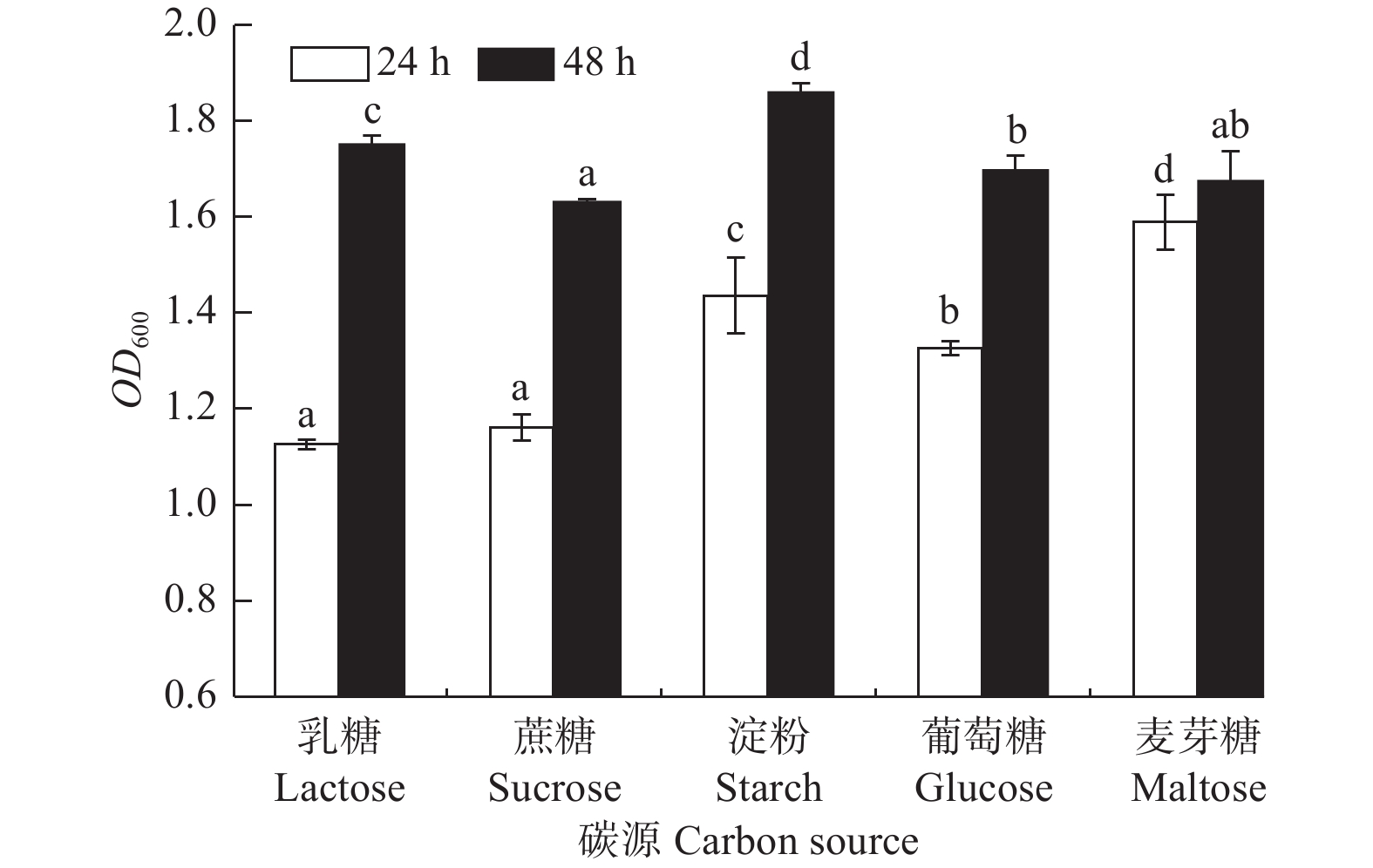
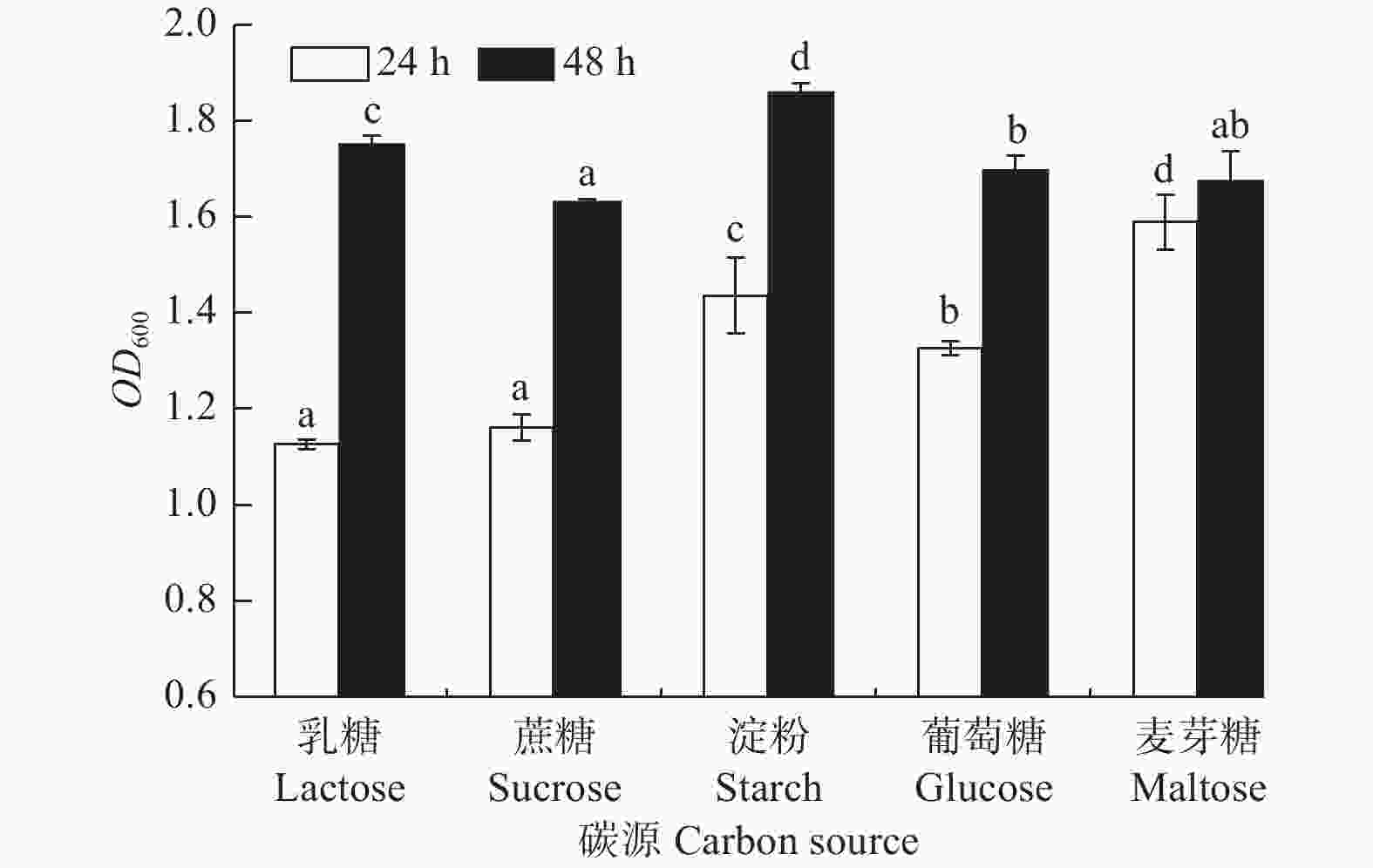
碳源对菌株生长的影响差异显著(图5,P<0.05)。菌株A1对各碳源乳糖、蔗糖、淀粉、葡萄糖、麦芽糖均能利用,生长普遍较好;培养24 h时,菌株对麦芽糖的利用率较高,生长量较大(OD600吸光值为1.587);48 h内,菌株对淀粉的利用率更高和持久,生长量达到最大(OD600吸光值为1.861),因此,长时间培养可用淀粉做其碳源。
-
菌株A1的典型生长曲线见图6。菌株接种后,经过0~4 h的延迟期,在4~20 h进入了快速生长的对数期,20 h之后到达稳定期,维持12 h后,在32 h后开始进入缓慢的衰亡期。说明筛选出的菌株A1有一个完整的生长过程,包括了延迟期、对数期、稳定期和衰亡期,生长周期相对较长。
2.1. 固氮菌的分离与形态学特征
2.2. 固氮菌的固氮能力测定与筛选
2.3. 固氮菌的最适培养条件
2.3.1. pH值对菌株生长的影响
2.3.2. NaCl浓度对菌株生长的影响
2.3.3. 温度对菌株生长的影响
2.3.4. 碳源对菌株生长的影响
2.4. 菌株生长曲线的绘制
-
无氮液体培养基中菌株生长繁殖所需要的氮源全部来于对氮气的固定,刘欣林[9]用凯氏定氮法测得不同小麦内生固氮菌的固氮量分别为3.6、3.0、2.8、2.7 mg·L−1;栾敏[10]用凯氏定氮法测得土壤自生固氮菌的固氮量分别为4.0、3.0、2.7 mg·L−1;本实验用凯氏定氮法测得试验菌的固氮量为16.695 mg·L−1,显示出良好的固氮性能;而杨从发等[11]取小麦、水稻、玉米和蔬菜根际土壤测得的自生固氮菌的固氮量从13.6 mg·L−1到72.2 mg·L−1不等,说明取材地点对固氮菌的固氮量影响较大。杨从发等[11]通过乙炔还原法和凯氏定氮法比较了自生固氮菌的固氮能力,结果表明,2种方法都能很好的测定固氮酶活性。红树林内生固氮菌在红树林生态系统的恢复、可持续发展以及红树植物的保育和繁殖方面应用前景广阔[12]。然而,开发固氮资源还需要做进一步的研究,比如接种固氮剂到作物上,评估接种对作物生长的影响等。
培养液中不同pH值对菌体的生产量影响较大,在pH值 ≤ 5的培养液中,菌株不能正常生长,培养液中的pH值对细菌代谢产物的解离有影响,引起细胞膜的电荷变化,从而影响细菌对营养物质的吸收利用。此外,pH值还影响酶的合成,导致影响细菌对物质的分解利用效率;pH值过高或过低都不利于细菌的生长和代谢物质的产生,从而影响细菌的固氮能力[13]。菌株A1在5 < pH≤9的培养条件下均能生长,说明该菌株具有较强的适应能力。侯伟等[14]认为,广东箣竹内生固氮菌在pH值5~8时,生长势较强,与本研究结果一致,也与葛江丽[15]等对水稻根际固氮菌的pH值适应范围一致。
NaCl在维持渗透压方面起重要作用,Na+和Cl−是维持细胞外液渗透压的主要离子。目前,关于渗透压影响固氮菌生长和功能的研究较少,因为细菌的有关耐盐机理较复杂,多数认为细菌可合成或积累一些“亲和性溶质”的有机化合物,这些有机化合物在细菌体内迅速合成和分解,对于不同的盐浓度环境有很好的适应作用。本试验菌株A1在NaCl浓度为2%时,生长量最大,与侯伟等[14]对广东箣竹内生竹内生固氮菌在NaCl浓度为0.5~2.5 g·L−1时能保持旺盛生长且固氮酶活性较强的研究结论一致。本试验菌株在NaCl 浓度0%~4%的条件下均能较好地生长。
低温时,细胞的酶活性较低,对营养物质的利用能力较弱,进而影响生物的生长;随着温度升高,酶活性升高,对营养物质利用加快,提高了细菌生长分化速度;超过一定温度时,酶会逐渐失活,导致细菌减少甚至死亡。本研究菌株最适宜温度为32℃,在此温度可以达到细菌生长的较高水平;28~32℃时,菌株生长势较强。刘彩霞等[16]认为,杉木林土壤中固氮菌的适宜生长温度为28℃,较为适宜生长区的温度为 20、28、37℃;侯伟等[14]认为,广东箣竹内生固氮菌在26~37℃时,菌液OD600吸光值和固氮酶活性都维持在较高水平,温度偏高于本研究结果。笔者认为,红树根部长期处于海水的浸泡中,温度低于陆地上温度,适宜温度略低于陆地植物内生菌是长期适应的结果。
碳源是细胞生命活动所需的重要能量来源,同时提供合成产物的碳架。在微生物的培养中,碳源为微生物的正常生长和分裂提供了物质基础。本实验中,菌株A1在对碳源的长期利用中,淀粉的供能利用效果更好,淀粉也是植物光合作用的主要产物。
-
本研究从湛江海滩桐花树根部获得1株高效固氮菌,对其培养条件进行了优化,结果表明,其最适生长条件为:温度32℃,pH值7,NaCl浓度2%,最适碳源淀粉。本实验为培育优良的红树植物内生固氮菌与研制高效固氮菌剂应用于生产实践提供了理论依据。






 DownLoad:
DownLoad: