-
白蜡虫(Ericerus pela (Chavannes))是一种重要的林业资源昆虫, 其主要寄主植物为白蜡树(Fraxinuschinensis Roxb.)和女贞(Ligustrum lucidum Ait.)。白蜡虫雄性二龄幼虫在寄主植物上分泌的次生代谢物质为白蜡。白蜡是我国的一种重要林副产品, 采用氢化铝锂还原法或皂化法提炼后能够得到高级烷醇[1-2]。高级烷醇能降低胆固醇, 促进细胞成熟[3-4]; 但是白蜡和高级烷醇均不溶于水, 限制了人们对白蜡及高级烷醇的开发和利用。笔者通过研究发现: 白蜡和白蜡高级烷醇能溶解到含有吐温80的水溶液中, 但吐温80易诱导细胞的脱粒作用[5]。因此, 用吐温作为白蜡及高级烷醇的增溶剂进行生物活性筛选时需要考虑其对细胞的安全性。
人真皮乳头细胞是毛囊生长调节的重要细胞, 它存在于毛囊的基底部位, 调控毛囊的生长、循环, 指导毛基质细胞分化形成毛干, 决定毛发的直径[6]。因此, 人真皮乳头细胞成为体外筛选脱发药物的首选细胞。考察药物对细胞生长的影响通常采用的方法有MTT法和MTS法, 这2种方法均是采用比色法检测细胞的生长, 其原理是MTT和MTS试剂被活细胞内的脱氢酶产生的NADPH或NADH还原为有色的甲臜, 而死细胞不能产生脱氢酶, 因此, 死细胞不能产生颜色。活细胞数量越多, 产生的甲臜越多, 培养基的颜色越深[7], 表明细胞增殖越旺盛。相对于MTT法, MTS法检测时间短, 安全性高, 重复性好[8]。因此, 本文采用MTS法研究不同用量的吐温80对人真皮乳头细胞生长的影响, 并考察在吐温80安全用量范围内白蜡及白蜡高级烷醇在水中的增溶量对人真皮乳细胞的增殖作用, 为白蜡及白蜡高级烷醇产品的开发和利用奠定理论基础。
HTML
-
白蜡及白蜡高级醇由本课题组提供; 人真皮乳头细胞(批号2365)、真皮乳头细胞生长培养基(批号184)、包被液(批号361)、消化液(批号322)购自美国Cell Applications。非那雄胺(M1122A)购自大连美仑生物科技有限公司。吐温80(分析纯)购自天津市风船化学试剂科技有限公司。DMSO(批号: 302A0328)购自北京索莱宝科技有限公司。倒置显微镜, 日本基恩士, 型号VHX-1000。
-
人真皮乳头细胞保存在液氮中, 临用前从液氮中取出, 在37℃水浴中融化后, 转移到用包被液处理过的T-75培养瓶中, 37℃, 5%CO2培养箱内培养过夜, 第2天更换完全培养基, 继续培养, 待细胞融合度达到90%, 用消化液消化, 采用台盼蓝法测定细胞的活力, 备用。
-
将吐温80配制成浓度为5%(w/v)的水溶液, 用灭菌水稀释成浓度250.00、125.00、62.50、31.25、15.60 μg·mL-1水溶液。
-
将白蜡溶解到5%吐温水溶液中, 制备成浓度1.00 mg·mL-1的白蜡水溶液(制备方法已申请专利), 用灭菌水稀释成浓度3.10、6.30、12.50、25.00、50.00 μg·mL-1的白蜡水溶液;
-
将白蜡高级烷醇溶解到1%吐温水溶液中, 制备成浓度2.00 mg·mL-1的白蜡高级烷醇水溶液(制备方法已申请专利), 用灭菌水稀释成浓度31.20、62.50、125.00、250.00、500.00 μg·mL-1的白蜡高级烷醇水溶液。
非那雄胺溶解到DMSO中配置成浓度0.74 μg·mL-1的溶液。
将上述溶液与培养基按1∶9混匀后, 备用。
-
人真皮乳头细胞(2.5×103个·孔-1)接种到96孔板中, 过夜, 更换含有不同浓度的吐温80培养基(终浓度为25.00、12.50、6.25、3.12、1.56 μg·mL-1)、白蜡培养基(终浓度为0.31、0.63、1.25、2.50、5.00 μg·mL-1)和白蜡高级烷醇培养基(终浓度为3.12、6.25、12.50、25.00、50.00 μg·mL-1), 同时设阴性对照(90 μL细胞悬液+10 μL培养基)、空白对照1(100 μL培养基)和空白对照2(90 μL培养基+10 μL相应浓度的吐温80水溶液), 阳性对照(0.074 μg·mL-1非那雄胺), 每个处理4个平行孔, 继续在37℃, 5%CO2培养箱内培养48 h后, 每孔加20 μL MTS试剂, 继续培养4 h, 用酶标仪490 nm测定各孔光密度(OD), 计算细胞增殖率, 吐温80对细胞作用效果计算公式[10]为:
白蜡及白蜡高级烷醇对细胞作用效果计算公式为:
同时采用倒置显微镜观察细胞生长情况。
-
采用SAS9.1统计软件中的ANOVA分析不同处理组细胞的增殖率和抑制率的平均值±SE, P < 0.05表明有显著性差异。
1.1. 试验材料
1.2. 细胞培养
1.3. 测试药液的配置
1.3.1. 吐温80水溶液
1.3.2. 白蜡水溶液
1.3.3. 白蜡高级烷醇水溶液
1.4. 吐温80、白蜡及白蜡高级烷醇液对人真皮乳头细胞生长的影响
1.5. 统计分析
-
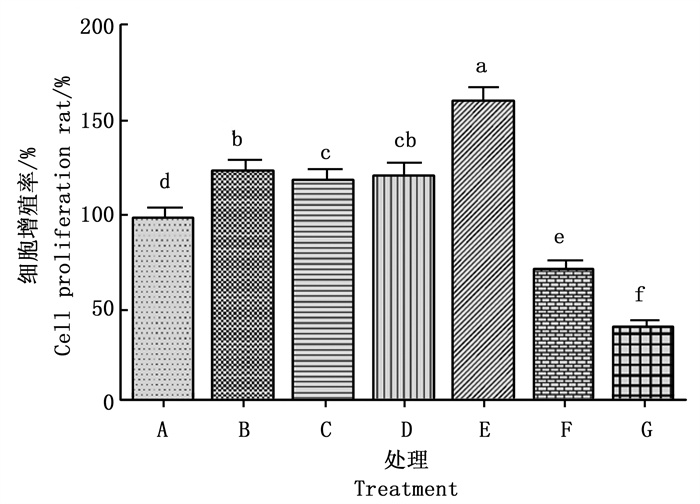
吐温80对人真皮乳头细胞生长的影响与其剂量存在明显量效关系。吐温80用量1.56~6.25 μg·mL-1时, 人真皮乳头细胞为梭形, 生长良好, 其生长状态与阴性细胞差异不明显, 细胞融合度达到70%~80%, 细胞增值率明显高于阴性对照, 并且随着吐温80用量的增加而增加。吐温80用量在12.50~25.00 μg·mL-1时, 人真皮乳头细胞溶胀、变圆、破裂, 有明显的细胞碎片, 细胞融合度只有5%~20%, 吐温80对细胞具有明显的抑制作用, 其抑制作用随着吐温80用量的增加而增加(图 1)。结果表明: 吐温80用量在1.56~6.25 μg·mL-1内人真皮乳头细胞能安全生长。
-
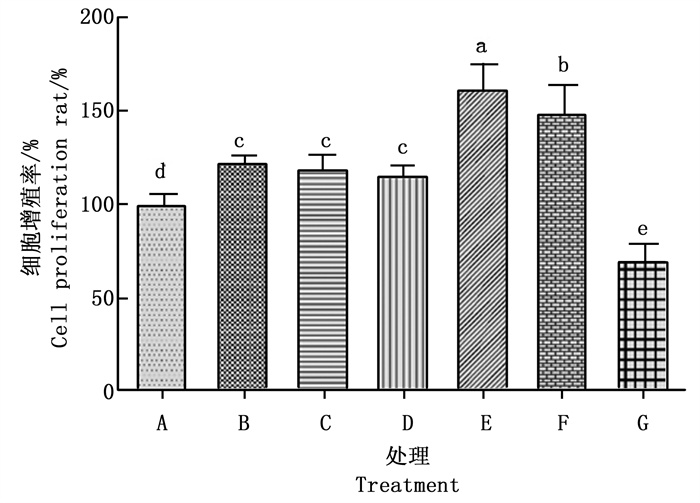
吐温80安全用量分别为1.56、3.12、6.25 μg·mL-1, 白蜡在水中相应的增溶量分别为0.31、0.63、1.25 μg·mL-1时, 人真皮乳头细胞生长良好, 细胞成梭形, 生长状态与阴性细胞相似, 细胞融合度达80%~90%, 白蜡对人真皮乳头细胞具有明显的增殖效果, 其增殖率随着剂量的增加而增加。白蜡的增溶量为1.25 μg·mL-1时, 对人真皮乳头细胞的增殖效果最明显, 其增殖率明显高于阴性对照和阳性对照; 白蜡增溶量为0.63 μg·mL-1时, 对人真皮乳头细胞的增殖率与阳性对照(非那雄胺)差异不明显; 增溶量为0.31 μg·mL-1时, 对人真皮乳头细胞的增殖作用明显低于阳性对照, 而高于阴性对照。吐温80用量为12.50~25.00 μg·mL-1, 相应的白蜡增溶量分别为2.5、5 μg·mL-1时, 人真皮乳头细胞溶胀、变圆、破裂, 有明显的细胞碎片, 细胞的融合度只有5%~20%, 人真皮乳头细胞的增值率明显降低, 且随着白蜡和吐温80用量的增加, 细胞的增殖率降低(图 2)。这表明, 在吐温80安全用量范围内, 0.31~1.25 μg·mL-1白蜡对真皮乳头细胞有明显的增殖作用。
-
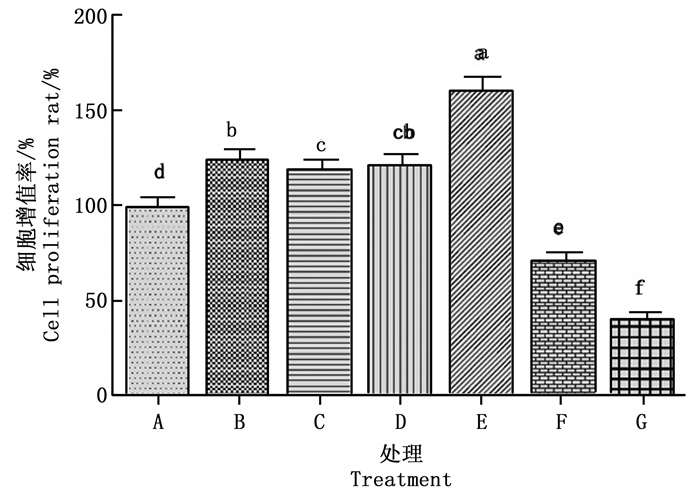
吐温80用量为1.56~12.50 μg·mL-1, 白蜡高级烷醇在水中相应的增溶量分别为3.12、6.25、12.50、25.00 μg·mL-1时, 人真皮乳头细胞成梭形, 生长良好, 细胞融合度达到90%~95%。白蜡高级烷醇对人真皮乳头细胞具有明显的增殖作用, 其中, 白蜡高级烷醇增溶量为12.50 μg·mL-1时, 人真皮乳头细胞的增殖率最高, 其次为白蜡高级烷醇增溶量为25.00 μg·mL-1时, 其对人真皮乳头细胞的增殖率明显高于阴性对照和阳性对照。吐温80用量为25.00 μg·mL-1时, 白蜡高级烷醇的增溶量为50.00 μg·mL-1时, 人真皮乳头细胞溶胀变圆, 部分细胞破碎, 细胞的融合度为50%左右。细胞的增殖率明显降低(图 3)。这表明, 吐温80用量为1.56~12.50 μg·mL-1时, 3.12~25.00 μg·mL-1白蜡高级烷醇对真皮乳头细胞有明显的增殖作用。
2.1. 不同用量吐温80对人真皮乳头细胞生长的影响
2.2. 白蜡对真皮乳头细胞的增殖作用
2.3. 白蜡高级烷醇对人真皮乳头细胞的增殖作用
-
白蜡和白蜡高级烷醇化学成分复杂, 分子量较大, 质轻, 在水中不溶, 影响了其开发利用。本研究发现, 白蜡及白蜡高级烷醇能溶解在以吐温80作为增溶剂的水溶液中, 但吐温80中含有的杂质或降解产物容易对细胞产生毒害作用[9], 而且不同细胞对吐温80的敏感程度不同, 如吐温80用量在0.1%~2%时对红细胞有溶血作用[10]; 用量为1%时对卵巢癌SKOV3有明显的抑制作用[11]; 而吐温80用量为0.05%~0.10%时对Caco-2细胞没有明显的毒害[12]。虽然吐温80对细胞的生长有一定的毒害作用, 但某些中药以吐温80作为增溶剂后, 其水溶液对红细胞的毒害作用小于吐温80本身对红细胞的作用, 如含有吐温80的细辛脑注射液对红细胞的溶血作用小于吐温80本身[13]。由此可见, 针对不同的细胞类型筛选合适的吐温剂量非常必要。本研究发现, 吐温80用量在1.56~6.25 μg·mL-1(含量为0.003%~0.006%)时对人真皮乳头细胞没有明显的毒害, 可用于试验。在吐温80用量为1.56~6.25 μg·mL-1, 白蜡水溶液浓度为0.31~1.25 μg·mL-1, 白蜡高级烷醇水溶液浓度为3.12~12.5 μg·mL-1时, 对人真皮乳头细胞的增殖率随水溶液中白蜡及白蜡高级烷醇用量的增加而增加, 表明白蜡和白蜡高级烷醇可促进人真皮乳头细胞的增殖, 白蜡和白蜡高级烷醇对人真皮乳头细胞的增殖效应还可能降低吐温80对人真皮乳头细胞的伤害。
《本草纲目》中记载白蜡能够促进毛发的生长[14], 但未见文献报道白蜡在细胞水平上对毛发生长的促进作用。高级烷醇自1949年被发现后, 其生物活性被大量而深入的研究和开发[15-17], 而高级烷醇对毛发生长作用方面的研究鲜见报道。此外, 对高级烷醇活性的研究多取材于植物, 如小麦[18]、甘蔗[19]的高级烷纯, 而对于昆虫的高级烷醇生物活性的研究鲜有报道。本研究以人真皮乳头细胞作为模式细胞, 研究白蜡及白蜡中提取的高级烷醇对毛发生长的促进作用, 结果表明, 在吐温80作为增溶剂条件下, 白蜡用量为0.31~1.25 μg·mL-1、高级烷醇用量为3.12~25.00 μg·mL-1时能促进体外人真皮乳头细胞的增殖。毛发的生长和脱发原因与多种因子相关, 本文虽然从体外细胞水平上证明白蜡和高级烷醇能促进人毛发的生长, 但对其更全面的科学评价, 还需要从动物模型等研究进一步明确其作用效果及作用机理。
-
(1) 吐温80作为增溶剂, 用量为1.56~6.25 μg·mL-1时人真皮乳头细胞能安全生长。
(2) 吐温80用量为1.56~6.25 μg·mL-1时, 白蜡的增溶量为0.31~1.25 μg·mL-1、白蜡高级烷醇的增溶量为3.12~12.50 μg·mL-1, 白蜡及白蜡高级烷醇水溶液能明显促进人真皮乳头细胞的增殖。







 DownLoad:
DownLoad: